人臍帶間充質干細胞來源工程化納米囊泡的制備與鑒定
李磊,杜飛躍,楊文杰
(南京今陽生物科技有限公司,江蘇南京 211899)
干細胞外泌體(Extracellular Vesicles,EVs)是由干細胞釋放的一種納米囊泡,內部包含蛋白質、脂質和核酸等多種生物分子,這些生物分子可以被其他細胞攝取,從而影響受體細胞的功能[1]。干細胞EVs可以用于治療多種疾病,包括心血管疾病[2]、神經退行性疾病[3]等。與干細胞療法相比,EVs 具有更好的安全性和更低的免疫原性,因此被認為是一種干細胞的替代療法[4]。盡管EVs 在治療上具有許多潛在優勢,但制備過程存在一些缺點:干細胞EVs 的產量通常比較低,難以進行大規模生產,生產成本高昂。這些缺點可能限制了EVs 的臨床應用[5-6]。
為了解決低產量問題,通過擠壓、研磨、超聲等破碎干細胞的技術產生工程化納米囊泡(Nanovesicles,NVs),成為一種新的具有潛力的生產方法[6-9]。其中,超聲破碎技術通過產生周期性的高頻振動波,在細胞中形成微氣泡并引發空化,細胞瞬間坍塌產生強大的流體力學剪切力,可以剪切和分解細胞膜,從而使細胞溶質(包括各種RNA、蛋白質)釋放到細胞外環境中,同時疏水/親水膜脂自動重組,隨機包裝周圍的RNA 和蛋白質,形成NVs[6]。已有研究證明,超聲處理的干細胞破碎液包含NVs,可以促進成纖維細胞增殖和遷移[6]。但是,干細胞破碎液中除了NVs 外,還包含有各種細胞內物質,如蛋白質、脂質、核酸、糖類、酶、激素、維生素、氨基酸等小分子,為了排除這些物質對NVs 特性的影響,項目組采用超聲破碎干細胞的方法制備NVs,根據傳統外泌體超速離心提取技術純化NVs,并對NVs 的形態、免疫表型、生物學活性進行分析。
1 材料與方法
1.1 儀器與材料
PBS 和DMEM/High Glucose 培養基,美國HyClone公司;α-MEM 培養基和胰蛋白酶-EDTA(0.25%),美國Gibco 公司;100×青霉素-鏈霉素,以色列BI公司;胎牛血清(FBS),澳大利亞Bovogen Biological 公司;重組Anti-TSG101 抗體(ab125011),英國Abcam公司;抗GAPDH 兔多克隆抗體和山羊抗兔IgG H&L(HRP),康為世紀生物科技有限公司;BCA 檢測試劑盒(增強型)、RIPA 蛋白裂解液(強)、PMSF 蛋白酶抑制劑、Western Blot 試劑盒、親水PVDF 膜、極超敏ECL 化學發光試劑和增強型CCK-8 試劑盒,上海碧云天生物技術有限公司。
Countess Ⅱ細胞計數儀,美國Invitrogen 公司;JY92-IIDN 超聲波細胞粉碎機,寧波新芝生物科技股份有限公司;L-90K 超速離心機,美國Beckman Optima公司;Tecnai 12 透射電子顯微鏡,荷蘭Philips 公司;Amersham Imager 600UV 多功能成像儀,美國GE 公司。
1.2 hUC-MSCs 培養
人臍帶間充質干細胞(hUC-MSCs)使用α-MEM培養基(包含10% FBS 和1%青霉素-鏈霉素)進行培養。將hUC-MSCs 按照5 000 cells/cm2密度接種于T175 培養瓶中,在37 ℃、5% CO2下培養,直到細胞達到90%~95%匯合度。使用胰蛋白酶-EDTA(0.25%)對hUC-MSCs進行消化,最終在PBS溶液中重懸細胞,并使用細胞計數儀檢測細胞數量和活力。
1.3 EVs 的制備
將80%匯合度的hUC-MSCs在無血清的α-MEM培養基中饑餓培養48 h。收集細胞培養上清液,以300×g離心10 min,16 500×g離心20 min,再用0.22 μm過濾器過濾上清。然后,在4 ℃條件下100 000×g 離心2 h,棄除上清液,用PBS 重懸EVs 顆粒,-80 ℃保存備用。
1.4 NVs 的制備
參考WANG 等[6]研究方法,經過改進后制備NVs,將1 mL 1.0×107hUC-MSCs 懸液轉移到4 mL EP 管,置于冰水混合物,實施超聲破碎。超聲條件:變幅桿型號φ3,超聲儀探頭置于液面下1 cm,功率900 W×40%,超聲2 s,關閉2 s,總超聲時間4 min,保護溫度25 ℃。在4 ℃條件下,細胞破碎液300×g離心5 min,以去除未破碎的細胞,16 500×g 離心20 min,以清除細胞碎片,將上清液通過0.45 μm 過濾器進行過濾,以除去殘留的細胞碎片和大粒徑囊泡等,獲得細胞裂解液(Lysate),在4 ℃條件下,細胞裂解液經100 000×g 超速離心2 h[11],棄除上清液,用PBS 重懸顆粒,即得NVs,在-80 ℃保存備用。
1.5 NTA 分析粒徑
NVs 和EVs 送至上海逍鵬生物科技有限公司進行NTA 測試。
1.6 TEM 鑒定形態
取20 μL NVs 或EVs 樣品滴在Parafilm 封口膜上,然后將Formvar/carbon 載樣銅網膜面朝下放在液滴上,室溫下靜置10 min。用鑷子將銅網取出,用吸水紙從銅網側邊吸干多余的樣品。然后用2%磷鎢酸溶液(pH6.4 ~7.0)負染2 min,將銅網取出,并用吸水紙從銅網側邊吸干液體,最后將銅網放置于紅外烘烤燈下干燥10 min,在TEM 下觀察囊泡的形態,并拍攝電鏡照片。
1.7 Western Blot 檢測TSG101
利用BCA 蛋白測定試劑盒確定NVs 或EVs 的蛋白質含量。每孔加樣蛋白質25 μg,進行聚丙烯酰胺凝膠電泳(SDS-PAGE),120 V 電泳60 min,冰水浴中300 mA 電轉印2.5 h,將NVs 和EVs 包含的蛋白質轉移到聚偏二氟乙烯(PVDF)膜。然后,室溫下用封閉液封閉PVDF 膜15 min,用洗滌液洗滌3 次,每次10 min,在4 ℃條件下用一抗重組Anti-TSG101 抗體、抗GAPDH 兔多克隆抗體孵育過夜,再用洗滌液洗滌3 次,每次10 min,室溫下用二抗山羊抗兔IgG H&L (HRP)孵育2 h,再用洗滌液洗滌3 次,每次10 min。最后利用ECL 化學發光試劑在多功能成像儀中曝光成像。
1.8 NVs 對HSF 增殖的影響
取對數生長期的人皮膚成纖維(HSF)細胞,重懸于含10%FBS、1%青霉素-鏈霉素和89% DMEM/High Glucose 培養基,以1 800 cell/孔的密度接種于96 孔板,每孔100 μL,37 ℃、5% CO2、飽和濕度培養48 h。更換含有25 μg/L Lysate、NVs 或EVs 的低血清培養基(1%FBS、99% DMEM/High Glucose),37 ℃、5% CO2、飽和濕度培養48 h。加入10 μL CCK-8溶液,37 ℃培養3 h 后,在450 nm 測定吸光度。按照公式(1)計算細胞增殖率。
1.9 統計學方法
采用SPSS 26.0 軟件進行數據處理,實驗均重復3 次,實驗數據用均數±標準差(x—±s)表示,P<0.05表示有統計學差異。多組間比較采用單因素方差分析,組間比較采用t檢驗。
2 結果與分析
2.1 粒徑
NTA 技術是利用光散射和布朗運動的特性獲得液體懸浮液中的樣本粒度分布,檢測結果顯示(圖1),NVs粒徑集中在100 nm左右,NVs粒徑(103.5±9.0)nm,EVs 粒徑(138.0±0.7)nm,在統計學上無顯著差異(P>0.05),符合一般外泌體的直徑大小。
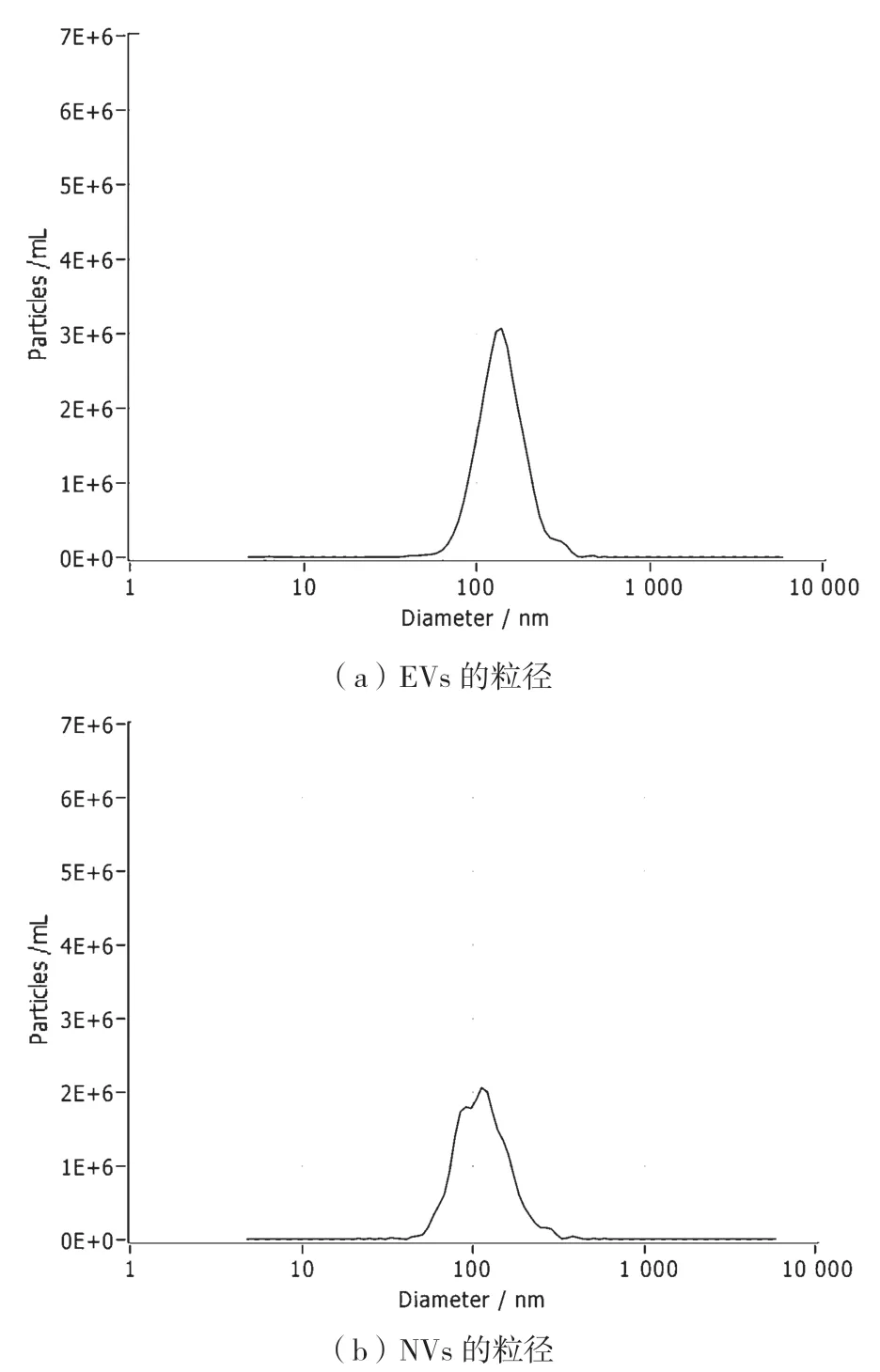
圖1 EVs 和NVs 的粒度分布
2.2 表面形態
NVs 和EVs 在TEM 下均觀察到100 nm 左右、呈杯墊狀圓形或橢圓形的膜型小囊泡,囊泡外周可見膜型結構,與外泌體的經典形態相似,見圖2。
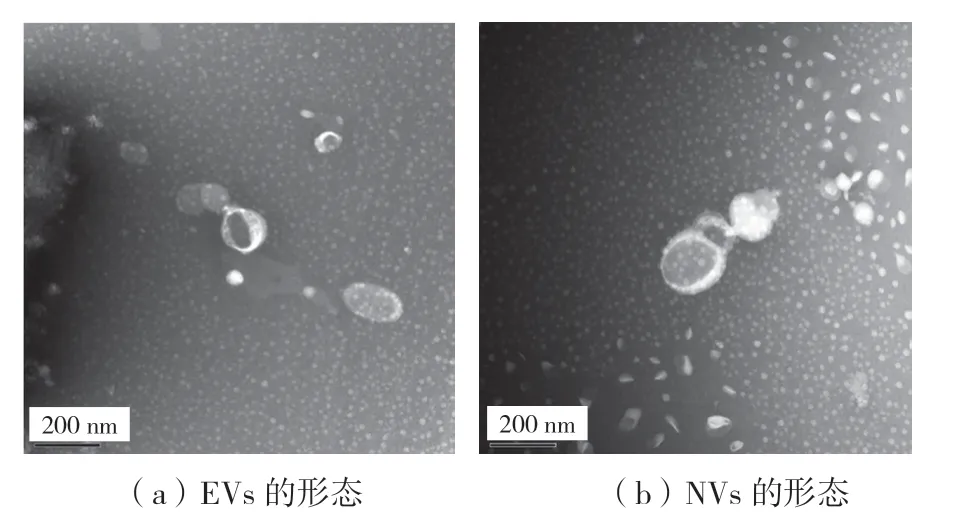
圖2 EVs 和NVs 在TEM 下的形態
2.3 蛋白質表達
采用Western Blot 分析相同總蛋白量下EVs 和NVs 中TSG101 的表達量,結果如圖3 所示。從圖中可以看出,NVs 包含的外泌體特征蛋白TSG101 含量遠遠低于EVs,這可能是組成NVs的膜主要是細胞膜,且在NVs 形成過程中隨機包裹的游離TSG101 蛋白總量也較少,導致了NVs 中檢測到的TSG 的含量低于EVs。
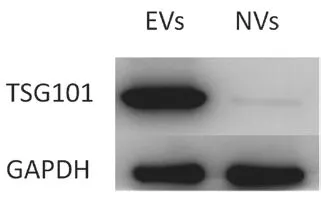
圖3 EVs 和NVs 中TSG101 表達結果
2.4 對成纖維細胞增殖的影響
如圖4 所示,超聲破碎hUC-MSCs 獲得的細胞裂解液、EVs 都能促進HSF 細胞的增殖,與對照組(PBS)相比均具有顯著性差異(P<0.01),且細胞裂解液對HSF 的促增殖效果優于EVs(P<0.05);而NVs對HSF 細胞的增殖沒有促進作用,細胞增殖情況與對照組(PBS)相似。
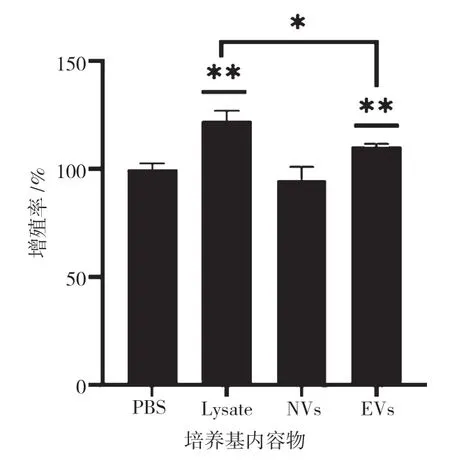
圖4 EVs 和NVs 對HSF 細胞增殖的影響
3 結論與討論
臍帶間充質干細胞被廣泛用于臨床研究,可治療多種疾病,其強大的治療效果與細胞因子的分泌、細胞外囊泡通信等相關[1]。在細胞外囊泡中,外泌體粒徑大小為30~150 μm,具有典型的茶托或杯狀結構,表達四跨膜蛋白分化簇(Clusters of Differentiation,CD),包括CD63、CD9 和CD81,此外還包含多泡體(Multivesicular Bodies,MVBs)合成相關的蛋白Alix 和TSG101 等[10]。外泌體還攜帶功能性mRNAs和miRNAs,可在細胞之間轉移[10]。有研究表明,臍帶間充質干細胞來源的外泌體富含一組microRNA(miR-21、-23a、-125b 和-145),通過抑制TGF-β2(轉化生長因子-β2,Transforming Growth Factor-β2)/SMAD2(Sam 和Mad 相關蛋白2,Sma- and Mad-related protein 2)通路來抑制肌成纖維細胞形成和瘢痕形成[11]。EVs 療法作為一種新型“無細胞”治療產品具有廣闊前景,但在其臨床應用之前仍有許多挑戰需要克服,主要為如何進行大規模、快速、低成本生產[4]。利用超聲從hUC-MSC 制備工程化納米囊泡(NVs)可能成為一種高效、快速、大量地生產囊泡的方法,該工程化NVs 與細胞分泌的EVs 的功能是否有差異,成為生產應用前必須了解的重要問題。
本文研究了NVs 的粒徑、形態、蛋白質表達等方面,并探討了NVs 對成纖維細胞增殖的影響。hUCMSC 經過超聲破碎,100 000×g、2 h 離心,可獲得粒徑大小集中在100 nm 左右的NVs,與標準EVs 粒徑比較無顯著差異,電鏡下為杯墊狀圓形的膜型小囊泡,幾乎不表達外泌體特征蛋白TSG101,對HSF 細胞的增殖沒有促進作用。這種NVs與EVs差異的形成,可能反映在NVs 形成的原理與EVs 不同。即EVs 是細胞外泌的一種囊泡,內含特定的蛋白質、脂質和核酸,具有特定的生物學活性[1];而工程化NVs 是在細胞膜分解后,隨機包裹周圍的核酸和蛋白質等形成的囊泡,包裹的成分容易受到環境中內容物的濃度、種類等影響,且組成囊泡的磷脂雙分子層中蛋白質等成分也是隨機的,因此,其形成的囊泡功能也相對會受到影響。
綜上所述,本研究旨在探索來源于hUC-MSCs 的工程化NVs 的制備和鑒定方法。通過特征分析,成功建立了一套制備和純化工程化NVs 的方法,并發現從hUC-MSCs 中獲得的NVs 在形態上與細胞分泌的EVs 相似,但在功能上存在區別。為將NVs 應用于臨床治療中,有必要引入靶向分子和功能成分,以實現特定的治療效果。

