HYOU1對高糖環境施萬細胞自噬和凋亡的影響及其機制
周晨明,薛巖,孟麗,朱艷,徐彥楠
1 河北醫科大學大型科研儀器設備共享服務平臺,石家莊050017;2 河北醫科大學第二醫院神經內科;3 河北醫科大學教學實驗中心
糖尿病是由于胰島素分泌和(或)胰島素作用缺陷引起的代謝紊亂,患者以高血糖、高血脂和負氮平衡為主要表現[1]。糖尿病周圍神經病是糖尿病常見的并發癥,其發病與節段性脫髓鞘、軸索損傷有關,是引起患者下肢截肢、殘疾和神經性疼痛的重要原因[2]。施萬細胞是周圍神經系統較為豐富的神經膠質細胞,構成血液—神經界面,不僅是軸突的被動絕緣體,還可動態調節神經纖維的生物學特性,為軸突提供代謝支持,調節外周神經功能[3-4]。施萬細胞功能障礙在糖尿病周圍神經病變的發生發展中發揮重要作用[5]。自噬通過回收受損的細胞器和錯誤折疊的蛋白,能夠維持細胞穩態和細胞正常的生長與功能[6]。凋亡信號通過多種途徑驅動細胞死亡,如線粒體控制信號途徑、死亡受體連接信號或內質網應激介導的信號通路如JAK-STAT通路、ROS/PI3K/AKT通路等[7]。在高糖誘導的施萬細胞中,抗凋亡因子Bcl-2下調,促凋亡因子Bax上調,細胞色素C釋放[8],凋亡和自噬增強[9]。細胞代謝異常導致活性氧(ROS)累積,易引起凋亡相關基因表達,激活細胞凋亡程序。PI3K/AKT信號通路參與細胞存活、周期、凋亡和物質代謝等生物學過程,與多種腫瘤細胞的凋亡密切相關[10]。本課題組對高糖刺激的大鼠施萬細胞RSC96進行轉錄測序,發現高糖能下調內質網分子伴侶復合物缺氧上調基因1(HYOU1)的表達。HYOU1屬于HSP70家族,應激狀態如缺氧可導致HYOU1在內質網內大量聚集,參與蛋白質的折疊和分泌[11]。有研究發現,HYOU1可保護缺氧環境下的神經元細胞,其機制與抑制凋亡有關[12]。2022年5月—2023年6月,本研究觀察了HYOU1對高糖環境施萬細胞自噬和凋亡的影響,并基于凋亡相關通路探討相關機制。現報告如下。
1 材料與方法
1.1 細胞與主要實驗材料 原代大鼠施萬細胞株RSC96購自中國科學院上海生命科學研究院細胞資源中心。細胞復蘇后置于DMEM培養基中,放置在37 ℃、5% CO2培養箱中進行培養;待細胞融合達80%時,加入0.05%胰蛋白酶消化,完成傳代培養,取第3代細胞進行實驗。兔抗HYOU1抗體購自Abcam公司,小鼠抗GAPDH抗體購自Proteintech公司,RIPA強效裂解液購自上海碧云天公司。BCA蛋白定量試劑盒購自南京凱基公司,逆轉錄試劑盒購自Thermo公司,SYBR Green PCR試劑盒購自Thermo公司,細胞培養箱購自Thermo公司,超凈工作臺(型號SW-CJ-1FD)購自于蘇州安泰科技有限公司,電泳儀(型號Mini Protean 3 Cell)購自Bio-Rad公司,酶標儀(型號MK3)購自Thermo公司。
1.2 HYOU1重組表達質粒的構建 根據設計的HYOU1擴增引物,以人胎腦cDNA文庫中的cDNA為模板,以PCR方法擴增HYOU1全長基因序列。對擴增出的PCR產物,進行1%瓊脂糖凝膠電泳,以Lambda DNA EcoRⅠ/Hind Ⅲ標記為DNA相對分子質量,預期獲得大小約為1 785 bp的HYOU1序列全長。將pEG-FP-C1載體和HYOU1 PCR片段分別采用Bg1Ⅱ和EcoRⅠ雙酶切后,以凝膠回收純化產物。將兩個片段采用T4 DNA連接酶于16 ℃過夜連接;取5 μL連接產物轉化到DH5α大腸桿菌中,于37 ℃下過夜培養。挑取單克隆菌落,接種在含有卡那霉素的LB培養基中。將充足質粒pEGFP-HYOU1到Invitrogen公司完成序列分析。
1.3 細胞分組及質粒轉染 取第三代RSC96細胞,制成單細胞原液,采用10.0%胎牛血清的DMEM培養基,以1×104/mL接種于96培養板中。采用隨機數字表法將細胞分為高糖組、高糖+對照質粒組和高糖+HYOU1質粒組。三組均采用高糖培養,其中高糖+對照質粒組和高糖+HYOU1質粒組分別轉染對照質粒和pEGFP-HYOU1質粒,根據Lipofectamine轉染試劑說明進行操作。采用免疫熒光法檢測轉染細胞中HYOU1蛋白,高糖組、高糖+對照質粒組只見藍色熒光的胞核、胞質未見紅色熒光,高糖+HYOU1質粒組胞質中可見紅色熒光,說明高糖+HYOU1質粒組細胞中有HYOU1蛋白表達。見OSID碼圖1。各組細胞培養72 h進行后續操作。
1.4 自噬相關蛋白檢測 采用Western blotting法檢測自噬相關蛋白LC3、ATG5、ATG12、Beclin1、p62[11]。預冷PBS并洗滌組織1次,加入200 μL的RIPA裂解液,剝離勻漿器勻漿;于冰上裂解蛋白10 min,4 ℃下以12 000 r/min離心15 min,將離心后的上清分裝到0.5 mL的離心管中。根據BCA蛋白定量試劑盒說明書完成蛋白濃度的測定。經電泳、轉膜及封閉后,采用TBST將一抗按比例稀釋,將膜與一抗孵育,于4 ℃下過夜;采用TBST稀釋HRP標記的二抗,將稀釋的二抗與膜孵育45 ~ 60 min;將膜置于凝膠成像系統中進行發光等操作,采用凝膠圖像分析軟件測定各蛋白條帶的灰度值。以β-actin為內參。以目的蛋白灰度值與內參蛋白灰度值表示目的蛋白相對表達量。
1.5 細胞凋亡指標檢測 各組培養48 h后加入胰蛋白酶完成細胞消化,2 000 r/min離心5 min,預冷PBS清洗2次,重懸細胞;避光加入Annexin V-FITC 5 μL,輕輕混合均勻后,孵育15 min,加入PI 5 μL,輕輕混合均勻后,孵育5 min,1 h內上流式細胞儀檢測凋亡細胞,計算總凋亡率。總凋亡率=早期細胞凋亡率+中晚期細胞凋亡率。采用RT-PCR法檢測Bax、Bcl-2 mRNA。
1.6 JAK/STAT通路相關蛋白檢測 采用Western blotting法檢測JAK/STAT通路相關蛋白JAK1、JAK2、STAT1、STAT3、STAT5、STAT6。
1.7 ROS/PI3K/AKT通路相關蛋白檢測 通過Western blotting法檢測PI3K、AKT、mTOR、pPI3K、pAKT、pmTOR蛋白。采用DCFH-DA染色檢測各組ROS水平。
1.8 統計學方法 采用SPSS26.0軟件。計量資料以表示,組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞中自噬相關蛋白表達比較 高糖+HYOU1質粒組LC3、ATG5、ATG12、Beclin1蛋白表達低于高糖組和高糖+對照質粒組,p62蛋白表達高于高糖組和高糖+對照質粒組(P均<0.05)。見表1。
表1 各組細胞中自噬相關蛋白表達比較()

表1 各組細胞中自噬相關蛋白表達比較()
注:與高糖組相比,*P<0.05;與高糖+對照質粒組相比,#P<0.05。
組別高糖+HYOU1質粒組高糖+對照質粒組高糖組p62 2.50 ± 0.59*#2.48 ± 0.57 1.12 ± 0.19 LC3 1.29 ± 0.23*#2.73 ± 0.61 2.75 ± 0.63 ATG5 0.86 ± 0.14*#2.89 ± 0.64 2.90 ± 0.66 ATG12 0.95 ± 0.17*#2.71 ± 0.58 2.73 ± 0.60 Beclin1 0.93 ± 0.16*#2.43 ± 0.54 2.45 ± 0.56
2.2 各組凋亡率、凋亡相關基因、JAK/STAT通路蛋白表達比較 高糖+HYOU1質粒組凋亡率、Bax mRNA表達低于高糖組和高糖+對照質粒組,Bcl-2 mRNA表達高于高糖組和高糖+對照質粒組(P均<0.05),見表2。高糖+HYOU1質粒組JAK1、JAK2、STAT1、STAT3、STAT5、STAT6蛋白表達高于高糖組和高糖+對照質粒組(P均<0.05),見表3。
表2 各組細胞凋亡率、凋亡相關基因表達比較()
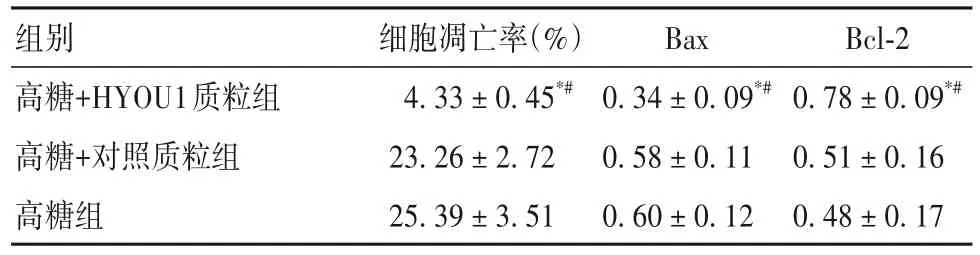
表2 各組細胞凋亡率、凋亡相關基因表達比較()
注:與高糖組相比,*P<0.05;與高糖+對照質粒組相比,#P<0.05。
Bcl-2 0.78 ± 0.09*#0.51 ± 0.16 0.48 ± 0.17組別高糖+HYOU1質粒組高糖+對照質粒組高糖組細胞凋亡率(%)4.33 ± 0.45*#23.26 ± 2.72 25.39 ± 3.51 Bax 0.34 ± 0.09*#0.58 ± 0.11 0.60 ± 0.12
表3 各組細胞中JAK/STAT通路蛋白表達比較()
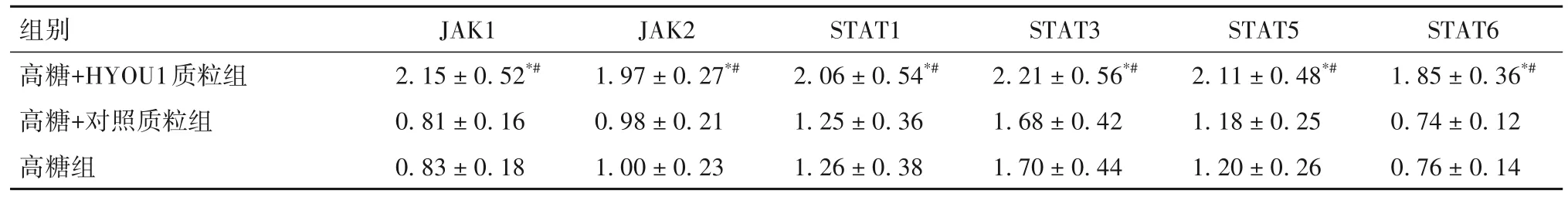
表3 各組細胞中JAK/STAT通路蛋白表達比較()
注:與高糖組相比,#P<0.05;與高糖+對照質粒組相比,*P<0.05。
組別高糖+HYOU1質粒組高糖+對照質粒組高糖組STAT6 1.85 ± 0.36*#0.74 ± 0.12 0.76 ± 0.14 JAK1 2.15 ± 0.52*#0.81 ± 0.16 0.83 ± 0.18 JAK2 1.97 ± 0.27*#0.98 ± 0.21 1.00 ± 0.23 STAT1 2.06 ± 0.54*#1.25 ± 0.36 1.26 ± 0.38 STAT3 2.21 ± 0.56*#1.68 ± 0.42 1.70 ± 0.44 STAT5 2.11 ± 0.48*#1.18 ± 0.25 1.20 ± 0.26
2.3 各組細胞中ROS/PI3K/AKT通路相關蛋白表達比較 高糖+HYOU1質粒組PI3K、AKT、mTOR、pPI3K、pAKT、pmTOR蛋白表達高于高糖組和高糖+對照質粒組,ROS水平低于高糖組和高糖+對照質粒組(P均<0.05)。見表4。
表4 各組細胞中ROS/PI3K/AKT通路蛋白表達比較()
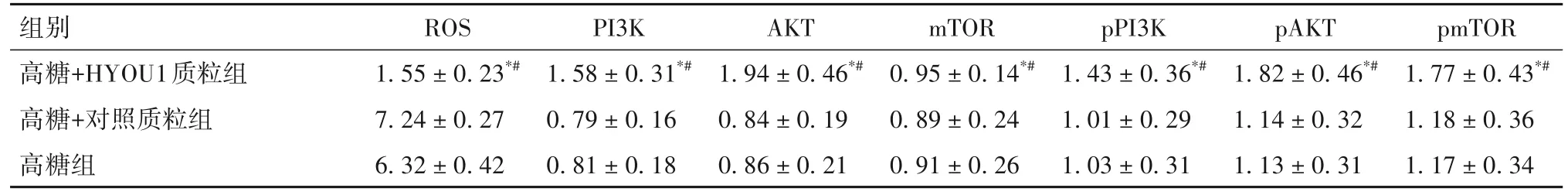
表4 各組細胞中ROS/PI3K/AKT通路蛋白表達比較()
注:與高糖組相比,*P<0.05;與高糖+對照質粒組相比,#P<0.05。
組別高糖+HYOU1質粒組高糖+對照質粒組高糖組pmTOR 1.77 ± 0.43*#1.18 ± 0.36 1.17 ± 0.34 ROS 1.55 ± 0.23*#7.24 ± 0.27 6.32 ± 0.42 PI3K 1.58 ± 0.31*#0.79 ± 0.16 0.81 ± 0.18 AKT 1.94 ± 0.46*#0.84 ± 0.19 0.86 ± 0.21 mTOR 0.95 ± 0.14*#0.89 ± 0.24 0.91 ± 0.26 pPI3K 1.43 ± 0.36*#1.01 ± 0.29 1.03 ± 0.31 pAKT 1.82 ± 0.46*#1.14 ± 0.32 1.13 ± 0.31
3 討論
研究表明,糖尿病周圍神經病的發病與長期高糖狀態使外周神經長期受到氧化應激刺激有關[13]。施萬細胞作為周圍神經膠質細胞,能直接參與人體周圍神經的形成及發育過程,在修復受損神經中發揮了重要的作用。有研究表明,長期糖尿病狀態可導致施萬細胞凋亡[14]。此外,高糖刺激下的施萬細胞凋亡隨著炎癥細胞的浸潤而加劇[15]。施萬細胞凋亡是糖尿病周圍神經病變的重要病理特征。本課題組對高糖刺激的大鼠施萬細胞(RSC96)進行轉錄組測序發現,差異基因的富集分析顯示,富集在內質網分子伴侶復合物的差異基因與正常糖組相比均出現下調,其中包括HYOU1。因此推測高糖誘導施萬細胞的自噬抑制與調亡可能與HYOU1下調有關。本研究中,高糖+HYOU1質粒組自噬相關蛋白LC3、ATG5、ATG12、Beclin1表達低于高糖組和高糖+對照質粒組,p62表達高于高糖組和高糖+對照質粒組,細胞凋亡率低于高糖組和高糖+對照質粒組,這表明HYOU1施萬細胞高表達后,能降低高糖狀態下施萬細胞的自噬水平并抑制細胞凋亡。分析原因:HYOU1是粗面內質網內進行蛋白質質量控制的重要組成成分,主要由分子伴侶、輔助分子和蛋白修飾酶構成。越來越多的研究表明,內質網分子伴侶復合物異常與糖尿病及其并發癥的發生有關。持續的高糖狀態能引起HYOU1表達下調,而上調HYOU1表達能為糖尿病周圍神經病治療提供新的思路和方法[16]。
施萬細胞的自噬及凋亡的發生常伴有相關信號通路的共同參與,如JAK/STAT通路。細胞內一類分子JAK在接受上游受體分子信號后,能迅速募集于受體上并發生活化,而活化JAK催化受體后能發生酪氨酸磷酸化,并激活STAT3,被激活的兩個STAT分子形成二聚體并轉移到細胞核,并與細胞核中靶基因啟動子中的DNA特異性結合,進而對其下游靶基因進行調控[17]。有研究發現,在1型糖尿病大鼠模型的背根神經節,失調的JAK/STAT通路傳導可導致感覺神經元中線粒體功能障礙,引起大鼠坐骨神經的沃勒變性[13]。也有研究表明,睫狀神經營養因子可通過JAK/STAT信號傳導使受損的線粒體生物能量正常化,增強軸突再生和防止糖尿病纖維變性的能力[16]。Bax和Bcl-2是調控細胞凋亡過程中的重要因子。當細胞受到損傷時,細胞內信號轉導途徑被激活,能促進凋亡蛋白Bax的活性,使線粒體膜的通透性增加,大量細胞色素C穿過膜組織進入細胞質,激活細胞的凋亡途徑,促進細胞凋亡。本研究中,高糖+HYOU1質粒組JAK/STAT通路相關蛋白JAK1、JAK2、STAT1、STAT3、STAT5、STAT6表達高于高糖組和高糖+對照質粒組;高糖+HYOU1質粒組與高糖組和高糖+對照質粒組相比,Bax mRNA表達降低、Bcl-2 mRNA表達升高,進一步驗證了HYOU1高表達能夠抑制高糖狀態下施萬細胞的自噬和凋亡。
ROS是機體受到刺激時產生的一組不穩定、含氧的活性分子化合物的統稱,具有較高的化學活性,對生物體及細胞的生理活動發揮重要的調節作用。當機體處于生理狀態下且無外界刺激時,ROS生成量較少,當細胞代謝異常產生大量活性氧超過抗氧化系統的還原能力時,細胞處于氧化應激狀態,易引起凋亡相關基因的表達,繼而激活細胞凋亡程序[18]。ROS/PI3K/AKT通路可以調控炎癥因子的釋放、氧化應激、細胞凋亡和自噬,在糖尿病的發生展過程中起重要作用。有研究表明糖尿病周圍神經病中施萬細胞的PI3K/AKT通路被明顯抑制[19],在高糖環境下,施萬細胞中磷酸化AKT表達顯著降低,AKT活化抑制[20]。本研究結果顯示,高糖+HYOU1質粒組ROS水平低于高糖組和高糖+對照質粒組,而PI3K、AKT、mTOR、pPI3K、pAKT、pmTOR蛋白表達高于高糖組和高糖+對照質粒組,提示HYOU1過表達后,能激活糖尿病施萬細胞中的ROS/PI3K/AKT通路,影響相關蛋白的表達,進而調控細胞的自噬和凋亡。
綜上所述,HYOU1過表達可下調高糖環境施萬細胞的自噬和凋亡,可能與調控ROS/PI3K/AKT通路有關,以上結果為糖尿病周圍神經病的防治提供了一定理論基礎。

