高考化學電化學選擇題速解法
陳文初

隨著新能源的興起和普及,關于電化學的研究越來越受到重視,高考中電化學知識的考查在高考試題中占比也越來越高。2022年廣東高考題中出現了兩道考查電化學知識的選擇題,總分值為6分;2023年更是增加到三道題,總分值達到10分。這顯示了在廣東高考化學試題中基礎性試題和綜合性試題都在加強電化學知識的考查。本文通過對近兩年廣東高考電化學相關選擇題的綜合分析,總結了該類試題的常考知識點和解題技巧,從而提高學生的解題效率和學習信心。
一、基礎性電化學選擇題分析及解題策略
【例1】(2022年廣東卷第10題) 以熔融鹽為電解液,以含Cu、Mg和Si等的鋁合金廢料為陽極進行電解,實現Al的再生。該過程中()
A.陰極發生的反應為Mg-2e-=Mg2+
B.陰極上Al被氧化
C.在電解槽底部產生含Cu的陽極泥
D.陽極和陰極的質量變化相等
【解析】根據電解原理可知,電解池中陽極發生失電子的氧化反應,陰極發生得電子的還原反應,該題中以熔融鹽為電解液,含Cu、Mg和Si等的鋁合金廢料為陽極進行電解,通過控制一定的條件,從而可使陽極區Mg和Al發生失電子的氧化反應,分別生成Mg2+和Al3+,Cu和Si不參與反應,陰極區Al3+得電子生成Al單質,從而實現Al的再生。A項,陰極應該發生得電子的還原反應,實際上Mg在陽極失電子生成Mg2+,A錯誤;B項,Al在陽極上被氧化生成Al3+,B錯誤;C項,陽極材料中Cu和Si不參與氧化反應,在電解槽底部可形成陽極泥,C正確;D項,因為陽極除了鋁參與電子轉移,鎂也參與了電子轉移,且還會形成陽極泥,而陰極只有鋁離子得電子生成鋁單質,根據電子轉移數守恒及元素守恒可知,陽極與陰極的質量變化不相等,D錯誤;故選C。
【例2】(2023年廣東卷第6題)負載有Pt和Ag的活性炭,可選擇性去除Cl-實現廢酸的純化,其工作原理如圖1所示。下列說法正確的是()
A.Ag作原電池正極
B. 電子由Ag經活性炭流向Pt
C.Pt表面發生的電極反應:O2+2H2O+4e-=4OH-
D. 每消耗標準狀況下112L的O2,最多去除1mol Cl-
【解析】O2在Pt得電子發生還原反應,Pt為正極。根據題意和圖示,Cl-在Ag極失去電子發生氧化反應,Ag為負極。A.由分析可知,Cl-在Ag極失去電子發生氧化反應,Ag為負極,A錯誤;B.電子由負極Ag經活性炭流向正極Pt,B正確;C.溶液為酸性,電極方程式不能出現OH-,Pt表面發生的電極反應應為O2+4H++4e-=2H2O,C錯誤;D.根據電極反應關系式:4e-~O2~4Cl-,每消耗標準狀況下112L即05mol O2,可除2mol Cl-,D錯誤。故選B。
【解題策略】
1.運用基本的電極方程式書寫和離子的放電順序等知識。
(1)電解電解質水溶液時,陽極放電順序為:活性金屬陽極(Au 、Pt 除外)>S2->I- > Br->Cl->OH->含氧酸根離子 。
如果是熔融鹽電解液,陽極含多種金屬,則按照金屬活動順序,活潑金屬優先放電,較不活潑的金屬通常還沒來得及放電就已經脫落陽極成為陽極泥。
(2)電解電解質水溶液時,陰極放電順序為:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+> Mg2+>Na+>Ca2+>K+。
陽離子放電,其順序大體可參照金屬活動順序來推斷。位于金屬活動順序表后面的金屬,其對應的陽離子優先得到電子。
2.熟悉運用電化學腐蝕的基本原理。
電化學腐蝕的分類:
(1)析氫腐蝕——腐蝕過程中不斷有氫氣放出
①條件:潮濕空氣中形成的水膜,酸性較強(水膜中溶解有CO2、SO2、H2S等氣體)
②電極反應:
負極: Fe-2e-=Fe2+
正極: 2H++2e-=H2↑
總式:Fe+2H+=Fe2++H2↑
(2)吸氧腐蝕——反應過程吸收氧氣
①條件:堿性或中性或弱酸性溶液
②電極反應:
負極: 2Fe-4e-=2Fe2+
正極: O2+4e-+2H2O =4OH-
總式:2Fe+O2+2H2O=2Fe(OH)2。
二、綜合性電化學選擇題分析及解題策略
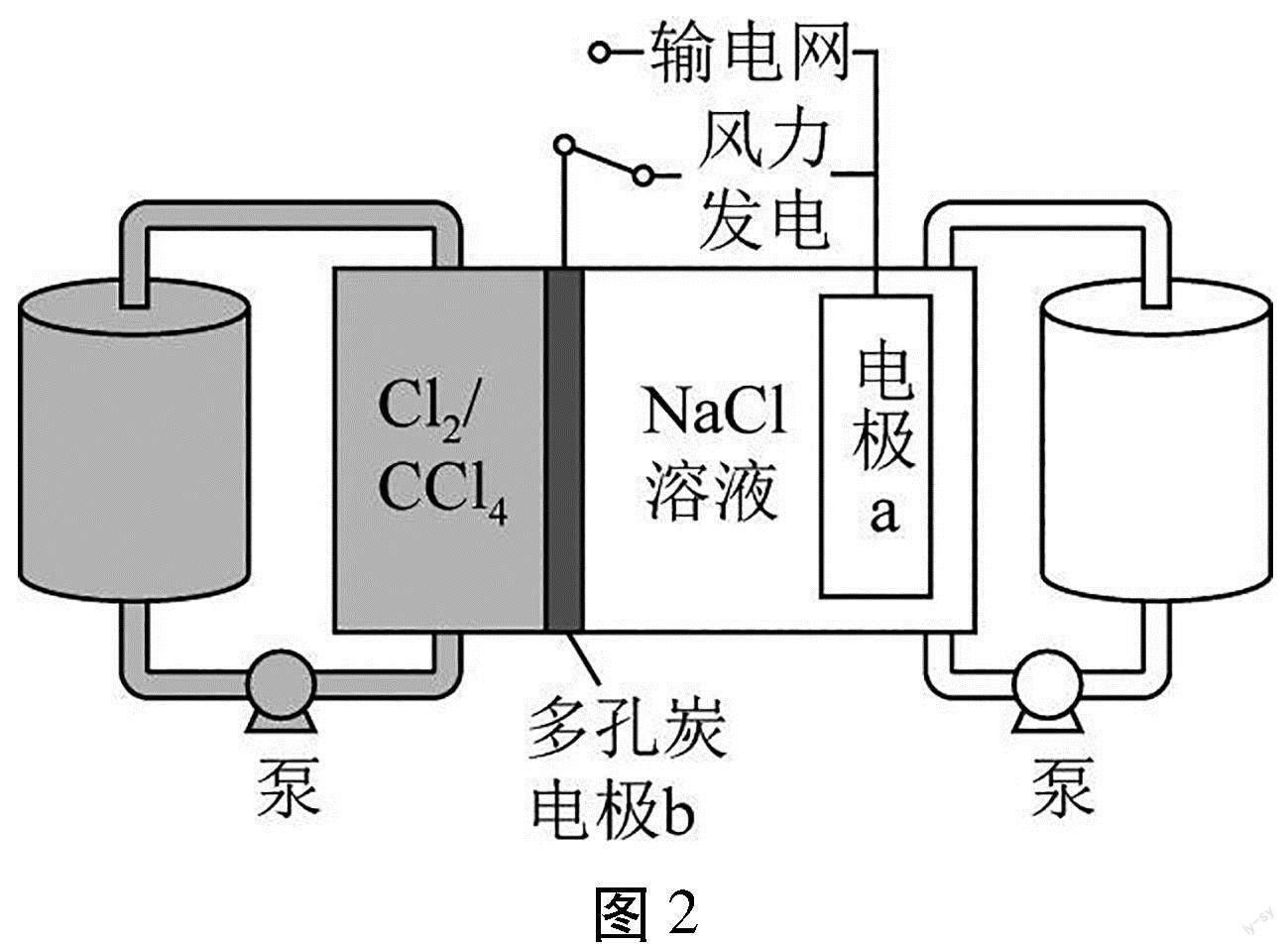
【例3】(2022年廣東卷第16題)科學家基于Cl2易溶于CCl4的性質,發展了一種無需離子交換膜的新型氯流電池,可作儲能設備(如圖2)。充電時電極a的反應為:
NaTi2(PO4)3+2Na++2e-Na3Ti2(PO4)3。下列說法正確的是()
A.充電時電極b是陰極
B.放電時NaCl溶液的pH減小
C.放電時NaCl溶液的濃度增大
D.每生成1molCl2,電極a質量理論上增加23g
【解析】A項,由充電時電極a的反應可知,充電時電極a發生還原反應,所以電極a是陰極,則電極b是陽極,故A錯誤;B項,放電時電極反應和充電時相反,則由放電時電極a的反應為Na3Ti2(PO4)3-2e-NaTi2(PO4)3+2Na+,正極反應為Cl2+2e-=2Cl-,可知,NaCl溶液的pH不變,故B錯誤;反應后Na+和Cl-濃度都增大,則放電時NaCl溶液的濃度增大,故C正確;D項,充電時陽極反應為2Cl--2e-=Cl2↑,陰極反應為NaTi2(PO4)3+2Na++2e-Na3Ti2(PO4)3,由得失電子守恒可知,每生成1molCl2,電極a質量理論上增加23g/mol×2mol=46g,D錯誤;故選C。
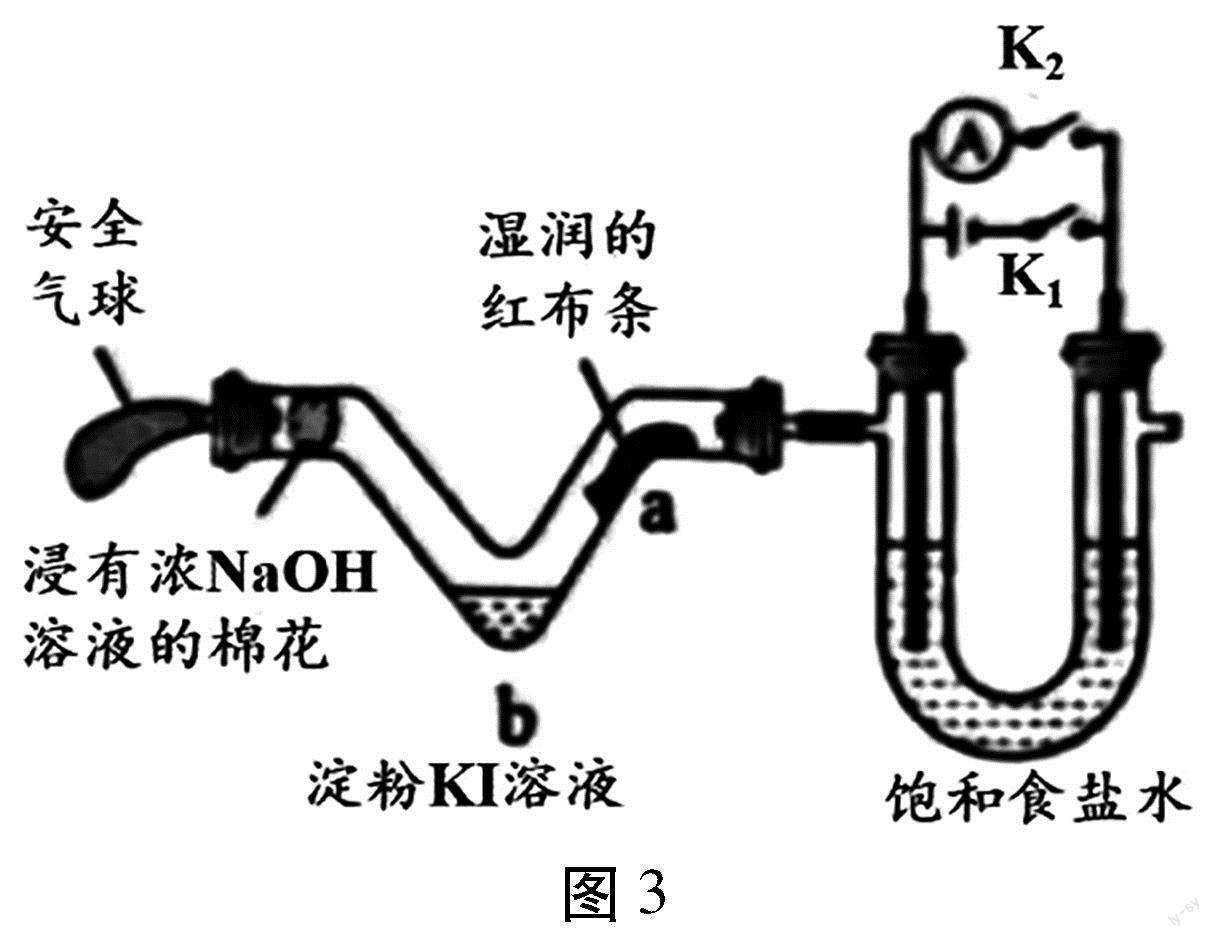
【例4】(2023年廣東卷第13題)利用活性石墨電極電解飽和食鹽水,進行如圖3所示實驗。閉合K1,一段時間后()
A.U型管兩側均有氣泡冒出,分別是Cl2和O2
B.a處布條褪色,說明Cl2具有漂白性
C.b處出現藍色,說明還原性:Cl->I-
D.斷開K1,立刻閉合K2,電流表發生偏轉
【解析】閉合K1,形成電解池,電解飽和食鹽水,左側為陽極,陽極氯離子失去電子生成氯氣,電極反應為2Cl--2e-=Cl2↑,右側為陰極,陰極電極反應為2H2O+2e-H2↑+2OH-,總反應為2NaCl+2H2O電解2NaOH+H2↑+Cl2↑。A.根據分析,U型管兩側均有氣泡冒出,分別是Cl2和H2,A錯誤;B.左側生成氯氣,氯氣遇到水生成HClO,具有漂白性,則a處布條褪色,說明HClO具有漂白性,B錯誤;C.b處出現藍色,發生Cl2+2KII2+2KCl,說明還原性:I->Cl-,C錯誤;D.斷開K1,立刻閉合K2,此時構成氫氯燃料電池,形成電流,電流表發生偏轉,D正確;故選D。
【例5】(2023年廣東卷第16題)用一種具有“卯榫”結構的雙極膜組裝電解池(如圖4所示),可實現大電流催化電解KNO3溶液制氨。工作時,H2O在雙極膜界面處被催化解離成H+和OH-,有利于電解反應順利進行。下列說法不正確的是()
A. 電解總反應:KNO3+3H2ONH3·H2O+2O2↑+KOH
B. 每生成1mol NH3·H2O,雙極膜處有9 mol的H2O解離
C. 電解過程中,陽極室中KOH的物質的量不因反應而改變
D. 相比于平面結構雙極膜,“卯榫”結構可提高氨生成速率
【解析】A.由分析中陰陽極電極方程式可知,電解總反應為KNO3+3H2ONH3·H2O+ 2O2↑+ KOH,故A正確;B.每生成1molNH3·H2O,陰極得8mole-,同時雙極膜處有8mol H+進入陰極室,即有8mol的H2O解離,故B錯誤;C.電解過程中,陽極室每消耗4molOH-,同時有4mol OH-通過雙極膜進入陽極室,KOH的物質的量不因反應而改變,故C正確;相比于平面結構雙極膜,“卯榫”結構具有更大的膜面積,有利于H2O被催化解離成H+和OH-,可提高氨生成速率,故D正確;故選B。
【解題策略】 近兩年的廣東高考化學試題均有原電池和電解池結合的綜合性電化學題選擇題,難度較大。但只要充分運用以下基本的原電池和電解池原理去解答,也可以比較快地準確做出判斷。
1.電子、離子的移動方向:首先要明確電子只能在導線或固體電極上傳遞,而不能從電解質溶液中通過,離子可以通過電解質溶液或者固體電解質(即電子不下水,離子不上岸),電流從電勢高的正極流向負極。
(1)電子移動方向:原電池電子從負極沿導線流向正極;電解池電子從直流電源負極流出,流入陰極,再從陽極流出,流入直流電源正極。
(2)離子的移動方向:原電池:正正負負;電解池:陰陽相吸。即原電池帶正電的離子(陽離子)移向正極,帶負電的離子(陰離子)移向負極;電解池陽離子向陰極移動,陰離子向陽極移動。
2.電極反應的判斷:電化學中發生氧化反應(失去電子)的電極為陽極或負極,發生還原反應(得到電子)的電極為陰極或正極。規律:負極、陽極發生氧化反應(失去電子),正極、陰極發生還原反應(得到電子)。
(1)看選項所給正極、陰極反應式是否為“+xe-”;負極、陽極反應式是否為“-xe-”。
(2)判斷是充電還是放電;所給反應的反應物是否正確(有時放電反應的題目會給出充電時的反應)。
(3)考慮反應環境對產物的影響,如酸性環境不能生成OH-。
3.可充電電池:充電要求“正接正,負接負”,即充電時電池的負極與電源的負極相連作陰極,電池的正極與電源的正極相連作陽極。電極反應特點:負極與陰極相反,正極與陽極相反。
4.溶液pH(物質)變化:電解質溶液pH的變化與溶液中c(H+) 或c(OH-)的變化有關,在解題中注意分析電極反應或總反應方程式中c( H+)或c(OH-)的變化。電極附近的pH變化要看電極反應,電解質溶液的pH變化要看總反應。一般電解池pH變化:“陰盛陽衰”,即陰極pH增大,陽極pH減小。
5.電極產物的判斷及電化學的相關計算: 在電化學中電極產物是與電解質接觸的,因此判斷電極產物時不要忽略介質(電解質)參與反應,相關量計算時的主要依據為電子守恒, 即在串聯電路中,通過每個電極的電子數均相等,相關量計算時遵循電子守恒。
(1)電極產物的判斷:反應物得失電子后在電解質溶液中要能穩定存在,即判斷電極產物時不要忽略介質。如當KOH溶液為電解質時,CH4燃料電池中碳元素對應產物不是CO2,而是CO32-。
(2)相關量的計算要以電極反應或總反應為依據,遵循電子守恒。熟記常見電子與物質間計算關系式:4e-~O2~2H2~2Cu~2Cl2~4Ag~4H+~4OH-。涉及氣體體積,首先要看一下有沒有“標準狀況”,然后再進行計算。
三、基于選擇題的速解策略
實際上,在熟悉掌握原電池和電解池的基本工作原理和規律后,對于大多數選擇題,還有更快更高效的解法,堪稱“秒殺技巧”。這里另選取幾道全國高考電化學試題為例來分析。
【例6】(2022全國甲卷)一種水性電解液Zn-MnO2離子選擇雙隔膜電池如圖5所示(KOH溶液中,Zn2+以Zn(OH)2-4存在)。電池放電時,下列敘述錯誤的是()
A.Ⅱ區的K+通過隔膜向Ⅲ區遷移
B.Ⅰ區的SO2-4通過隔膜向Ⅱ區遷移
C.MnO2電極反應:MnO2+2e-+4H+=Mn2++2H2O
D.電池總反應:Zn+4OH-+MnO2+4H+=Zn(OH)2-4+Mn2++2H2O
【秒殺技巧】對于原電池,首先判斷正負極。右邊的Zn為活潑金屬,而左邊的MnO2為氧化性物質,故可判斷左邊MnO2為正極,右邊的Zn為負極,根據電池中離子移動規律“正向正,負向負”,K+應向左邊的Ⅰ區遷移,故A錯誤,選A。
下列敘述錯誤的是( )
A.充電時Na+從鈉電極向硫電極遷移
B.放電時外電路電子流動的方向是a→b
C.放電時正極反應
D.炭化纖維素紙的作用是增強硫電極導電性能
【秒殺技巧】作為電池,顯然活潑金屬一極鈉電極為負極,充電時變成電解池,負極外接負極做陰極。根據電解池中離子移動規律“陰向陽,陽向陰”,Na+應向陰極鈉電極遷移,故A錯誤,選A。
【速解策略】準確判斷出兩極,很多問題即可迎刃而解。通過判斷電極的正與負、陰與陽,明確裝置中微粒的遷移方向,電路中電子的流向,一般就可以確定若干選項的正誤。同時,對教材中典型的電化學裝置,如銅鋅原電池、氫氧燃料電池、電解飽和食鹽水模型、鉛蓄電池的基本原理要理解透徹。只有在吃透教材中典型電化學裝置的基礎上,才能很好地構建解題模型,梳理解題思路,完成知識的遷移,才能做到以不變應萬變。

