腸道菌群通過NLRP3介導神經炎癥調節rmTBI導致的記憶功能障礙*
汪家文,李佳潔,2,吳 君,吳文鑫,楊 林
(1.貴州醫科大學法醫學院/法醫司法鑒定中心,貴陽,550004;2.貴州醫科大學生物與工程學院/健康醫藥現代產業學院,貴陽 550004)
創傷性腦損傷(traumatic brain injury,TBI)已成為全球公共衛生問題,據統計全球每年約有1 000萬人受TBI影響[1]。TBI是長期殘疾及多種慢性神經性疾病如帕金森病、腦卒中、記憶功能損傷、抑郁和神經退行性疾病的主要原因之一[2-4]。中、重度TBI患者一般能得到及時救助,而輕度TBI患者由于器質性變化不明顯而延誤治療,進而面臨著重復損傷的風險,即重復輕度創傷性腦損傷(rmTBI)[5-7]。胃腸道是微生物最多的器官,10萬億~100萬億的微生物生活在結腸中[8]。已有研究表明,帕金森病、腦卒中、記憶功能損傷和抑郁都與腸道菌群有關,TBI發生后腸道菌群結構也發生改變[9-10]。而rmTBI發生后腸道菌群如何變化,少見報道。
急性TBI可引起腸道菌群失調,24 h內可導致加塞乳桿菌、黃色瘤胃球菌和腹真桿菌數量明顯減少,而溝真桿菌和福瑪馬文布蘭菌數量明顯增加[11]。TBI后缺血性腦卒中也會導致嚴重的腸道菌群失調,且與腦損傷的程度和預后有關[12-14]。腸道菌群有助于恢復核苷酸結合寡聚化結構域樣受體3(NLRP3)介導的神經炎癥和慢性乙醇暴露(CEE)誘導的抑郁樣行為,腸道菌群失調也可以導致小鼠腦組織小膠質細胞活化和神經炎癥反應,從而加劇腦損傷[15-16]。恢復腸道菌群失調,有望給TBI帶來治療效果。
腦-腸-微生物軸三者之間相互作用的改變在許多疾病的發生、發展中扮演著重要角色[17]。rmTBI常常伴隨著炎癥的發生,例如rmTBI發生后,NLRP3炎癥小體可被激活,從而激活caspase-1,形成活化的炎性體。caspase-1進一步剪切白細胞介素(interleukin,IL)-1β和IL-18前體,形成其成熟體,并通過消皮素D(gasdermin-D,GSDMD)-N介導的質膜孔釋放,從而誘導NLRP3炎性細胞焦亡[18-19]。腸道菌群可通過腦-腸-微生物軸來調節神經炎癥,而腸道微生物移植能有效地緩解炎癥反應從而改善神經功能障礙[20-25]。
糞菌移植(fecal microbiota transplantation,FMT)是一種通過把正常糞便中的細菌混合物轉移到患者腸道中而引入新的菌群的方法,該法可使脊髓損傷和缺血性腦卒中后的腸道菌群失調正常化,從而發揮保護神經的作用[13,26-27]。FMT還可通過使TBI后腸道菌群正常化從而達到緩解神經功能缺損的作用[28]。FMT能否使rmTBI后腸道菌群正常化而改善rmTBI導致的神經功能障礙,尚不清楚。本研究擬通過建立rmTBI大鼠模型,研究大鼠rmTBI后腸道菌群失調與其神經功能障礙的關系,以及FMT是否能通過調節NLRP3/caspase-1/IL-18炎癥通路來恢復這種失調,影響神經功能效力,從而緩解rmTBI后腸道菌群紊亂、神經炎癥、神經功能障礙而發揮治療作用。
1 材料與方法
1.1 實驗動物
6周齡SD雄性大鼠購自長沙天勤生物技術有限公司。動物操作程序按照動物保護和使用委員會的規定進行,并經貴州醫科大學動物中心批準(批準號:NJMU-1807003)。實驗開始前1周,所有大鼠均于光暗循環新環境適應性喂養,大鼠自由獲得食物和水。然后隨機將大鼠分為4組:對照(contorl,con)組,rmTBI組,rmTBI+生理鹽水灌胃(rmTBI+saline)組,rmTBI+糞便溶液灌胃糞菌移植(rmTBI+FMT)組。
1.2 方法
1.2.1rmTBI模型建立
使用單擺撞擊裝置構建rmTBI模型。32只大鼠用異氟烷麻醉后將其暴露在單擺撞擊裝置的平臺上進行撞擊。每天進行5次撞擊,連續進行5 d。
1.2.2FMT治療
FMT懸浮液制備:9:00-11:00取大鼠新鮮糞便,置于-80 ℃冰箱保存。使用前解凍,以生理鹽水稀釋為200 mg/mL的糞便懸浮液,并在標準混合器中均化,置于離心機內2 000 r/min離心10 min,收集懸浮液用于FMT。FMT:每天損傷大鼠2 h后對rmTBI+saline組、rmTBI+FMT組大鼠分別進行200 μL生理鹽水和糞便懸浮液灌胃,在rmTBI結束后繼續灌胃2 d。
1.2.3Morris水迷宮實驗
將大鼠輕輕放入直徑1.5 m的水池當中,池子分為4個象限,水池里的水沒過平臺2 cm,并與鈦白粉混合以隱藏平臺,水溫(25±3)℃。平臺處于第三象限中部,如果大鼠找到逃逸平臺(潛伏期),實驗結束;若在120 s內未找到平臺,則將大鼠引導到平臺上休息15 s,每天3次。分別從第一象限、第二象限、第四象限放入,持續4 d。于第5 d撤去平臺,隨機選一個象限將大鼠輕輕放入水池中,記錄大鼠60 s內的運動路徑、距離、在目標象限停留的時間、穿越平臺的次數及時間;若60 s內未找到平臺,則潛伏期記為60 s。
1.2.4組織處理
各組大鼠用戊巴比妥鈉麻醉。然后灌注磷酸鹽緩沖液(PBS)和4%多聚甲醛溶液,仔細解剖、分離大鼠腦組織。部分大鼠腦組織進行腦含水量檢測,其余浸泡于4%多聚甲醛溶液固定1周。取海馬腹側組織,石蠟包埋、切片并進行免疫組織化學染色(IHC)及蘇木素-伊紅(HE)染色。
1.2.5腦水腫程度測定
使用干濕法測定大鼠腦水腫程度。使用10%水合氯醛麻醉,經心灌注生理鹽水后處死大鼠,取出腦組織,沿正中線切開,分離出左右半球,立即稱濕重。然后放入100 ℃烤箱中48 h烤干,再迅速稱量腦組織干重。計算腦含水量(%)=(濕重-干重)/濕重×100%。
1.2.6HE染色
切片經70 ℃烤1 h,依次在二甲苯Ⅰ、二甲苯Ⅱ、100%→80%→60%梯度乙醇脫蠟水合后滴加蘇木素染核,1%鹽酸酒精分化,稀氨水返藍后滴加 1%伊紅染色液,經自來水沖洗后脫水透明,中性樹膠封片。
1.2.7ELISA法檢測NLRP3、caspase-1、IL-18、IL-1β表達水平
取大鼠外周血血清,分別從NLRP3、caspase-1、IL-18、IL-1β試劑盒中取出板條,分為標準品孔、0值孔、樣品孔和空白孔,分別在標準品孔、0值孔和樣品孔中加入不同濃度的標準品,樣品稀釋液各50 μL,辣根過氧化物酶(HRP)100 μL,空白孔不加,封板膜封口,恒溫避光孵育1 h。棄去板內液體,吸水紙拍干,洗滌液洗滌后向所有孔中加入底物混合液100 μL,恒溫箱避光孵育15 min,加入反應終止液50 μL,酶標儀上450 nm處測所有孔的吸光度值(A值)。
1.2.8IHC法檢測大鼠海馬區膠質纖維酸性蛋白(GFAP)、離子鈣接頭蛋白1(Iba-1)表達水平
切片經70 ℃烤1 h,用二甲苯Ⅰ、二甲苯Ⅱ、100%→80%→60%梯度乙醇脫蠟水合后用3% H2O2孵育,去除內源性過氧化物酶,然后置于乙二胺四乙酸(EDTA)抗原修復液中進行高壓修復。滴加山羊血清封閉液,在37 ℃培養箱中孵育30 min,然后加入各種靶蛋白的一抗,在4 ℃下孵育過夜。一抗包括GFAP(GTX108711,1∶500稀釋,美國Gene Tex公司)和Iba-1(GTX100042,1∶200稀釋,美國Gene Tex公司)。在PBS中沖洗3次后,滴加山羊抗兔二抗,室溫孵育1 h。PBS洗3次用二氨基聯苯胺(DAB)顯色液顯示信號,用蘇木素對細胞核進行雙染色,然后在自來水下沖洗15 min.最終脫水透明后用中性樹膠封口。
1.2.916S rRNA測序
使用糞便基因組DNA提取試劑盒(TianGen)提取大鼠糞便DNA,使用1%瓊脂糖凝膠電泳檢測所提取DNA的純度及濃度。按照常規流程操作方法獲 得PCR擴增產物,使用濃度為2%的瓊脂糖凝膠電泳檢測,對合格的PCR產物進行磁珠純化,通過酶標定量法根據PCR產物的濃度進行等量混樣,充分混勻后再使用2%的瓊脂糖凝膠電泳檢測。使用通用型DNA純化回收試劑盒(TianGen)回收目的條帶產物。使用NEB Next?UltraTMⅡ FS DNA PCR-free Library Prep Kit(New England Biolabs)構建文庫,對構建好的文庫進行Qubit和實時熒光定量PCR(qPCR)定量,待文庫檢測合格后,使用NovaSeq 6000進行PE250上機測序。
1.3 統計學處理
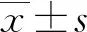
2 結 果
2.1 rmTBI后大鼠記憶功能障礙及FMT的治療作用
大鼠的水迷宮蹤跡見圖1A。結果顯示,rmTBI可引起記憶功能障礙,表現為:大鼠穿越平臺的次數明顯減少(P<0.01,圖1B),潛伏期明顯增長(P<0.001,圖1C);使用FMT干預后,大鼠的記憶功能得到了恢復(圖1B、C)。4組大鼠的游泳速度差異無統計學意義(P>0.05,圖1D),排除了大鼠因為游泳能力不同導致空間記憶功能差異的可能性。

A:代表性大鼠蹤跡圖;B:大鼠穿越平臺次數組間比較;C:大鼠第1次找到平臺時間(潛伏期)組間比較;D:大鼠游泳速度組間比較;①:con組;②:rmTBI組;③:rmTBI+saline組;④:rmTBI+FMT組;*:P<0.05,**:P<0.01,***:P<0.001;ns:P>0.05。
2.2 FMT改善rmTBI后腦水腫程度
con組、rmTBI組、rmTBI+saline組、rmTBI+FMT組腦含水量分別為77.3%±0.9%、80.3%±1.2%、81.9%±1.5%、76.4%±2.1%,rmTBI組和rmTBI+saline組差異無統計學意義(P>0.05),相比于con組明顯增多(P<0.05);與rmTBI組和rmTBI+saline組相比,rmTBI+FMT組大鼠腦含水量明顯減少(P<0.05)。
2.3 組織病理學改變
病理學結果顯示:與con組相比,rmTBI組、rmTBI+saline組、rmTBI+FMT組大鼠大腦海馬區神經細胞及腦血管周隙明顯增寬;與rmTBI組、rmTBI+saline組相比,經FMT治療后大鼠海馬區神經細胞及腦血管周隙明顯減小,腦水腫程度明顯減輕,見圖2。

圖2 海馬區病理學改變(HE染色)
2.4 ELISA法檢測大鼠血清中NLRP3、caspase-1、IL-1β、IL-18表達
血清學結果顯示:與con組相比,rmTBI組及rmTBI+saline組大鼠血清NLRP3、caspase-1、IL-18表達水平均明顯升高(P<0.01),rmTBI組大鼠血清IL-1β表達水平明顯升高(P<0.01)。rmTBI組和rmTBI+saline組大鼠組間血清NLRP3、caspase-1、IL-18表達水平差異均無統計學意義(P>0.05),IL-1β表達水平較rmTBI組明顯降低(P<0.05)。與rmTBI組及rmTBI+saline組相比,經FMT干預治療后,大鼠血清NLRP3、caspase-1、IL-18表達水平均明顯降低(P<0.05)。與rmTBI組相比,FMT干預后大鼠血清IL-1β表達水平明顯降低(P<0.001),與rmTBI+saline組相比差異無統計學意義(P>0.05),見圖3。

A:大鼠血清NLRP3水平組間比較;B:大鼠血清caspase-1水平組間比較;C:大鼠血清IL-18水平組間比較;D:大鼠血清IL-1β水平組間比較;①:con組;②:rmTBI組;③:rmTBI+saline組;④:rmTBI+FMT組;*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1;ns:P>0.05。
2.5 IHC檢測大鼠海馬區GFAP、Iba-1表達水平
IHC檢測大鼠海馬區GFAP、Iba-1表達,結果顯示:rmTBI組和rmTBI+saline組大鼠海馬區GFAP、Iba-1表達水平無明顯差異(P>0.05)。與con組相比,rmTBI組和rmTBI+saline組大鼠海馬區GFAP、Iba-1表達水平明顯升高(P<0.05)。與rmTBI組和rmTBI+saline組相比,rmTBI+FMT組大鼠海馬區GFAP、Iba-1表達水平明顯降低(P<0.05),見圖4。

A:隨機選取不同標本同一位置0.1 mm×0.1 mm面積內Iba-1陽性表達統計分析;C:隨機選取不同標本同一位置0.1 mm×0.1 mm面積內GFAP陽性表達統計分析;①:con組;②:rmTBI組;③:rmTBI+saline組;④:rmTBI+FMT組;*:P<0.05,**:P<0.01,***:P<0.001;ns:P>0.05。
2.6 門分類水平豐度分布
根據物種注釋結果,在門水平上選取排名前10的門從高到低分別是:厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidota)、變形菌門(Proteobacteria)、酸桿菌門(Acidobacteriota)、綠彎菌門(Chloroflexi)、放線菌門(Actinobacteriota)、脫硫桿菌門(Desulfobacterota)、疣微菌門(Verrucomicrobiota)、彎曲桿菌門(Campilobacterota)、黏菌門(Myxococcota)。其中厚壁菌門、擬桿菌門均大量存在于各個樣品中,所占比例高,是構成腸道菌群的優勢菌門。除此之外,各個樣品的菌門所占比例也不相同。例如rmTBI組樣品4中厚壁菌門相對豐度高達67%;con組樣品3中擬桿菌門相對豐度高達58%。
2.7 屬分類水平豐度分布
在屬分類水平上,豐度排名前10的菌屬依次是:乳酸菌屬(Muribaculaceae)、乳桿菌屬(Lactobacillus)、普氏菌屬(Prevotella)、毛螺球菌科-NK4A136屬(Lachnospiraceae-NK4A136-group)、普雷沃菌科-Ga6A1屬(Prevotellaceac-Ga6A1-group)、理研菌科-RC9屬(Rikenellaceae-RC9-gut-group)、羅姆布茨菌屬(Romboutsia)、擬桿菌屬(Bacteroides)、梭狀芽胞桿菌-UCG-014屬(Clostridia-UCG-014)、瘤胃菌屬(NK4A214-group)。每個樣品間菌屬構成比例差異較大。例如:con組樣品2中Muribaculaceae屬相對豐度為45%;con組樣品5中Muribaculaceae屬相對豐度為23%,Muribaculaceae屬在大鼠個體間差異較大。
2.8 腸道菌群、神經功能障礙、神經炎癥相關性分析
腸道菌群、神經功能障礙與神經炎癥存在不同的相關性。腸道菌群變化與神經功能障礙、神經炎癥具有一定相關性,表現為Shannon指數與大鼠潛伏期(r=-0.810)、GFAP(r=-0.721)、Iba-1(r=-0.680)呈負相關,與穿越平臺次數呈正相關(r=0.723);Simpson指數與GFAP呈負相關(r=-0.628)。神經功能障礙與神經炎癥也具有一定相關性,表現為潛伏期與GFAP(r=0.809)、Iba-1(r=0.803)呈正相關,穿越平臺次數與GFAP(r=-0.832)、Iba-1(r=-0.749)呈負相關。除此之外,腸道菌群失調與神經功能障礙、神經炎癥等多項指標均存在不同的相關性,見表1。

表1 Simpson指數、Shannon指數、炎癥因子、記憶功能障礙指標相關性分析(r)
3 討 論
腸道菌群受多因素的影響,包括性別、遺傳因素、飲食、年齡、藥物和壓力等。近年來,TBI模型已被用于研究腸道微生物組中宿主與微生物之間的相互作用,從而加深對大腦與腸道菌群之間相互調節機制的理解。腸道菌群失調可通過腦-腸-微生物軸影響神經功能,因此神經功能障礙患者更易發生腸道菌群失調,如認知功能障礙、神經免疫功能等神經功能障礙[29-30]。在rmTBI發生后腸道菌群改變,表現為有益菌[如嗜黏蛋白阿克曼菌(Akkermansia)、糖化假絲酵母菌(Candidatus-Saccharimonas)等]減少而有害菌(如Romboutsia)增多,這種紊亂可導致神經行為改變,進而導致神經功能障礙。
rmTBI常常伴隨著神經炎癥反應的發生和神經功能障礙。神經炎癥是機體的一種防御反應機制,適當的神經炎癥可通過促進組織修復與除去細胞碎片而對大腦起到保護作用,相反,持續的炎癥反應會激活固有免疫細胞,從而導致疾病的發生[31],進而產生神經功能障礙。研究表明,小膠質細胞、星形膠質細胞、神經元細胞是神經炎癥中最重要的三類細胞,神經炎癥加重了抑郁、阿爾茨海默病、認知功能障礙和神經退行性疾病等神經功能障礙的發生,調節星形膠質細胞-小膠質細胞之間的交互對話可以維持神經元結構和功能的完整性,從而達到維持神經系統內環境的穩定和治療神經退行性疾病的目的[32-34]。
腦小膠質細胞、星形膠質細胞的激活受多種因素的影響。Iba-1是一種鈣結合蛋白,可以特異性地結合巨噬細胞和激活的小膠質細胞;GFAP作為主要的炎癥性中樞神經系統疾病標志物,主要存在于成熟的星形膠質細胞內。本研究證實,當rmTBI發生后,腸道菌群穩態被破壞,小膠質細胞、星形膠質細胞被激活。腸道菌群失調可間接影響小膠質細胞、星形膠質細胞功能的促炎和抗炎細胞因子循環水平的改變。當腸道菌群的復雜結構受到破壞時,小膠質細胞尤其受到影響。研究表明,神經元和星形膠質細胞合作促進小膠質細胞分支,誘導小膠質細胞特征基因表達[35]。當神經元所處的微環境穩態被打破時,則會釋放出“信號”分子,通過配體-受體的結合,誘導小膠質細胞活化[36]。
腸道微生物成員的細菌產物或代謝物如三甲胺、短鏈脂肪酸(short-chain fatty acids,SCFAs)是調節小膠質細胞成熟、形態和功能的關鍵因子[37-38]。SCFAs可能通過腸黏膜進入體循環中,進而影響神經系統功能。本研究結果證實,糞便微生物移植可以抑制小膠質細胞、星形膠質細胞的激活,進而減少神經元細胞的焦亡,改善神經功能障礙。然而,腸道菌群影響小膠質細胞、星形膠質細胞激活的機制尚不清楚,推測可能與腸道微生物成員的細菌產物或者代謝物有關,如三甲胺、SCFAs等。總之,本研究發現腸道菌群的穩態對rmTBI后神經炎癥和神經功能障礙至關重要,FMT減少了神經炎癥的發生,改善了rmTBI后的神經功能障礙,為腸道微生物在大腦損傷后固有免疫系統中的免疫反應提供了證據,有助于理解和治療rmTBI后神經炎癥和認知功能損傷、抑郁、空間記憶功能損傷和阿爾茨海默病等神經功能障礙。
rmTBI可導致腸道菌群失調,表現為腸道菌群豐度增多而多樣性下降,有益菌數量減少而致病菌增多,NLRP3/caspase-1/IL-18炎癥通路被激活,同時導致記憶功能損傷;而FMT能有效地使失調的腸道菌群正常化,同時調節NLRP3/caspase-1/IL-18炎癥通路使其表達下調,并對rmTBI造成的記憶功能損傷具有恢復作用。

