低強(qiáng)度脈沖超聲作用于膝骨關(guān)節(jié)炎炎癥相關(guān)信號通路的研究進(jìn)展
歐陽輝,林星瑾,王金英,沈龍彬,王成棟
1 暨南大學(xué)附屬第一醫(yī)院,廣東 廣州 510630;
2 暨南大學(xué),廣東 廣州 510620
膝骨關(guān)節(jié)炎(knee osteoarthritis,KOA)是一種由多因素引起的以軟骨侵蝕、滑膜炎癥、軟骨下骨增厚及骨贅形成為病理改變,涉及關(guān)節(jié)及關(guān)節(jié)周圍組織結(jié)構(gòu)病變的全關(guān)節(jié)疾病。危險因素包括年齡、性別、肥胖、創(chuàng)傷和代謝等[1-3]。KOA 在我國的致殘率約為53%,是第三大致殘疾病[4]。其發(fā)病主要涉及關(guān)節(jié)軟骨的合成和分解代謝的失衡,細(xì)胞因子的啟動與其密切相關(guān)。研究顯示,骨關(guān)節(jié)炎病理改變涉及軟骨細(xì)胞、破骨細(xì)胞、成骨細(xì)胞、滑膜中的成纖維細(xì)胞和單核細(xì)胞等多種細(xì)胞類型[5]。關(guān)節(jié)軟骨損傷后白細(xì)胞介素-1β(interleukin-1β,IL-1β)、IL-6 和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)高表達(dá),其中IL-1β 和TNF-α 是促進(jìn)炎癥發(fā)展及誘導(dǎo)軟骨下骨破壞的關(guān)鍵細(xì)胞因子,其出現(xiàn)于KOA 的多條致病信號通路中,調(diào)控KOA 的細(xì)胞內(nèi)活動,在軟骨細(xì)胞破壞、細(xì)胞外基質(zhì)減少、軟骨重塑異常、軟骨下骨化和滑膜炎癥等病理過程中扮演重要的角色[5-6]。目前臨床不斷尋求藥物或非藥物治療方法來調(diào)控軟骨代謝或阻斷促炎因子的表達(dá),以期促進(jìn)軟骨修復(fù)或抑制軟骨破壞[7-8]。國內(nèi)外指南均提倡針對KOA 以非藥物治療為首選,包括患者教育、運動治療及物理治療等[9-10]。超聲治療作為一種無創(chuàng)安全的物理治療手段,在KOA 的治療上已經(jīng)有60多年的歷史[11],研究較多且療效較好的強(qiáng)度為0.02~1 W/cm2、頻率為1~3 MHz 的低強(qiáng)度脈沖超聲(low-intensity pulsed ultrasound,LIPUS)。LIPUS 作用于KOA 具有減輕關(guān)節(jié)炎癥、緩解疼痛、促進(jìn)軟骨再生和保護(hù)軟骨的作用[12-13]。通過對LIPUS 作用于KOA 炎癥相關(guān)信號通路的研究進(jìn)展進(jìn)行綜述,可以為LIPUS的臨床應(yīng)用尋找最佳干預(yù)方案。
1 LIPUS的作用機(jī)制
LIPUS 是一種機(jī)械波,其聲能可通過介質(zhì)傳播到組織間和細(xì)胞內(nèi),在組織細(xì)胞內(nèi)產(chǎn)生微氣泡和微射流,引起分子間的振動和碰撞,產(chǎn)生非熱效應(yīng)和熱效應(yīng),從而使組織細(xì)胞產(chǎn)生一系列生物效應(yīng)。其中非熱效應(yīng)主要包括空化效應(yīng)、聲流和機(jī)械刺激等[14]。而關(guān)節(jié)組織對機(jī)械刺激非常敏感,適度的機(jī)械刺激可調(diào)節(jié)關(guān)節(jié)的穩(wěn)態(tài),維持軟骨的正常代謝[15]。既往研究發(fā)現(xiàn),LIPUS 通過非熱效應(yīng)在治療骨折和骨不連等方面具有良好的療效[16-17],另外LIPUS在控制炎癥和促進(jìn)軟組織修復(fù)等方面也具有良好作用[18-19]。與其他強(qiáng)度的治療性超聲相比,LIPUS 具有最小的熱效應(yīng),且能將聲能定向傳遞到靶組織中,在生物信號傳遞上具有優(yōu)越性[14]。利用LIPUS這一特性,可以調(diào)控膝骨關(guān)節(jié)中細(xì)胞的信號通路,改變細(xì)胞的理化性質(zhì),促進(jìn)細(xì)胞新陳代謝,控制膝骨關(guān)節(jié)的炎癥。
2 LIPUS對膝骨關(guān)節(jié)炎作用的信號通路研究
近年來LIPUS 已廣泛應(yīng)用于KOA 的臨床治療,LIPUS 與藥物或其他治療方法聯(lián)合應(yīng)用對KOA 的疼痛、膝關(guān)節(jié)功能改善、炎癥控制和關(guān)節(jié)軟骨修復(fù)等方面具有明顯的治療優(yōu)勢。高明霞等[20]應(yīng)用LIPUS 聯(lián)合藥物干預(yù)KOA 患者6 周后,與單獨應(yīng)用藥物組對比,在視覺模擬評分(visual analogue scale,VAS)、西安大略和麥克馬斯特大學(xué)骨關(guān)節(jié)炎指數(shù)(Western Ontario and McMaster Universities Osteoarthritis Index,WOMAC)及Lysholm 膝關(guān)節(jié)評分(Lysholm knee score scale,LKSS)方面改善更明顯,且差異有統(tǒng)計學(xué)意義(P<0.05)。亦有針對KOA 患者的臨床研究將口服藥物與LIPUS 聯(lián)合使用,相較單獨口服雙氯芬酸鈉組患者血清組織金屬蛋白酶抑制因子-2(tissue inhibitor of metalloproteinases-2,TIMP-2)的生成增加而關(guān)節(jié)軟骨基質(zhì)金屬蛋白酶-13(matrix metalloproteinase-13,MMP-13)的表達(dá)減少更顯著,顯示LIPUS 對軟骨修復(fù)有積極作用[21]。除了運用量表與血清學(xué)檢測作為評估療效的手段外,通過影像學(xué)MRI 檢測,也能觀察到超聲聯(lián)合藥物對關(guān)節(jié)軟骨的修復(fù)作用,從不同角度揭示了藥物聯(lián)合超聲治療KOA 的機(jī)制[22]。此外,非藥物聯(lián)合治療的臨床應(yīng)用也逐漸興起,如王廣等[23]運用本體感覺聯(lián)合LIPUS 與單純本體感覺訓(xùn)練治療KOA 患者12周,通過比較其VAS、WOMAC 及跌倒效能量表評分(modified fall efficacy scale,MFES),結(jié)果顯示前者改善更明顯,差異具有統(tǒng)計學(xué)意義(P<0.05),表明LIPUS 在各類聯(lián)合治療中對KOA 的抗炎作用。KOA 的發(fā)病和治療機(jī)制并不依賴于單個細(xì)胞因子,相同的信號通路可以被不同的細(xì)胞因子激活。在LIPUS 對KOA 炎癥相關(guān)信號通路作用機(jī)制的研究中,基礎(chǔ)研究主要包括對滑膜細(xì)胞、軟骨細(xì)胞和間充質(zhì)干細(xì)胞(mesenchymal stem cells,MSCs)的作用等方面,其成果值得臨床研究借鑒,以期針對KOA的不同發(fā)病機(jī)制選擇適合的治療參數(shù)和作用靶點,并聯(lián)合不同藥物,最終提高臨床療效。
2.1 LIPUS對滑膜細(xì)胞作用
隨著人體衰老,膝關(guān)節(jié)軟骨中裂解的細(xì)胞外基質(zhì)片段(如多糖和蛋白聚糖)被釋放到關(guān)節(jié)腔中,激活滑膜細(xì)胞(主要包括巨噬細(xì)胞、成纖維細(xì)胞、樹突樣滑膜細(xì)胞和內(nèi)皮細(xì)胞等[24])上的Toll樣受體(Tolllike receptors,TLRs)、晚期糖基化終產(chǎn)物受體(receptor for advanced glycation end products,RAGE),以及滑膜細(xì)胞內(nèi)的核苷酸結(jié)合寡聚化結(jié)構(gòu)域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor and pyrin domain-containing protein 3,NLRP3)炎癥小體,進(jìn)一步級聯(lián)激活以核因子活化B 細(xì)胞κ輕鏈增強(qiáng)子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)信號通路和絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信號通路為主要途徑的細(xì)胞內(nèi)途徑,產(chǎn)生炎性介質(zhì)如IL-1β、IL-6 和TNF-α 并釋放入滑液中[25],介導(dǎo)滑膜無菌性炎癥的產(chǎn)生。目前研究發(fā)現(xiàn),LIPUS 具有抗炎的作用,LIPUS 可能通過干預(yù)滑膜細(xì)胞上的NLRP3 炎癥小體通路及自噬通路發(fā)揮抗炎作用[26-27]。2020 年的1 項研究應(yīng)用脂多糖-三磷酸腺苷處理滑膜巨噬細(xì)胞,促使巨噬細(xì)胞分泌的IL-1β 顯著增加,模擬膝骨關(guān)節(jié)炎的炎癥過程[28],然后進(jìn)行LIPUS 的治療,發(fā)現(xiàn)巨噬細(xì)胞膜中釋放出的NLRP3 炎癥小體信號通路中的關(guān)鍵酶——半胱氨酸天冬氨酸蛋白酶1(Caspase 1)裂解受到抑制,進(jìn)一步抑制前體IL-1β 的加工[29],從而使成熟IL-1β減少。除了抑制NLRP3 炎癥小體信號通路中Caspase 1 外,這項研究還發(fā)現(xiàn)LIPUS 可以通過促進(jìn)丙酮酸激酶(pyruvate kinase muscle,PKM)的自噬來抑制滑膜組織中IL-1β,或通過增強(qiáng)PKM 和螯合體1的結(jié)合,進(jìn)而促進(jìn)溶酶體等自噬小體降解PKM,抑制成熟IL-1β的產(chǎn)生,最終發(fā)揮抗炎作用[28]。見圖1。另一方面,IL-1β 等炎癥因子的刺激同時也導(dǎo)致成纖維細(xì)胞的增生和滑膜的纖維化。LIAO 等[30]發(fā)現(xiàn)LIPUS 可通過抑制從OA 患者滑膜中分離出的成纖維細(xì)胞上的經(jīng)典無翅型MMTV 整合位點家族蛋白(wingless-type MMTV integration site family,Wnt)/β-連環(huán)蛋白信號通路,從而抑制成纖維細(xì)胞的增殖及減少滑膜纖維化。Wnt/β-連環(huán)蛋白信號通路作為典型的Wnt 信號通路,是KOA 的炎癥相關(guān)通路,存在于關(guān)節(jié)的滑膜和軟骨中,參與KOA 的病理過程[31]。此研究表明,LIPUS 可通過經(jīng)典Wnt 信號通路來抑制成纖維細(xì)胞增殖。以上研究闡述了LIPUS可能通過NLRP3 炎癥小體通路、自噬通路和經(jīng)典Wnt 信號通路,來分別影響滑膜中巨噬細(xì)胞和成纖維細(xì)胞的細(xì)胞活動,達(dá)到控制炎癥的效果。見圖2。

圖1 LIPUS通過干預(yù)滑膜細(xì)胞上的NLRP3炎癥小體通路及自噬通路發(fā)揮抗炎作用Figure 1 LIPUS exerts anti-inflammatory effects by interfering with the NLRP3 inflammatory vesicle pathway and autophagic pathway on synovial cells
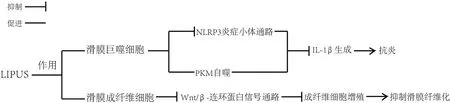
圖2 LIPUS對滑膜細(xì)胞的作用Figure 2 Action of LIPUS on synovial cells
2.2 LIPUS對軟骨細(xì)胞作用
隨著KOA 的進(jìn)展,大量炎癥因子進(jìn)入滑液后刺激軟骨細(xì)胞,通過NF-κB 及MAPKs 等多種信號通路,產(chǎn)生如基質(zhì)金屬蛋白酶和聚集蛋白聚糖酶等軟骨降解產(chǎn)物,介導(dǎo)軟骨細(xì)胞的破壞[31-33]。LIPUS 通過抑制NF-κB 通路而阻斷軟骨細(xì)胞的破壞過程。UDDIN等[34]發(fā)現(xiàn),LIPUS的機(jī)械刺激作用可以激活人軟骨細(xì)胞上的整合素及牽張活化通道,使得IL-1β誘導(dǎo)的細(xì)胞質(zhì)內(nèi)NF-κB 的蛋白質(zhì)磷酸化被抑制,通過抑制核轉(zhuǎn)錄,降低了細(xì)胞中MMP-13 和聚集蛋白聚糖酶-5 mRNA的表達(dá),從而減少軟骨細(xì)胞MMP-13和聚集蛋白聚糖酶-5 的生成,使Ⅱ型膠原蛋白(collagen type Ⅱ,Col Ⅱ)降解減緩,同時增加細(xì)胞外基質(zhì)的合成,抑制軟骨分解代謝,刺激軟骨分化,最終起到保護(hù)軟骨的作用。除此之外,LIPUS 還可作用于軟骨中的MAPK 通路。MAPK 是一類廣泛存在于真核細(xì)胞中的絲氨酸/蘇氨酸蛋白激酶。MAPK中與KOA發(fā)病相關(guān)的酶主要有細(xì)胞外信號調(diào)節(jié)激酶(extracellular regulated protein kinases,ERK)、p38絲裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)和Jun 氨基末端激酶[17]。有學(xué)者提出LIPUS 可能是通過促進(jìn)細(xì)胞內(nèi)Ca2+內(nèi)流來產(chǎn)生上述作用,LIPUS 產(chǎn)生的機(jī)械刺激激活瞬時受體電位香草素受體4 型通道蛋白(TRPV4),這種通過機(jī)械應(yīng)力激活的鈣通道,使Ca2+向細(xì)胞內(nèi)流,進(jìn)一步激活p38 MAPK通路及ERK1/2通路[35]。以上2種信號通路共同促進(jìn)CCN 家族蛋白2/結(jié)締組織生長因子(CCN family 2/connective tissue growth factor,CCN2/CTGF)的產(chǎn)生。CCN2 是LIPUS 作用于軟骨細(xì)胞產(chǎn)生效應(yīng)所需要的物質(zhì)[36],可促進(jìn)軟骨細(xì)胞中Col Ⅱa1 和Acan 基因的表達(dá)(產(chǎn)物為Col Ⅱ和聚集蛋白聚糖),起到增加細(xì)胞外基質(zhì)的作用。SEKINO等[37]也發(fā)現(xiàn)LIPUS 可以使小鼠軟骨細(xì)胞內(nèi)ERK1/2的活性和聚集蛋白聚糖的合成增加,MMP-13 的表達(dá)降低,增強(qiáng)軟骨細(xì)胞分化和細(xì)胞外基質(zhì)合成,最終促進(jìn)軟骨的合成。沈士浩等[38]則從不同角度揭示了LIPUS 對軟骨細(xì)胞的作用,該團(tuán)隊提出LIPUS可能通過激活兔軟骨細(xì)胞中整合素-黏著斑激酶(focal adhesion kinase,F(xiàn)AK)-MAPK 通路來減輕KOA 對軟骨的破壞。在LIPUS 機(jī)械刺激的作用下,整合素被激活,進(jìn)一步激活FAK,調(diào)控下游的MAPK水平,使ERK1/2、p38 磷酸化水平下降,最終促進(jìn)Col Ⅱ的合成及減少MMP-13 的產(chǎn)生來保護(hù)軟骨。這些結(jié)果說明LIPUS的機(jī)械刺激通過直接作用于軟骨細(xì)胞上不同的靶點,對軟骨細(xì)胞中2 種主要信號通路產(chǎn)生不同的作用,來抑制軟骨降解產(chǎn)物的產(chǎn)生,抑制軟骨分解,促進(jìn)軟骨合成,調(diào)控軟骨代謝過程,延緩膝骨關(guān)節(jié)炎的進(jìn)展。
2.3 LIPUS誘導(dǎo)MSCs再生軟骨
除以上對滑膜及軟骨的治療機(jī)制外,近年來LIPUS 的研究熱點逐漸趨于其對MSCs 的影響[39-40]。LIPUS 還可通過影響MSCs的增殖、分化及遷移來達(dá)到修復(fù)軟骨的目的。MSCs是多能干細(xì)胞,廣泛分布于滑膜、骨髓和骨骼肌等組織中,可增殖分化為多種細(xì)胞,如成骨細(xì)胞、基質(zhì)細(xì)胞、軟骨細(xì)胞等,其遷移到受損軟骨組織中,具有修復(fù)軟骨的作用,在治療KOA 方面有巨大的潛力[41]。LING 等[42]和CHEN等[43]研究指出,LIPUS 通過激活磷脂酰肌醇3-激酶(phosphoinositide 3 kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信號通路和ERK1/2信號通路,促進(jìn)人羊膜間充質(zhì)干細(xì)胞的細(xì)胞增殖周期進(jìn)入周期蛋白合成時期,從而上調(diào)細(xì)胞周期蛋白的表達(dá),誘導(dǎo)MSCs 的增殖。XIA 等[44]觀察到LIPUS 的機(jī)械刺激可使添加了轉(zhuǎn)化生長因子-β1(transforming growth factor-beta 1,TGF-β1)的體外培養(yǎng)的大鼠骨髓MSCs 中的Col Ⅱ和聚集蛋白聚糖的基因表達(dá)增加而使Col Ⅰ的基因表達(dá)降低,促進(jìn)MSCs分化形成軟骨細(xì)胞,修復(fù)軟骨。這個過程可能是通過促進(jìn)骨髓MSCs 中的整合素-雷帕霉素的機(jī)制靶點(mammalian target of rapamycin,mTOR)信號通路來實現(xiàn)的。1 項大鼠體內(nèi)外研究給出了更加新穎的觀點,即LIPUS 可通過調(diào)節(jié)自噬來促進(jìn)骨髓來源的MSCs外泌體釋放[45],進(jìn)一步增加Col Ⅱ等細(xì)胞外基質(zhì)以保護(hù)軟骨,此類外泌體也可通過抑制由IL-1β 激活的NF-κB 途徑修復(fù)軟骨[46]。因此LIPUS 除了直接抑制軟骨破壞外,還可促進(jìn)注射至關(guān)節(jié)腔的骨髓MSCs 分泌的外泌體修復(fù)軟骨。另外,LIPUS 的機(jī)械應(yīng)力可激活MSCs中的自噬通路并使其發(fā)生遷移,且此過程可被自噬抑制劑所抑制,但對自噬通路的激活過程及如何引起MSCs 的遷移并未具體闡明[47]。未來還需更多研究闡述LIPUS 在MSCs 遷移中的作用。近年的研究發(fā)現(xiàn)LIPUS通過多種經(jīng)典的信號通路,在MSCs 的增殖、分化、遷移及其生物活性物質(zhì)的產(chǎn)生、作用等方面產(chǎn)生效應(yīng),介導(dǎo)膝關(guān)節(jié)軟骨代謝的調(diào)控,減緩KOA的發(fā)展。見圖3。
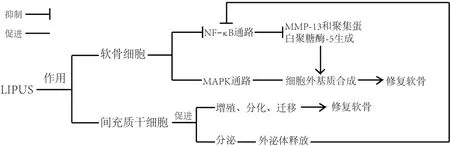
圖3 LIPUS對軟骨的作用Figure 3 Effect of LIPUS on cartilage
3 討 論
綜上所述,LIPUS 主要通過影響自噬、Wnt/β-連環(huán)蛋白、MAPKs、NF-κB、PI3K-Akt 和整聯(lián)蛋白-mTOR 等信號通路對膝關(guān)節(jié)中的滑膜細(xì)胞、軟骨細(xì)胞及骨髓間充質(zhì)干細(xì)胞的細(xì)胞活動起積極作用。LIPUS 可通過增強(qiáng)巨噬細(xì)胞的自噬途徑及抑制NLRP3 炎癥小體通路使巨噬細(xì)胞產(chǎn)生的IL-1β 減少,減輕炎癥反應(yīng)。也可通過機(jī)械刺激抑制IL-1β誘導(dǎo)的NF-κB 途徑及激活MAPK 通路,來調(diào)節(jié)軟骨的分泌代謝,促進(jìn)軟骨細(xì)胞生成細(xì)胞外基質(zhì),保護(hù)軟骨。在骨髓間充質(zhì)干細(xì)胞方面,LIPUS 激活ERK1/2 和PI3K-Akt 信號通路促進(jìn)MSCs 增殖分化,也通過整聯(lián)蛋白-mTOR 信號通路來促進(jìn)MSCs產(chǎn)生TGF-β1,促進(jìn)軟骨形成。另一方面,LIPUS 還可促進(jìn)MSCs分泌外泌體,通過抑制IL-1β 誘導(dǎo)的NF-κB 途徑改變軟骨代謝,間接保護(hù)軟骨。最近研究也發(fā)現(xiàn)LIPUS通過激活自噬來促進(jìn)MSCs 的遷移。通過對LIPUS在KOA 炎癥相關(guān)信號通路上不同作用途徑的探索,有利于實現(xiàn)LIPUS 更精準(zhǔn)的治療。此外,干細(xì)胞新技術(shù)治療骨關(guān)節(jié)炎疾病的臨床試驗已陸續(xù)開始在國內(nèi)開展[10],未來應(yīng)進(jìn)一步尋找LIPUS 對膝關(guān)節(jié)內(nèi)其他細(xì)胞或物質(zhì)的影響通路,或進(jìn)一步探究通過LIPUS的物理刺激讓干細(xì)胞定向分化為軟骨細(xì)胞并誘導(dǎo)其遷移修復(fù)受損軟骨的可行性,為臨床研究及聯(lián)合治療方案提供理論依據(jù)。