選擇性MAO-B 抑制劑TM-5 對膠質瘤U87 細胞自噬和凋亡的影響
武海博 梁 燕 沈 雷 范 展 傅國惠
膠質瘤是一種病因不詳、損傷性極大的中樞神經系統腫瘤,嚴重威脅人類健康[1]。手術治療是目前臨床醫治惡性膠質瘤的主要方式,但腦膠質瘤細胞嚴重浸潤周圍正常腦組織,手術切除因需要確保神經功能和必要的生理功能而無法徹底清除腫瘤;患者術后改善效果不佳,存活率較低且極易復發[2-3]。由于膠質瘤細胞具有失控性增殖、侵襲性生長、細胞凋亡速度減慢等惡性細胞行為,也給膠質瘤的治療帶來巨大困難[4-5]。因此,尋找新的治療藥物防治膠質瘤,具有重要的臨床實用價值。單胺氧化酶(monoamine oxidase,MAO)存在于大多數哺乳動物,包括單胺氧化酶A (monoamine oxidase A,MAO-A)和單胺氧化酶B(monoamine oxidase B,MAO-B)兩種同工酶,能夠催化多種胺類(5-羥色胺、組胺、多巴胺、去甲腎上腺素和腎上腺素)氧化脫氨,導致神經遞質失活[6]。研究顯示,MAO-B 抑制劑對神經退行性疾病(如帕金森和阿爾茨海默癥)具有潛在的治療潛力[7]。在人膠質瘤中也檢測到MAO-B 活性顯著性增加,與正常星形膠質細胞相比,腫瘤來源的星形膠質細胞中MAO-B 的含量明顯增高,其過表達可能與惡性膠質瘤有關[8-9]。因此,抑制MAO-B 將成為治療膠質瘤的新靶點。筆者前期研究發現,新型查爾酮衍生物TM-5 可選擇性抑制MAO-B 活性,其IC50為(0.022±0.01)μM(SI = 2618)[10]。但TM-5 是否可在膠質瘤中發揮抗腫瘤活性尚不清楚,本研究以人膠質瘤細胞株U87 為研究對象,觀察TM-5 對U87 細胞存活的影響及可能作用機制,為惡性膠質瘤的新型藥物開發提供理論基礎。
1 材料與方法
1.1 細胞株 人類膠質瘤細胞株U87,源于惡性神經膠質瘤,上皮樣細胞,購自中科院上海生化所。
1.2 實驗材料 DMEM/F12 培養基(貨號:11320033,規格:500 mL,美國Gibco 公司);胎牛血清(貨號:BCSE-FBS01-500 mL,規格:500 mL,南京生航生物技術公司);二甲基亞砜(貨號:D5879,規格:100 mL,美國Sigma 公司);噻唑藍[3-(4,5-Dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT]試劑、SYBR熒光定量試劑盒(貨號:C0009S、D7260-5mL,規格:500次、5 mL,上海碧云天生物技術公司);異硫氰酸熒光素標記膜聯蛋白V/碘化丙啶(annexin V-fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)細胞凋亡試劑盒(貨號:70-AP101-100,規格:100T,杭州聯科生物技術有限公司);反轉錄試劑盒(貨號:K1622,規格:100 rxns,美國Thermo Scientific 公司);兔源Bcl-2相關蛋白X(Bcl-2 associated protein X,Bax,貨號:ab53154,免疫親和純化,濃度:1 mg/mL,規格:100 μg)、Beclin-1(貨號:ab53154,蛋白A 純化,濃度:0.634 mg/mL,規格:40 μg)、P62(貨號:ab264313,免疫親和純化,濃度:1 mg/mL,規格:100 μg)、切割后半胱氨酸蛋白酶3(cleaved caspase-3,貨號:ab2302,免疫親和純化,濃度:0.5 mg/mL,規格:50 μg)、β-tubin(貨號:ab179513,蛋白A 純化,濃度:2.151 mg/mL,規格:40 μg)、鼠源自噬相關蛋白1 輕鏈-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ,貨號:ab53154,蛋白A 純化,濃度:0.43 mg/mL,規格:100 μg)蛋白一抗(美國Abcam 公司);山羊源抗兔/鼠蛋白二抗(貨號:CYZC04041、CYZ-C04042,規格:1 mg,武漢艾美捷科技公司)。流式細胞儀(型號:NovoCyte 2060R,杭州艾森生物有限公司),實時熒光定量PCR 儀(型號:Iq5,美國BIO-RAD 公司)。
1.3 方法
1.3.1 TM-5 的合成及配制 將3 mmol 5,6-二甲氧基茚酮和9 mmoL 50%氫氧化鉀加入10 mL 乙醇中,室溫攪拌30 min,再加入3.3 mmol 對二甲胺基苯甲醛,繼續室溫攪拌72 h,經薄層色譜法檢測反應,將反應液倒入碎冰中,攪拌下調pH = 6,4℃下靜置過夜,次日,抽濾,濾餅用乙醇重結晶,4℃下靜置過夜,抽濾后將濾餅烘干,即得黃色目標化合物TM-5,其合成路線見圖1。TM-5 分子式為 (Z)-2-[4-(二甲胺基)苯亞甲基]-5,6-二甲氧基-2,3-二氫-1H-茚1 酮[(Z)-2-(4-(Dimethylamino)benzylidene)-5,6-dimethoxy-2,3-dihydro-1H-inden-1-one (TM-5)],淺黃色固體,熔點為117.8~119.1°C,收率為83.1%,純度為98.6%。以二甲基亞砜為溶劑,再用pH 7.4 緩沖液梯度稀釋,濾膜過濾除菌后備用。
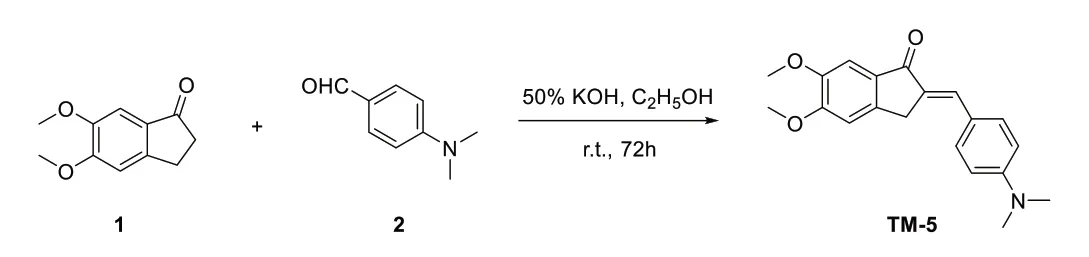
圖1 化合物TM-5的合成圖示
1.3.2 細胞培養 預先配制含10% 胎牛血清、100 mg/L 鏈霉素和1×105U/L 青霉素的DMEM/F12 培養基(以下簡稱培養基),用適量培養基懸浮U87 細胞,設置培養條件為5% CO2、37 ℃,細胞貼壁生長繁殖至80%~90% 匯合度時傳代培養,取對數生長期細胞用于后續實驗。
1.3.3 MTT實驗檢測細胞活力 將U87 細胞以1×104個/mL 密度接種于96 孔板,100 μL/孔,每組3 個復孔,隨機分為7 組:對照組不做處理,溶劑組待細胞貼壁后加入二甲基亞砜,5、10、25、50、100 μmoL/L TM-5 組待細胞貼壁后分別加入5、10、25、50、100 μmoL/L TM-5處理細胞,培養24 h,再加入0.5 mg/mL MTT 試劑每孔50 μL,繼續孵育4 h,終止培養后加入二甲基亞砜 ,每孔100 μL,避光下放置搖床15 min,使結晶物充分溶解,用酶聯免疫檢測儀測量各孔的吸光度值(OD 492 nm),細胞存活率=測試組OD 值/對照組OD 值×100%,篩選細胞存活率>50%的濃度進行后續實驗。
1.3.4 流式細胞術檢測細胞凋亡 將U87 細胞以1.0×105個/毫升接種于6 孔板,每孔1.5 mL,每組3 個復孔,按各組處理后培養24 h 收集細胞,調整細胞密度為1.0×106個/毫升,緩沖液洗滌兩次,加入預冷1×結合緩沖液重懸細胞,分別加入Annexin V-FITC 和PI 染液,避光下孵育10 min,再混入1×結合緩沖液,上流式細胞儀檢測,右上象限(晚期凋亡細胞)與右下象限(早期凋亡細胞)細胞率之和為細胞凋亡率,再計算相對細胞凋亡率=測試組細胞凋亡率/對照組細胞凋亡率×100%。
1.3.5 實時熒光定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,qRT-PCR)檢測細胞中Bax mRNA、Bcl-2 mRNA 水平 將U87 細胞以1.0×105個/毫升接種于6 孔板,每孔1.5 mL,每組3 個復孔,按各組處理后培養24 h 收集細胞,提取總RNA,逆轉錄為cDNA 模板。構建qRT-PCR 反應體系:EvaGreen 2X qPCR MasterMix 5 μL、Forward Primer(10μM) 0.3 μL、Reverse Primer(10 μM) 0.3 μL、Nuclease-free H2O 3.4 μL、模板cDNA 1 μL,其中引物系列見表1。反應條件:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火1 min,72℃延伸30 s,72 ℃總延伸10 min,共40 個循環。以GAPDH 為內參,采用2-△△Ct法計算Bax mRNA、Bcl-2 mRNA 表達水平,相對表達水平=測試組Bax mRNA、Bcl-2 mRNA 表達水平/對照組Bax mRNA、Bcl-2 mRNA 表達水平×100%。
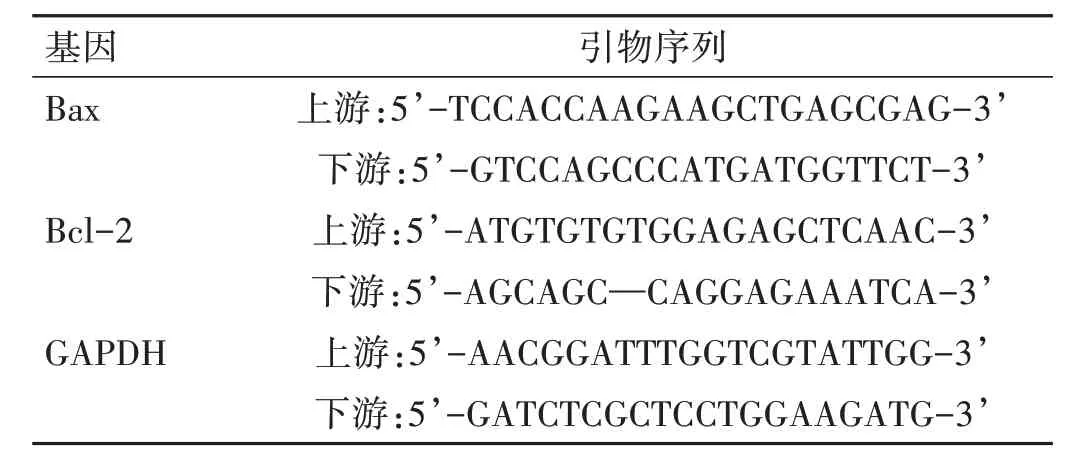
表1 基因引物序列
1.3.6 蛋白質免疫印跡(Western blot,WB)檢測細胞中相關蛋白表達 將U87 細胞以1.0×105個/毫升接種于6 孔板,每孔1.5 mL,每組3 個復孔,按各組處理后培養24 h 收集細胞,提取細胞總蛋白,各組取40 μg 變性蛋白經10% SDS-PAGE 電泳分離,再電轉至 PVDF膜,室溫封閉1 h,添加蛋白一抗(稀釋比1:1 000) 4℃過夜,加山羊源抗兔/鼠蛋白二抗室溫孵育1 h,ECL 顯色發光檢測后顯影,應用Image J 軟件測定蛋白條帶灰度值,計算Bax、LC3、Beclin 1、P62 和cleaved-caspase-3 蛋白條帶灰度值與β-tubin 比值,表示目的蛋白表達量,蛋白相對表達量=測試組目的蛋白表達量/對照組目的蛋白表達量×100%。
1.4 統計學方法 應用SPSS 24.0 和GraphPad Prism5 軟件進行統計學分析;符合正態分布數據以表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,多組間兩兩比較采用LSD-t檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 TM-5 對U87 細胞活力的影響 MTT 實驗結果顯示,與對照組比較,用10、25、50、100 μmoL/L TM-5 處理后U87 細胞存活率降低(P<0.05)。見表2。選取細胞存活率>50% 的濃度進行后續實驗,即5、10、25 μmoL/L TM-5 組。
表2 各組U87細胞存活率比較()
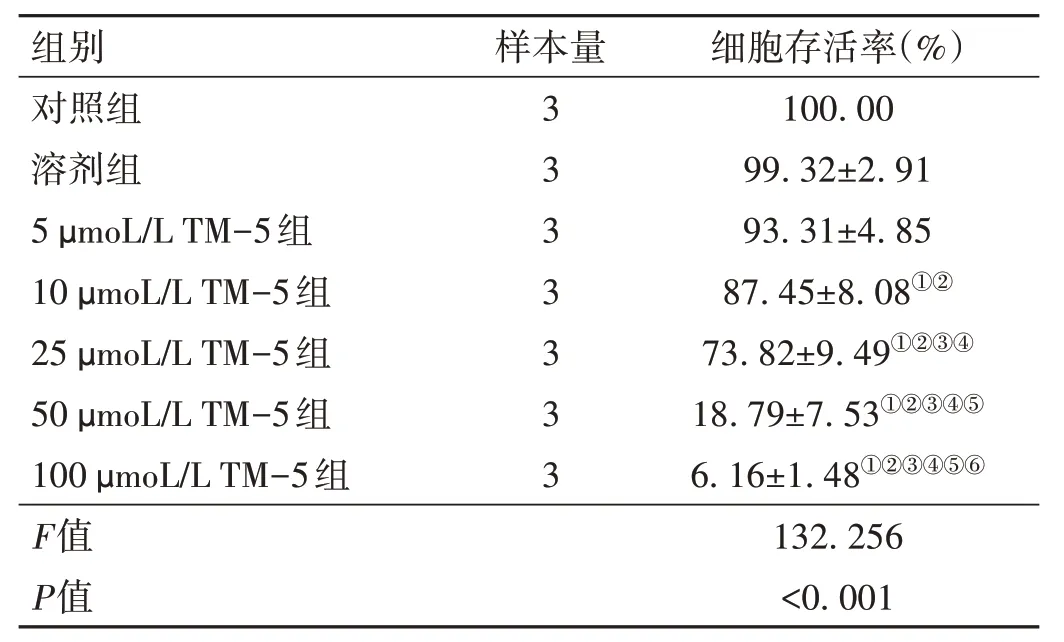
表2 各組U87細胞存活率比較()
注:與對照組比較,①P < 0.05;與溶劑組比較,②P < 0.05;與5 μmoL/L TM-5組比較,③P < 0.05;與10 μmoL/L TM-5組比較,④P < 0.05;與25 μmoL/L TM-5組比較,⑤P < 0.05;與50 μmoL/L TM-5組比較,⑥P < 0.05。
?
2.2 TM-5 對U87 細胞凋亡的影響 與對照組比較,10、25 μmoL/L TM-5 組U87 細胞相對細胞凋亡率升高(P<0.05)。見表3、圖2。
表3 各組U87細胞相對細胞凋亡率比較()
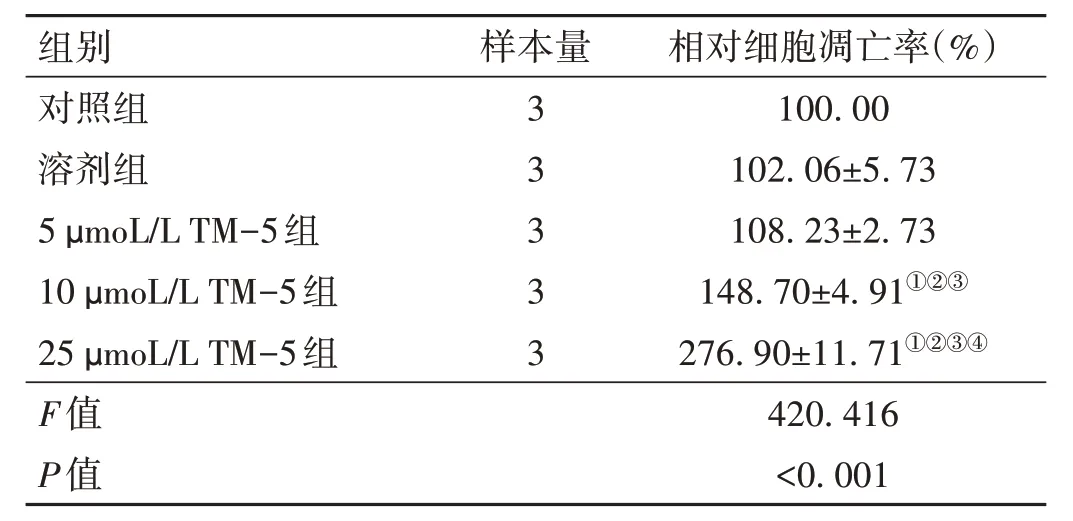
表3 各組U87細胞相對細胞凋亡率比較()
注:與對照組比較,①P < 0.05;與溶劑組比較,②P < 0.05;與5 μmoL/L TM-5組比較,③P < 0.05;與10 μmoL/L TM-5組比較,④P < 0.05。
?
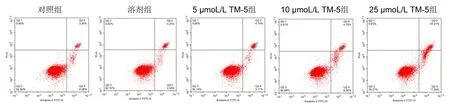
圖2 TM-5對U87細胞凋亡的影響(流式細胞術實驗)
2.3 TM-5 對U87 細胞中Bax mRNA、Bcl-2 mRNA 相對表達水平的影響 與對照組比較,5、10、25 μmoL/L TM-5 組U87 細胞中促凋亡基因Bax mRNA 相對表達水平升高,抑凋亡基因Bcl-2 mRNA 相對表達水平降低(P<0.05)。見表4。
表4 各組U87細胞中Bax mRNA、Bcl-2 mRNA相對表達水平的比較(,%)
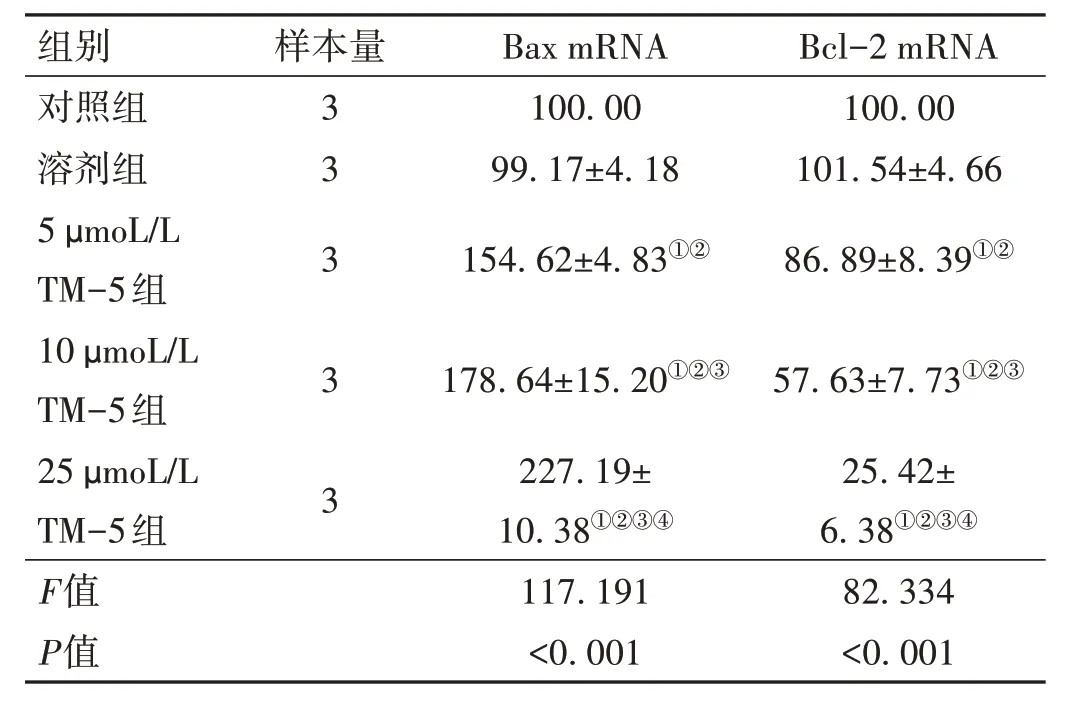
表4 各組U87細胞中Bax mRNA、Bcl-2 mRNA相對表達水平的比較(,%)
注:Bax為B細胞淋巴瘤/白血病-2基因相關X蛋白;Bcl-2為B細胞淋巴瘤/白血病-2基因;與對照組比較,①P < 0.05;與溶劑組比較,②P < 0.05;與5 μmoL/L TM-5組比較,③P < 0.05;與10 μmoL/L TM-5組比較,④P < 0.05。
?
2.4 TM-5 對U87 細胞中自噬及凋亡相關蛋白相對表達量的影響 與對照組相比,5、10、25 μmoL/L TM-5組U87 細胞中Beclin-1 和cleaved caspase-3 蛋白相對表達量升高,P62 蛋白相對表達量降低(P<0.05);10、25 μmoL/L TM-5 組LC3-Ⅱ和Bax 蛋白相對表達量升高(P<0.05)。見表5、圖3。
表5 各組U87細胞中自噬及凋亡相關蛋白相對表達量比較(,%)
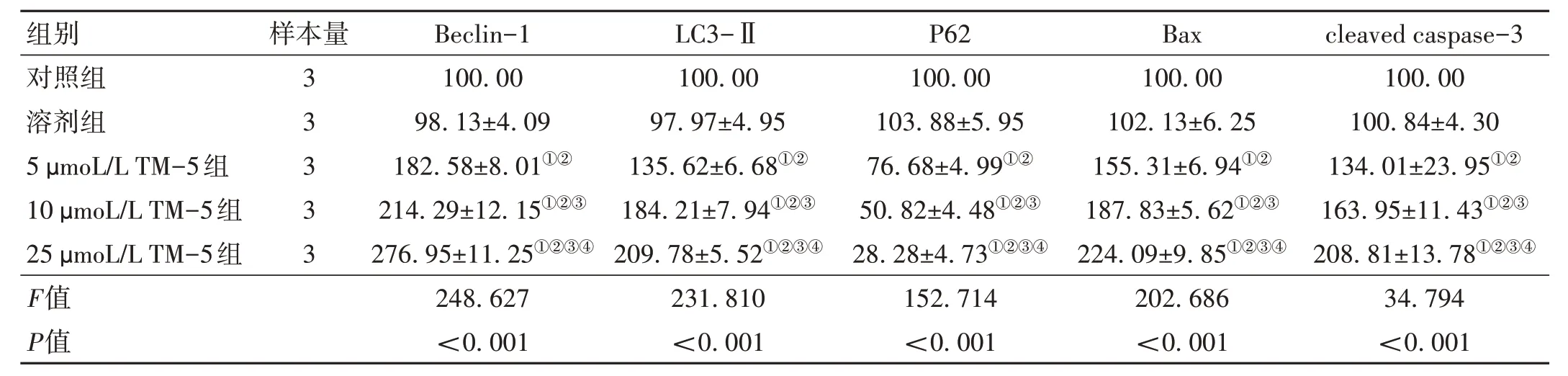
表5 各組U87細胞中自噬及凋亡相關蛋白相對表達量比較(,%)
注:Beclin-1為BH3域自噬蛋白;LC3-Ⅱ為微管相關蛋白輕鏈3 Ⅱ;P62為自噬選擇性底物;Bax為B細胞淋巴瘤/白血病-2基因相關X蛋白;cleaved caspase-3為切割后天冬氨酸蛋白水解酶3;與對照組比較,①P < 0.05;與溶劑組比較,②P < 0.05;與5 μmoL/L TM-5組比較,③P < 0.05;與10 μmoL/L TM-5組比較,④P < 0.05。
?
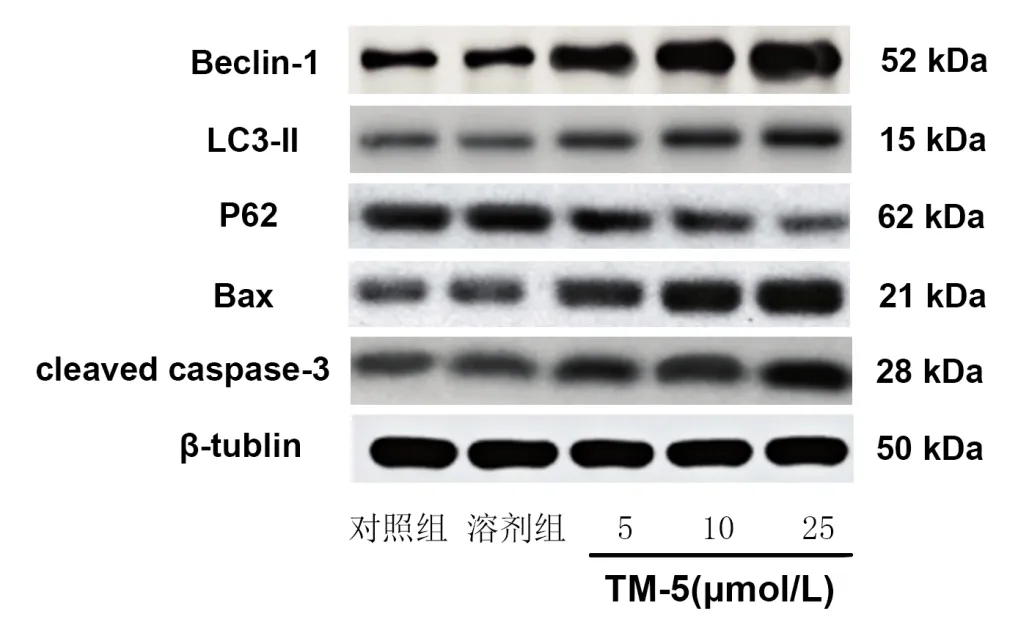
圖3 TM-5對U87細胞中自噬及凋亡相關蛋白表達的影響(Western blot檢測)
3 討論
膠質瘤細胞生長速度快、破壞性強,急需開發新型藥物幫助改善患者預后[11]。MAO 抑制劑是臨床常用的抗抑郁藥物,通過抑制MAO 的降解,提高突觸有效介質濃度,發揮抗抑郁作用[12]。邵根寶等[13]研究發現,MAO 抑制劑可誘導膠質瘤U251 細胞分化,這將有助于提高膠質瘤的治療效果;Marconi 等[14]發現,新型MAO-B 抑制劑—Cmp5 和Cmp3,可促進氧化應激,誘導細胞周期阻滯,并降低膠質瘤細胞遷移能力,從而在高級別膠質瘤發揮抗腫瘤作用。同時,Irwin 等[15]通過近紅外熒光光學成像技術,發現靜脈注射5 mg/kg MAO抑制劑是靶向腦腫瘤的最佳劑量,可安全用于膠質瘤的治療。上述研究表明,MAO 抑制劑在膠質瘤的治療中具有一定潛力。
筆者前期研究發現,合成新型MAO-B 抑制劑TM-5,在阿爾茨海默病中有良好的神經保護作用,但是否也可抑制膠質瘤尚不清楚[10]。本研究檢測了人膠質瘤細胞株U87 在TM-5 處理后細胞增殖和凋亡的變化,結果顯示,與對照組比較,10、25、50、100 μmoL/L TM-5 組細胞存活率降低,10、25 μmoL/L TM-5 組相對細胞凋亡率升高,提示MAO-B 抑制劑TM-5 對U87 細胞具有抑制作用。Inaba-Hasegawa 等[16]研究結果顯示,MAO-B 可抑制膠質瘤細胞中神經保護基因表達,敲低其表達可調控Bcl-2、腦源性神經營養因子和膠質細胞系源性神經營養因子水平。由此提出猜測,TM-5可能通過調控Bcl-2 表達,在膠質瘤中發揮作用。本研究中,與對照組比較,5、10、25 μmoL/L TM-5 組U87細胞中促凋亡基因Bax mRNA 相對表達水平升高,抑凋亡基因Bcl-2 mRNA 相對表達水平降低,表明TM-5可能通過調控Bax、Bcl-2 基因表達,誘導細胞凋亡。
自噬是細胞完成細胞器更新和物質代謝的重要過程,對細胞凋亡有雙向調節作用,營養物質缺乏的情況下,適度的自噬可促進細胞存活,但過量自噬會導致細胞死亡[17-18]。促凋亡信號因子刺激下細胞啟動自噬,LC3-I 轉化為 LC3-II 并轉移至自噬體膜上,偶聯P62蛋白參與自噬體的形成[19-20]。抑凋亡蛋白Bcl-2 也是重要的自噬調節因子,可結合自噬標識蛋白Beclin 1 并抑制其誘導的細胞自噬[21]。本研究中Western blot 檢測發現,TM-5 可上調Beclin 1、LC3-Ⅱ表達,下調P62,誘導細胞自噬;同時,TM-5 處理后U87 細胞中Bax 和凋亡執行蛋白cleaved caspase-3 表達也升高,說明TM-5 可能通過調控上述蛋白表達,誘導U87 細胞自噬和凋亡,從而降低U87 細胞存活率。
綜上所述,TM-5 可抑制膠質瘤U87 細胞存活,其作用機制可能是上調Beclin-1、LC3-Ⅱ、Bax 和cleaved caspase-3,下調Bcl-2 和P62 表達,誘導細胞自噬和凋亡。本研究提出新型化合物TM-5 有望成為治療人膠質瘤的候選藥物,但其是否存在其他作用途徑還有待深入分析。

