細胞焦亡在胎盤早剝患者外周血和胎盤組織中的表達及臨床意義*
唐雨帆,宋鵬書,李 英,龍俊青
(廣西壯族自治區婦幼保健院新陽院區產二科,南寧 530005)
胎盤早剝是指孕婦妊娠20周后正常位置的胎盤在胎兒娩出前,部分或全部從子宮剝離,發生率約為2%[1-2]。胎盤早剝的主要病理變化是底蛻膜螺旋小動脈痙攣或硬化,引起遠端毛細血管變性壞死甚至破裂出血,血液在底蛻膜與胎盤之間形成血腫使該處胎盤從子宮壁剝落,造成這種血管破損的原因尚不明確,目前國內外對其機制的研究熱點為免疫炎癥反應[3-4]。細胞焦亡是一種促炎的程序性死亡方式,其主要依賴于炎性半胱天冬氨酸蛋白酶的活化,進而介導白細胞介素(IL)-1β活化、IL-18分泌,并誘發炎癥反應,最終誘導細胞炎性死亡[5]。細胞焦亡可促進內皮細胞功能障礙,在心血管疾病的發生、發展中發揮重要作用[6-7]。血管內皮損傷是眾多心血管疾病發生的始動因素,而血管內皮細胞死亡是導致內皮損傷的重要原因[8]。本研究推測胎盤組織中發生細胞焦亡,進而引起血管破損,最終導致胎盤早剝。通過研究細胞焦亡及其相關因子,探討胎盤早剝機制,為胎盤早剝癥狀提供早期的預警標志物。
1 資料與方法
1.1 一般資料
選取2021年7月至2023年3月在本院定期產檢,并在產檢中通過磁共振成像和彩色多普勒超聲最終確診為胎盤早剝的產婦40例(胎盤早剝組),以及同時間段妊娠期健康孕婦40例(對照組)。為了防止分娩時陰道污染胎盤,選擇剖宮產分娩孕婦,所有同意參加本研究的孕婦都簽署《科研知情同意書》。本研究已獲廣西壯族自治區婦幼保健院倫理委員會批準[桂婦保院醫倫快審(2022-2)1號]。
1.2 方法
1.2.1外周血采集和炎癥因子檢測
兩組孕婦分娩前抽取3 mL外周血,采血管在4 ℃,3 000 r/min離心10 min。收集上層血清轉移到凍存管保存于-80 ℃。等所有標本收集完畢之后,通過ELISA檢測細胞焦亡因子如腫瘤壞死因子-α(TNF-α)、IL-1β和IL-18的表達水平。檢測儀器為美國賽默飛世爾科技公司Multiskan Sky紫外可見光分光光度計Cary 100,TNF-α(JM-5141H2)、IL-1β(JL13662)和IL-18(JM-1152H1)ELISA試劑盒均購自深圳市優里生物科技有限公司。
1.2.2胎盤病理學形態分析
剪取娩出胎盤母體面組織塊,置于4%甲醛溶液。組織經過脫水和石蠟包埋,切片機切成2 μm膜片。高溫烘片之后依次浸泡二甲苯和梯度乙醇,流水沖洗,蘇木素液染色5 min,流水清洗膜片,1%鹽酸乙醇浸泡1 s,流水沖洗返藍,0.5%伊紅液染色5 min,80%乙醇、95%乙醇、無水乙醇Ⅰ、無水乙醇Ⅱ,各浸泡1 s,晾干膜片用中性樹膠封片。
1.2.3電子顯微鏡觀察胎盤早剝患者胎盤組織中細胞焦亡情況
胎盤組織娩出后快速剪取1 mm×1 mm大小組織塊若干放在3%戊二醛中固定12 h,磷酸鹽緩沖液(PBS)清洗3次,每次15 min,之后浸泡在1%鋨酸固定2 h,PBS清洗3次,每次15 min。然后乙醇-丙酮逐級脫水,丙酮和包埋劑(體積比2∶1)滲透2 h,丙酮和包埋劑(體積比1∶3)滲透過夜。環氧樹脂包埋組織塊,聚合過程需要的溫度和時間依次為40 ℃ 15 h,48 ℃ 12 h,60 ℃ 48 h,修整組織塊,徠卡UC7超薄切片機切片,醋酸鈾-檸檬酸鉛雙重染色,透射電鏡(日本日立公司,型號:H-7650)觀察細胞內部形態結構。
1.2.4Western blot檢測胎盤早剝孕婦胎盤組織細胞焦亡標志蛋白表達
剪取小塊胎盤組織(避免鈣化區域),用冷PBS沖洗組織表面的血跡,使用組織研磨機將胎盤組織在冰上制成勻漿,加入1 mL RIPA裂解緩沖液(含1%蛋白酶抑制劑)。二喹啉甲酸(BCA)法測定提取蛋白水平。蛋白質樣品在高溫變性之后通過十二烷基硫酸鈉-聚丙烯酸胺凝膠電泳(SDS-PAGE)分離,100 mA電流持續120 min將凝膠上的蛋白轉移到聚偏氟乙烯(PVDF)膜上。5%脫脂奶粉室溫封閉孵育30 min,TBST漂洗3次,每次10 min。加入單克隆一抗caspase-1(稀釋比1∶1 000,貨號:ab207802)、Gasdermin D(GSDMD,稀釋比1∶1 000,貨號:ab219800)和NOD樣受體蛋白3(NLRP3,稀釋比1∶1 000,貨號:ab263899),置入4 ℃搖晃孵育12 h,再次TBST漂洗3次,每次10 min,加入二抗(稀釋比1∶8 000,貨號:ab205718)室溫孵育1 h,PVDF膜添加顯色劑孵育5 min,上機檢測。結果用凝膠分析軟件處理,Image-Lab軟件計算標志蛋白相對表達水平。
1.2.5實時熒光定量逆轉錄PCR(RT-qPCR)檢測胎盤早剝孕婦胎盤組織中焦亡因子mRNA的表達水平
收集胎盤標本,100 μg胎盤組織碎塊加入800 μL TRIzol提取RNA,采用美國賽默飛世爾科技公司Nandrop NOE儀器測定RNA水平;按照cDNA逆轉錄試劑盒將RNA逆轉錄成cDNA;參照美國賽默飛公司設計的反應程序加入cDNA、上下游引物、反應酶和水進行RT-qPCR。反應程序設置:85 ℃預變性3 min;95 ℃變性20 s;65 ℃退火40 s;75 ℃延伸35 s;40個循環,甘油醛-3-磷酸脫氫酶(GAPDH)基因作為管家基因進行PCR反應。根據PCR擴增曲線,得到兩組標本的循環閾值(Ct值),使用 2-ΔΔCt法計算兩組胎盤組織中caspase-1、GSDMD和NLRP3 mRNA表達水平。
1.3 統計學處理

2 結 果
2.1 兩組妊娠期臨床特征比較
兩組身高、體重、BMI、年齡均無明顯差異(P>0.05)。胎盤早剝組孕周屬于孕中期,較對照組明顯縮短(P<0.05);且有疤痕子宮史者占比明顯高于對照組(P<0.05)。統計兩組妊娠期并發癥發生情況,胎盤早剝組腹痛、出血、胎膜早破、子癇前期發生率均明顯高于對照組(P<0.05),見表1。

表1 兩組妊娠期臨床資料比較
2.2 兩組外周血炎癥因子表達水平比較
胎盤早剝組外周血TNF-α、IL-1β、IL-18水平均高于對照組,差異有統計學意義(P<0.05),見表2。

表2 兩組外周血炎癥因子水平比較
2.3 兩組胎盤組織的大體及蘇木素-伊紅(HE)染色病理學特征
對比妊娠期健康孕婦分娩的胎盤組織,可以發現胎盤早剝孕婦胎盤組織的母體面有黑褐色血液腫塊,胎兒面血管出現血栓;病理學染色結果顯示,胎盤早剝孕婦的胎盤組織內部血管破裂和血管溶解,見圖1。

A:對照組胎盤組織母體面;B:對照組胎盤組織胎兒面;C:對照組胎盤組織HE染色; D:胎盤早剝組胎盤組織母體面;E:胎盤早剝組胎盤組織胎兒面;F:胎盤早剝組胎盤組織HE染色。圖1 兩組胎盤組織大體及HE染色病理學檢測結果
2.4 電子顯微鏡觀察胎盤早剝孕婦胎盤組織細胞焦亡情況
在透射電子顯微鏡下,可以觀察到細胞形態不完整,細胞出現溶解,同時觀察到焦亡小體的出現,見圖2。
2.5 兩組胎盤組織細胞焦亡蛋白表達水平比較
與對照組比較,胎盤早剝組的胎盤組織中caspase-1和NLRP3表達水平升高,GSDMD表達水平降低,差異均有統計學意義(P<0.001),見圖3、4。

圖3 兩組胎盤組織細胞焦亡蛋白灰度圖

a:P<0.001。圖4 兩組胎盤組織細胞焦亡蛋白相對表達水平差異柱狀圖
2.6 兩組胎盤組織焦亡基因表達水平比較
與對照組比較,胎盤早剝組的胎盤組織中caspase-1、NLRP3 mRNA表達水平升高,GSDMD mRNA表達水平降低,差異均有統計學意義(P<0.05),見表3。
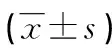
表3 兩組胎盤組織細胞焦亡基因相對表達水平比較
3 討 論
胎盤早剝是指在分娩第2階段完成之前胎盤從子宮內膜分離,連接子宮內膜和胎盤母體側的血管網絡被撕裂[9-10]。目前,胎盤早剝的確切原因尚不清楚,一種普遍的假說認為,胎盤早剝繼發于血管畸形和脆弱的血管系統,形成胎盤血管血腫,最終導致胎盤分離[11]。子宮是一種含有肌肉的彈性組織,而胎盤的彈性不如子宮。當子宮組織突然拉伸時,胎盤保持穩定,連接子宮壁和胎盤的血管結構被撕裂[12-13]。本研究收集胎盤早剝孕婦的胎盤組織發現,胎盤娩出后,胎盤表面出現幾處血凝塊。
最新版《婦產科學》教材上對于胎盤早剝的病因學沒有明確定義,不過有文獻闡述胎盤滋養層細胞通過釋放炎癥因子,誘導免疫細胞聚集,炎癥反應被過度激活,血管內皮細胞損傷,產生血管破裂出血,進而導致胎盤與子宮壁發生剝離[11,14]。本研究檢測胎盤早剝孕婦外周血清炎癥因子TNF-α、IL-1β和IL-18表達水平均高于妊娠期健康孕婦,同時胎盤早剝孕婦的胎盤組織病理學結果顯示胎盤組織內部出現血栓和血管破裂現象,說明炎癥因子可能與血管內皮細胞相互干預導致蛻膜血管收縮,以及血栓形成伴蛻膜壞死和靜脈出血。血管內皮細胞是覆蓋在血管腔內的單層細胞,為血液和血管壁間的重要物理屏障,其通過產生大量強效血管活性物質調節血管張力[15-16]。
臨床證實,炎癥或感染與胎盤早剝風險增加有關,在許多胎盤早剝病例中都發現了無菌炎性改變的特征[17]。ABINAHED等[18]發現,NOD樣受體蛋白7(NLRP7)由滋養細胞表達,受缺氧調節,NLRP7的失調被認為可能與胎盤早剝有關。炎癥變化可能在妊娠前幾周甚至妊娠前就已經發生,潛伏數周或數月。細胞焦亡是由某些炎性小體引發的細胞死亡的炎癥形式,導致GSDMD的分裂和非活性細胞因子如IL-18和IL-1β的激活[19]。細胞焦亡是血管內皮細胞死亡的一種形式,參與包括動脈粥樣硬化、心力衰竭及心肌梗死等血管損傷性疾病[20-21]。胎盤早剝屬于螺旋動脈重構不完全和由此引起的胎盤功能障礙導致的妊娠期并發癥[22]。QIU等[23]發現,高血糖誘導的NLRP3炎癥小體激活可能是一個活性氧(ROS)依賴的細胞焦亡過程,NLRP3炎癥小體誘導的焦亡加重了糖尿病大鼠心肌缺血/再灌注損傷。然而,目前尚不清楚胎盤早剝孕婦靜脈內皮細胞損傷是否與細胞焦亡有關。本研究收集胎盤早剝孕婦的胎盤組織,經過電鏡觀察到胎盤組織內部細胞含有少量的焦亡小體。同時檢測細胞焦亡的標志性分子caspase-1、NLRP3、GSDMD及其mRNA表達水平,結果顯示:與妊娠期健康孕婦的胎盤組織相比,胎盤早剝孕婦的胎盤組織中caspase-1、NLRP3及其mRNA表達水平升高,GSDMD及其mRNA表達水平降低。結合外周血清炎癥因子檢測結果和胎盤組織病理學染色結果,表明胎盤早剝孕婦的胎盤組織中發生細胞焦亡程序反應。發生在胎盤早剝的免疫學改變尚不明確,蛻膜組織中NK細胞和T淋巴細胞都有促進子宮胎盤螺旋動脈重構的作用,目前學界認為免疫細胞(NK細胞和T淋巴細胞)平衡破壞可能導致胎盤早剝[24]。根據現有資料,觀察到胎盤早剝發生的同時,子宮內膜免疫細胞的浸潤增加,介導血管成熟、穩定過程,啟動血管重塑[25]。根據本研究結果,作者推測血清TNF-α、IL-1β和IL-18等炎癥因子水平升高抑制血管重塑,造成子宮螺旋動脈滋養細胞無法重鑄,同時胎盤滋養層細胞的分化和增殖被抑制,侵襲能力降低,促使胎盤血管發育不良,引發血管內皮細胞焦亡,導致胎盤早剝發生。
綜上所述,胎盤早剝孕婦外周血炎癥因子表達水平升高,胎盤組織中存在細胞焦亡小體,細胞焦亡標志性分子的表達水平也高于健康孕婦。妊娠期胎盤疾病與血管和免疫系統的異常有關,這種異常使得胎盤內部血管損傷和壞死等問題發生,并最終導致胎盤早剝。

