一種風險預警模型對急性眩暈起病的aPCI的診斷價值*
樊艷泓,劉曉蕾,侯苗苗,張凱麗,李新毅
(山西醫科大學第三醫院/山西白求恩醫院/山西醫學科學院神經內科,太原 030032)
眩暈是神經內科疾病最常見的癥狀之一,可分為中樞性眩暈和周圍性眩暈[1]。眩暈病因眾多,機制復雜。急性后循環缺血性卒中(acute posterior-circulation ischemia,aPCI)占所有缺血性卒中的20%~25%,是卒中患者致殘和致死的重要原因[2]。臨床上部分aPCI患者僅僅表現為單純的眩暈/頭暈,不易被識別。既往研究證實,aPCI的漏診率約為前循環卒中的2.5倍[3]。漏診和誤診aPCI都會給患者造成嚴重不良后果,如后循環關鍵部位梗死嚴重者可出現呼吸驟停,危及患者生命。診斷aPCI常依賴于頭顱核磁共振,但由于條件或時間所限無法行頭顱核磁共振檢查,可能導致aPCI的誤診;部分核磁共振掃描層厚過厚也可能錯過病灶,導致aPCI的漏診。基于此,本研究擬建立一種aPCI的風險預警模型,以期有助于aPCI早識別、早診斷、早干預。
1 資料與方法
1.1 一般資料
本研究為回顧性研究,收集本院神經內科2021年12月至2022年10月期間以急性眩暈起病的住院患者的臨床資料。研究對象的納入標準:(1)主訴癥狀包括突然起病或突然加重的頭暈或眩暈;(2)發病時間小于24 h;(3)患者神志清楚,生命體征平穩。排除標準:(1)年齡小于18歲;(2)眩暈的病因是外傷、直立性低血壓、藥物食物中毒等;(3)生命體征不平穩,隨時可能因呼吸、心搏驟停等危及生命;(4)精神或智能障礙病史導致查體不能配合。經上述納入、排除標準篩選后,共有461例患者納入研究,其中375例患者(aPCI組)出院診斷為aPCI,86例患者(非aPCI組)出院診斷為良性陣發性位置性眩暈、梅尼埃病、前庭神經炎等周圍性眩暈相關疾病。
1.2 資料收集
收集入組患者臨床資料,包括以下6個方面共25項。(1)基本信息:性別、年齡。(2)既往行為史:吸煙史、飲酒史。(3)既往疾病史:高血壓、糖尿病、冠心病、腦卒中及血脂異常。(4)血清學指標:即刻血糖、白細胞計數、中性粒細胞/淋巴細胞比值(NLR)、血小板、國際標準化比值(INR)。(5)臨床癥狀:共濟失調、惡心嘔吐、飲水嗆咳、吞咽困難、構音障礙、單側肢體無力、單側肢體麻木、復視。(6)陽性體征:指鼻試驗不穩、水平眼震、巴氏征。
1.3 變量及取值
根據所收集的臨床資料設定變量如下:連續變量包括年齡、即刻血糖、白細胞計數、血小板、NLR、INR;分類變量包括性別、共濟失調、惡心嘔吐、飲水嗆咳、吞咽困難、構音障礙、單側肢體無力、單側肢體麻木、復視、指鼻試驗不穩、眼震、巴氏征、吸煙史、飲酒史、高血壓史、糖尿病史、腦卒中病史、冠心病史、血脂異常病史。除性別賦值1=女,2=男外,其他變量賦值1=是,0=否。
1.4 統計學處理
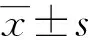
2 結 果
2.1 aPCI組和非aPCI組臨床特征
非aPCI組(n=86)和aPCI組(n=375)年齡、即刻血糖、NLR、血小板、INR比較差異無統計學意義(P>0.05),而白細胞計數差異有統計學意義(P<0.05),見表1。
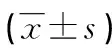
表1 兩組一般資料比較
采用χ2檢驗比較兩組19個分類變量,見表2。其中共濟失調、飲水嗆咳、構音障礙、單側肢體無力、單側肢體麻木、復視、指鼻試驗不穩、眼震、巴氏征、吸煙史、飲酒史、高血壓史、冠心病史、性別,共14項差異有統計學意義(P<0.01或P<0.05)。惡心嘔吐、吞咽困難、糖尿病史、腦卒中病史、血脂異常史這5項在兩組間差異無統計學意義(P>0.05)。
2.2 導致aPCI發生的單因素和多因素logistic回歸分析
將461例患者是否診斷aPCI進行影響因素分析,采用單因素logistic 回歸分析顯示:吸煙史、飲酒史、糖尿病史、NLR、INR、共濟失調與aPCI發生顯著相關(P<0.05),見表3。

表3 aPCI發生的單因素和多因素logistic回歸分析
多因素logistic回歸分析顯示,上述6項臨床資料均是aPCI發生的風險因素,風險預警模型如下:
ln(p/1-p)=1.166+ 1.133×吸煙史+1.011×飲酒史+2.100×糖尿病史+0.191×NLR+1.117×共濟失調-5.3×INR。
2.3 風險預警模型對aPCI的診斷價值
通過繪制ROC曲線(圖1)了解風險預警模型對aPCI的診斷價值:AUC為0.819,標準誤0.024,最佳界值0.512,95%CI:0.773~0.866,P<0.01,表明該風險預警模型具有較高的診斷價值,Cut-off值為0.856分,靈敏度為0.640,特異度為0.872。Hosmer-Lemeshow擬合優度檢驗,χ2=7.805,P=0.453,提示風險預測模型有較好的校準能力。

圖1 風險預警模型診斷aPCI的ROC曲線
3 討 論
合并眩暈的aPCI較前循環缺血性腦卒中容易更容易發生漏診誤診,若能早期識別aPCI將有助于臨床醫生早期篩選出高危患者及時開展治療。
動脈粥樣硬化是缺血性腦卒中的重要病理基礎,其形成與炎性介質、氧化應激密切相關,吸煙可刺激過氧化物與炎性因子的生成,雙重因素作用下導致血管內皮細胞受損[4]。動脈粥樣硬化斑塊被發現含有各種炎癥細胞,它們在梗死部位激活和募集促炎介質(如TNF-α和IL-6)和相關生物標志物(如CRP)從而導致卒中后的神經元損傷[5],有學者認為NLR對急性缺血性腦卒中發生及預后有很強的預測價值[6],NLR水平與頸動脈斑塊易損程度呈正相關,穩定的頸動脈斑塊更容易隨著NLR水平的升高向易損頸動脈斑塊轉移,而斑塊易損極易發生血栓栓塞事件,最終導致腦卒中的發生[7]。
糖尿病是公認的腦卒中重要的危險因素,與腦卒中的發生及預后差相關,血糖調節異常的腦卒中患者不易從靜脈溶栓這種治療方式中獲益,且腦卒中并發癥使糖尿病患者發生中風的概率增加[8]。血糖升高也會產生氧化應激和炎癥反應,高血糖通過蛋白酶C、晚期非酶糖基化終末產物等多種等途徑導致線粒體呼吸鏈中活性氧自由基和活性氮自由基生成增多,最后使抗氧化物及氧化物之間失去平衡,信號通路異常;且激發多種炎癥介質,導致血管內皮細胞受損、促進血栓形成最后導致aPCI發生[9]。
部分研究學者認為大量飲酒與腦卒中發生相關,其潛在機制可能是,酒精攝入后,血漿皮質醇、腎素血管緊張素水平升高及腎上腺素神經活動加強有關,并導致高凝狀態,減少腦血流量以及增加心房顫動風險,從而增加腦卒中發生[10]。
共濟失調主要見于小腦半球或其與額葉皮質間的聯系纖維受損、前庭系統病變及深感覺傳導路病變。成人常見的病因中包括后顱窩疾病如aPCI,若出現此癥狀應高度重視后循環部位的腦組織病變,及時干預。然而,目前臨床工作中尚缺少評估共濟失調與腦卒中發生相關性的評估量表,既往腦卒中診斷中常用的NIHSS(National Institute of the Health Stroke Scale)評分被認為在診斷aPCI中并不敏感,NIHSS中共濟失調項評分主要依據雙側指鼻試驗、跟膝脛試驗是否穩準,而四肢肌力影響上述兩項體征的判斷,且不評估軀干共濟失調,也有研究者認為SARA作為一種用于脊髓小腦變性患者的共濟失調評估指標也可應用于評估aPCI中,但仍需臨床實踐的證實[11]。
本研究中,通過統計學分析驗證了吸煙史、飲酒史、糖尿病史、NLR、共濟失調與aPCI的發生呈正相關,依據多因素logistic回歸系數得出糖尿病史與aPCI的發生相關性更大。
研究認為高凝狀態在急性腦卒中疾病的發生、發展過程中發揮著重要的作用[12]。本研究中,INR在兩組樣本間具有差異性,非aPCI患者的INR(1.03)高于aPCI患者(1.01),但二組INR數值差異不大。考慮INR是由凝血酶原時間和測定試劑的國際敏感指數推算得出,受多種因素因素影響,如:藥物、食物、基因等,可能導致結果存在誤差,INR對于診斷aPCI敏感性、特異性有待進一步深究。臨床工作中,因房顫所致心源性腦栓塞患者長期口服抗凝劑,所以需常規監測INR,目前有研究認為心源性腦卒中患者發病時若INR>1.7,預后較好[13]。
既往學者認為:男性,高齡(65~69歲缺血性腦卒中發生可能性更大)[14];有高血壓史、血脂異常史,尤其是低密度脂蛋白控制不佳的患者[15];既往腦卒中診斷分型為大動脈粥樣硬化和心源性腦栓塞[16];冠心病史[17]的患者更易患aPCI,但由于本研究樣本量仍不足,導致國內外有意義的風險因素未出現統計學意義,可進一步擴大樣本量,納入更多臨床資料,完善風險預警模型。
aPCI病因眾多,癥狀多樣,以往NIHSS評分等方式對其敏感性較低;且由于后循環供血部位結構精細,有時核磁DWI序列不能精準捕捉病灶信息,導致漏診、誤診,診斷具有挑戰性。隨著血管內介入治療的發展,BAOCHE研究結果提示發病6~24 h急性基底動脈閉塞卒中患者接受血管內治療較藥物治療可提高90 d功能預后[18]。風險預警模型的建立可幫助臨床醫生篩選aPCI高危人群,及早完善血管檢查(如頭顱MRA、頭頸CTA、DSA等),盡早開始治療,如溶栓、取栓等,緩解癥狀、改善預后、提高生存率。本研究樣本量相對較少,國內外一些與腦卒中相關的指標未被法納入風險預警模型中,該模型仍需在更多的臨床實踐中加以驗證并完善。

