非小細胞肺癌骨轉移放療聯合免疫治療對比單純放療的回顧性研究
張雯雯,王明偉,許映華,李曙光,俞華林,李 偉
(南通市第三人民醫院放療科,江蘇 南通 226001)
最新數據表明,肺癌的發病率和致死率居全球首位[1]。非小細胞肺癌(Non-small-cell lung cancer,NSCLC)作為肺癌最常見的病理類型,約占全部肺癌的85%,其中有超過50% 的患者會發生骨轉移,可導致骨不良事件(Skeletal related events,SREs)的發生,降低患者的生活質量,縮短生存時間[2]。放療(Radiotherapy)可有效緩解NSCLC 骨轉移引起的疼痛,降低SREs 的發生風險。免疫檢查點抑制劑(Immune checkpoint inhibitors,ICIs)可以重新激活T 細胞免疫,已經被成功用于所有階段的NSCLC 患者的治療中。近年來,越來越多研究NSCLC 免疫治療聯合放療的臨床試驗得到開展,但尚未得到一致性結論[3]。此外,關于NSCLC 骨轉移患者免疫治療聯合放療的研究尚未開展。因此,本中心回顧性選取了33 例NSCLC 骨轉移患者,探究骨轉移放療聯合免疫治療對比單純放療的療效及毒副反應情況。
1 資料與方法
1.1 一般資料
回顧性選取2018 年1 月至2020 年12 月南通市第三人民醫院放療科收治的33 例NSCLC 骨轉移患者作為研究對象。納入標準:(1)符合《原發性肺癌診療規范(2017 年版)》診療標準,確診NSCLC,符合骨轉移標準并有可測量評估的病灶;(2)既往未接受過任何抗腫瘤治療;(3)精神及認知功能正常;(4)一般情況良好,可以耐受放療;(5)預計生存時間≥3 個月;(6)病歷及隨訪資料完整。排除標準:(1)孕婦及哺乳期女性;(2)合并其他惡性腫瘤者;(3)合并自身免疫性疾病者;(4)合并嚴重基礎疾病者;(5)出現嚴重并發癥,需重癥監護支持治療者。根據治療方式的不同將患者分為放免組(17 例)和放療組(16例)。兩組的年齡、性別、吸煙史、ECOG 評分、病理類型、組織分化程度、程序性死亡受體配體1(PDL1)表達水平及轉移灶數量等一般資料相比,差異無統計學意義(P>0.05)。
1.2 方法
兩組均予以常規鎮痛、營養支持等對癥治療。在此基礎上,放療組采取適型調強放療技術治療,放射劑量為30 Gy/3 Gy×10 F/2 周。放免組在放療組的基礎上聯合信迪利單抗注射液治療,200 mg ivgtt q3w(200 mg,靜脈滴注,每3 周一次),當患者出現嚴重免疫副反應、疾病進展或其他嚴重意外狀況時停藥。
1.3 療效判定標準與觀察指標
比較兩組的近期療效及中位總生存期(OS),療效評估依據RECIST1.1 標準[4],分為完全緩解(CR)、部分緩解(PR)、穩定(SD)、進展(PD)。客觀緩解率(ORR)= 完全緩解(CR)率+部分緩解(PR)率;疾病控制率(DCR)=完全緩解(CR)率+部分緩解(PR)率+ 穩定(SD)率。比較兩組治療前后的免疫指標,包括CD4+T 細胞、CD8+T 細胞及CD4+T 細胞/CD8+T細胞。比較兩組治療前后的血清腫瘤標志物水平,包括血清癌胚抗原(CEA)、可溶性細胞角蛋白19 片段(CYFRA21-1)、神經元特異性烯醇化酶(NSE)。比較兩組治療后毒副反應的發生情況。
1.4 統計學方法
采用SPSS 23.0 統計軟件分析數據,計數資料以[例(%)] 表示,采用χ2 檢驗,非正態分布資料用中位數(四分位間距)M(P25,P75)表示,采用Mann-Whitney U 秩和檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 兩組近期療效及OS 的對比
放免組的ORR 為52.94%,DCR 為82.35%,均高于放療組的18.75% 和43.75%,差異有統計學意義(P<0.05)。詳見表1。治療結束后定期隨訪發現,放免組的OS 為4 ~42 個月,中位OS 為29 個月;放療組的OS 為4 ~29 個月,中位OS 為15 個月。放免組的OS 較放療組顯著延長,差異有統計學意義(P<0.05)。詳見圖1。

圖1 兩組的生存曲線圖

表1 兩組近期療效的對比[例(%)]
2.2 兩組治療前后的免疫指標的對比
治療前,兩組的CD4+T 細胞、CD8+T 細胞水平及CD4+T 細胞/CD8+T 細胞比值相比,差異無統計學意義(P>0.05)。治療后,放免組的CD4+T 細胞水平和CD4+T 細胞/CD8+T 細胞比值均高于放療組,CD8+T 細胞水平低于放療組,差異有統計學意義(P<0.05)。詳見表2。
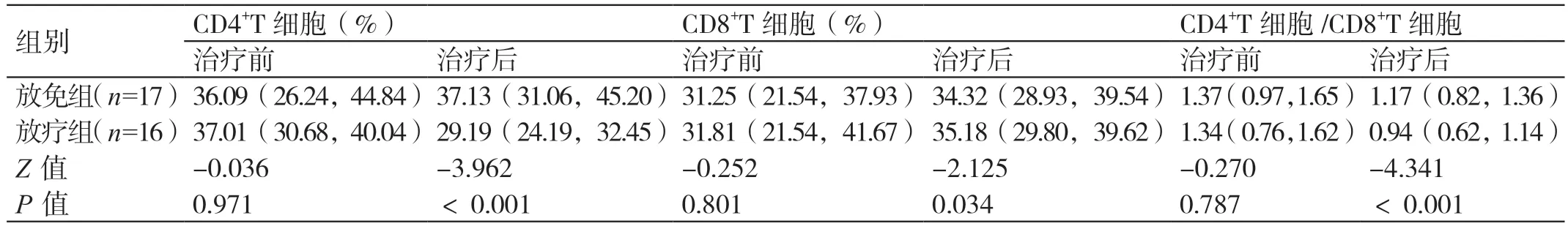
表2 兩組治療前后的免疫指標的對比[M(QL,QU)]
2.3 兩組治療前后血清腫瘤標志物水平的對比
治療前,兩組的血清CEA、CYFRA21-1、NSE水平相比,差異無統計學意義(P>0.05)。治療后,放免組的血清CEA、NSE 水平均較治療前降低,放療組的血清CEA、CYFRA21-1、NSE 水平均較治療前升高。治療后,放免組的血清CEA、CYFRA21-1、NSE 水平均低于放療組,差異有統計學意義(P<0.05)。詳見表3。
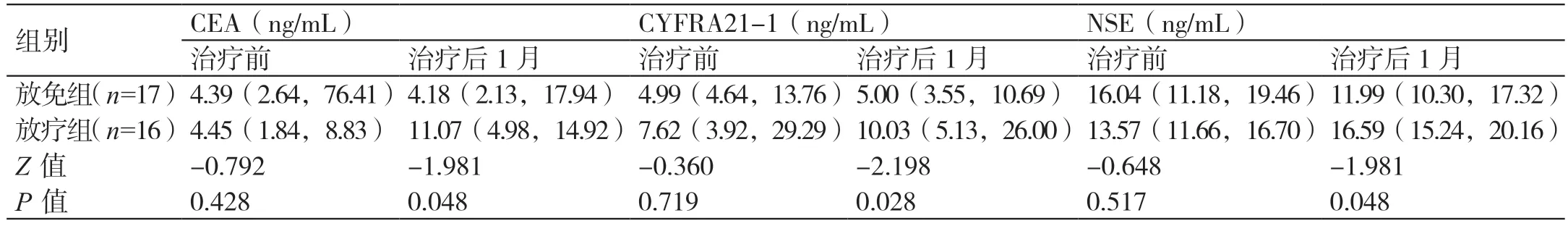
表3 兩組治療前后血清腫瘤標志物水平的對比[M(QL,QU)]
2.4 兩組治療后毒副反應發生情況的對比
治療后,放免組的毒副反應有骨髓抑制(1 例)、肺炎(2 例)、甲狀腺功能減退(1 例);放療組的毒副反應有骨髓抑制(1 例)、肺炎(1 例)。治療后,兩組骨髓抑制、肺炎、甲狀腺功能減退的發生率相比,差異無統計學意義(P>0.05)。詳見表4。
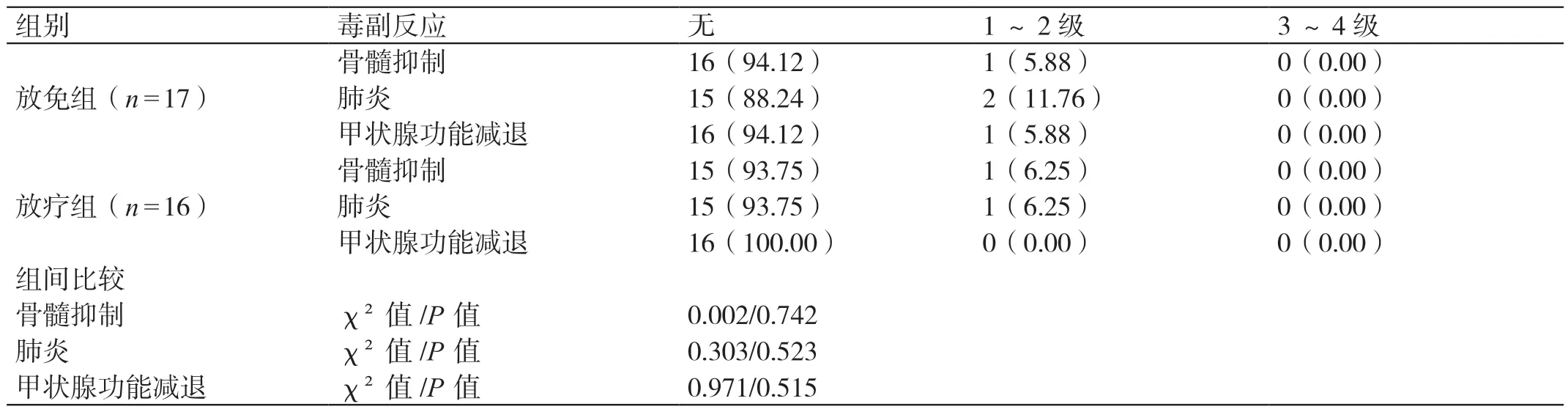
表4 兩組治療后毒副反應發生情況的對比[例(%)]
3 討論
肺癌目前是我國致死率排名第一的惡性腫瘤,骨轉移是肺癌最常見的遠處轉移,50% ~70% 的肺癌骨轉移患者會出現骨骼或神經病理性疼痛、病理性骨折、高鈣血癥、神經根損傷或脊髓壓迫等表現。盡管少數單發的肺癌骨轉移可以被治愈,但是對于大多數患者而言,骨轉移的治療是姑息性的。肺癌骨轉移的治療包括常見的放療、放射性同位素治療、雙膦酸鹽類藥物治療、三階梯藥物鎮痛治療、手術治療等。全身化療及內分泌治療亦可在治療腫瘤原發病灶的同時起到控制骨轉移發展、緩解疼痛的作用[5]。近年來,免疫治療在腫瘤治療中的地位日益突出,其關鍵機制是特異性結合程序性死亡受體1(PD-1)/PD-L1或CTLA-4 靶點,現已成功應用于各期NSCLC 的治療中,并顯示出良好的臨床療效。PD-1 抑制劑能夠阻斷腫瘤細胞或抗原提呈細胞表面PD-L1 受體與CD8+T 細胞表面PD-1 受體的相互作用,重新激活CD8+T 細胞的殺傷腫瘤能力,從而發揮抗腫瘤作用。目前,局部姑息性放療仍然是骨轉移瘤最重要的治療方式之一,可以有效緩解疼痛癥狀并保留骨的功能性和完整性[6]。現階段,關于NSCLC 骨轉移放療聯合免疫治療的研究尚不充分。在本研究中我們回顧性選擇了33 例NSCLC 骨轉移患者,分為放免組與放療組,通過對比兩組的療效發現,放免組較放療組DCR 明顯升高(82.35% vs 43.75%),OS 延長(中位OS :29 個月 vs 15 個月),且未增加嚴重不良反應。KEYNOTE-001 研究的二次分析發現,在應用派姆單抗之前接受任何放療的患者其無進展生存期(PFS)和OS 均顯著延長。王康馨等[7]的研究也發現,PD-1/PD-L1 抑制劑和放療聯合治療可以改善晚期NSCLC 患者的OS、PFS 和腫瘤應答率,且不增加嚴重不良事件。這與我們的研究結果相一致。
放療被認為是一種免疫調節手段,是引發免疫反應的最強治療方式之一[8]。局部放療不僅可以通過增加腫瘤特異性抗原的呈遞而起到“原位疫苗”的作用,還可以調節腫瘤免疫微環境,使“冷腫瘤”轉變為“熱腫瘤”,從而增強全身免疫反應[9]。本研究結果也表明,治療后放免組的CD4+T 細胞水平較治療前升高,提示放療能夠激活患者的免疫功能,產生免疫應答,提高患者的DCR 并延長生存時間。放療與免疫治療在單獨使用時都能在正常組織中引起毒性,聯合治療也可能導致毒性特征和機制的重疊[10]。本研究中,放免組中1 例出現2 級骨髓抑制,2 例出現間質性肺炎,1 例出現甲狀腺功能減退,放療組中1 例出現2 級骨髓抑制,1 例出現間質性肺炎,兩組骨髓抑制、肺炎、甲狀腺功能減退的發生率相比無統計學差異(P>0.05)。兩組患者均未出現3 級及以上的毒副反應。有趣的是,多項研究表明,在接受放療聯合免疫治療的NSCLC 患者中,多系統免疫相關不良事件可能延長PFS 和OS 或增加ORR 并延緩疾病進展[7],這表明免疫相關性不良事件可能是免疫系統激活的標志。
綜上所述,相較于單純放療,給予NSCLC 骨轉移患者放療聯合免疫治療療效更優,能有效延長患者的DCR 和OS,增強免疫功能,并具有可控的毒副反應。但本研究仍存在樣本量小、放療技術待改進等不足。有研究表明,當聯合免疫治療時,體部立體定向放射治療(stereotactic body radiotherapy,SBRT)較常規放療是更好的選擇[11]。在未來的研究中,除擴大樣本量外,治療順序、放療技術、劑量及部位均需要納入考慮,以評估免疫治療和放療聯合治療的安全性和有效性。

