基于復合誘變選育高抑菌活性植物乳桿菌
毛 銀, 盧艷波, 楊小雁, 馬忠瑪, 劉穎穎, 鮑青青, 鄧 禹*
(1. 江南大學糧食發酵與食品生物制造國家工程研究中心, 江蘇 無錫 214122; 2. 山東渤海實業集團有限公司山東省油脂油料精深加工技術重點實驗室,山東 濱州 256500)
在食品制造和儲藏過程中,致病菌的污染影響了食品的質量安全,對人類健康造成了嚴重的危害[1-2]。盡管傳統的添加化學防腐劑來延長食品保質期的方法已取得了相當大的進展,但隨著人們對“清潔標簽”食品需求的不斷增加,尋找安全、綠色、高效的防腐物質來取代化學衍生物質具有重要意義[3]。
現代生物技術的不斷發展為解決上述問題提供了理論支撐。 研究表明,乳酸菌在培養過程中會產生大量抑菌代謝物,如有機酸、脂肪酸、乙偶姻、過氧化氫、蛋白質類化合物、苯乳酸、細菌素和過氧化氫等[4-5]。 這些物質在不同的體系中可以單獨或協同發揮抑菌作用[6-7],且不影響食品感官特性和人體健康[8-9]。 因此,使用無毒、無副作用的高抑菌活性乳酸菌及其代謝產物作為天然防腐劑可用于控制食品腐敗及致病菌的生長,為食品添加劑安全問題提供了良好的解決方案[10-11],極具應用前景。
通過微生物誘變育種的手段來獲得高抑菌活性的乳酸菌,是提升菌株抑菌性能的有效方式[12]。物理誘變雖然具有安全性高、 變異范圍廣等優勢,但也存在誘變設備要求較復雜、誘變專一性較差等缺點。 化學誘變雖然具有誘變效果強的優點,但操作時存在安全性差的問題。 由于物理、化學誘變存在各自的局限性,同時長期的單一處理容易造成生長周期延長、代謝減緩等菌種退化問題,所以常采用多種誘變劑復合處理的方式進行誘變育種[13]。 復合誘變可以擴大突變的位點,使誘變方式起到協同作用,更易獲得性能優良的菌株[14]。
隨著高通量測序技術和生物信息學的快速發展, 具有高抑菌活性菌株的抑菌機理逐步得到闡明。 基因組重測序手段可以挖掘全基因組范圍內的基因和結構差異,從而獲得與抑菌性能相關的變異基因[15]。 作者所在團隊前期從自然發酵的酸菜中篩選到一株抑菌性能較好的植物乳桿菌DY6,并對其抑菌活性物質進行了初步研究,但其抑菌機理尚不清楚[16]。因此,作者首先通過常壓室溫等離子體和亞硝基胍對植物乳桿菌DY6 進行復合誘變,篩選獲得了高抑菌活性的菌株。 隨后通過基因組重測序技術系統分析了植物乳桿菌DY6 和其誘變菌株的遺傳差異,對抑菌性能相關的變異基因進行初步挖掘與分析,為植物乳桿菌在飼料和食品防腐領域的應用提供了有益借鑒。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株 植物乳桿菌DY6:作者所在實驗室保藏;大腸桿菌(ATCC25922):中國普通微生物菌種保藏中心提供。
1.1.2 培養基 MRS 培養基(g/L):胰蛋白胨10.0,牛肉膏8.0,酵母粉4.0,葡萄糖20.0,K2HPO42.0,檸檬酸三銨 2.0,CH3COONa 5.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐溫80 1 mL;pH 6.3~6.5,115 ℃滅菌30 min。
LB 液體培養基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0;pH 自然,115 ℃滅菌30 min。
所有固體培養基中瓊脂粉質量濃度為2 g/dL,半固體培養基中瓊脂粉質量濃度為1 g/dL。
抑菌活性測定所用培養基為雙層LB 培養基,即上層為半固體培養基加指示菌,下層為固體培養基。
1.1.3 儀器與試劑 UV-1800 分光光度計:上海翱藝儀器有限公司產品;電熱恒溫培養箱:上海善志儀器設備有限公司產品;多功能酶標儀:美國Bio-Tek 有限公司產品;Artp-iis ARTP 誘變系統:無錫源清天木生物科技有限公司產品;游標卡尺(0~150 mm):桂林廣陸數字測控股份有限公司產品。
葡萄糖、胰蛋白胨、牛肉膏、CH3COONa、吐溫80、NaCl、亞硝基胍、丙酮等:國藥化學試劑有限公司產品。
1.2 高抑菌活性誘變菌株的選育
1.2.1 抑菌活性的測定 以大腸桿菌作為指示菌,采用牛津杯法測定植物乳桿菌抑菌活性[16]。 首先將大腸桿菌接種至LB 液體培養基中,37 ℃、250 r/min培養12 h,制備菌液。 然后將待測菌株接種至MRS培養基中,37 ℃、250 r/min 培養24 h,制備發酵液,隨后12 000 r/min 離心10 min 制備發酵上清液,用于抑菌活性測定。
通過雙層LB 培養基測定菌株的抑菌活性,控制上層半固體培養基中大腸桿菌的菌體濃度為1×108CFU/mL。 在此基礎上等距離擺放牛津杯(4~5個)后放置在水平臺面上凝固。 然后在牛津杯中加入待測的發酵上清液200 μL,37 ℃培養15 h 后測量上清液對指示菌產生的抑菌圈直徑,每次測定做3 組平行。
1.2.2 常壓室溫等離子體(ARTP)誘變 菌懸液的制備: 將植物乳桿菌在37 ℃、250 r/min 培養12 h,12 000 r/min 離心10 min 收集菌體并用生理鹽水清洗3 次,最后稀釋成1×107CFU/mL 的菌懸液。
ARTP 誘變:取10 μL 菌懸液涂在金屬載片上,將其放入ARTP 誘變系統操作室,控制功率100 W,氣流量為10 L/min,照射距離為2 mm。誘變結束后,將載片移至裝有生理鹽水的離心管內,迅速振蕩樣品。 將誘變后的菌懸液涂布于MRS 平板上,待長出單菌落后測定平板菌落數,以未處理的菌懸液作為對照,計算致死率[17],每組實驗3 個平行:
式中:F 為致死率,%;Nc為對照平板菌落數;Nm為誘變平板菌落數。
1.2.3 亞硝基胍(NTG)誘變 NTG 母液的配備:取0.02 g NTG 加入1 mL 丙酮配制成質量濃度為20 g/L的NTG 母液, 再用磷酸緩沖液稀釋至NTG 質量濃度為2 g/L。
NTG 誘變: 在1 mL 的植物乳桿菌菌懸液中加入適量的NTG 溶液和磷酸緩沖液, 控制NTG 的終質量濃度分別為0.25、0.50、0.75、1.00 mg/mL, 混合均勻后放置在37 ℃、250 r/min 的搖床中振蕩處理30 min,6 000 r/min 離心10 min 收集菌體并用磷酸緩沖液清洗3 次。 將誘變后的菌懸液涂布于MRS平板上,待長出單菌落后測定平板菌落數,以未處理的菌懸液作為對照,計算出NTG 的致死率,每組實驗測定3 組平行。
1.2.4 復合誘變 將ARTP 誘變后抑菌圈直徑有明顯提高的突變菌株作為出發菌株,對其進行NTG 誘變,篩選抑菌活性較出發菌株有顯著提高的突變菌株。
1.2.5 誘變菌株的初篩 參考Gerez 等的方法[18]并稍加修改, 通過96 孔板法測定植物乳桿菌對大腸桿菌的抑制效果。 將誘變后的菌株接種于200 μL MRS 培養基中,37 ℃、250 r/min 培養12~16 h。隨后轉接至96 孔板中, 接種體積分數為2%,37 ℃、250 r/min 培養24 h。 通過96 孔板法測定植物乳桿菌誘變菌株對大腸桿菌的抑制效果。 將50 μL 大腸桿菌菌懸液(1×108CFU/mL)和150 μL 植物乳桿菌誘變菌株的發酵上清液添加到96 孔板中,37 ℃、250 r/min 培養24 h 后用酶標儀測定OD600nm值,以接種大腸桿菌菌懸液于MRS 培養基的孔板作為對照組,計算誘變菌株的抑菌率:
式中:I 為抑菌率,%;As為實驗組在600 nm 處的吸光度;Ac為對照組在600 nm 處的吸光度。
1.2.6 誘變菌株的復篩及遺傳穩定性測試 以初篩后抑菌率較高的菌株作為篩選對象,將其接種于MRS 培養基中,37 ℃、250 r/min 培養24 h 制備發酵液。 采用牛津杯法測定菌株的抑菌活性,以抑菌圈直徑為篩選高抑菌活性誘變菌株的唯一標準進行復篩。 選取ARTP 誘變以及復合誘變復篩后抑菌活性較高的菌株,對其連續傳代,用牛津杯法測定每一代菌株的抑菌活性,評估誘變菌株的遺傳穩定性。
1.3 基因組重測序
植物乳桿菌DY6 和誘變菌株在37 ℃、250 r/min培養12 h 后提取基因組DNA 用于全基因組測序,測序工作由上海生工生物工程有限公司完成。 首先選擇質檢合格的基因組DNA 制備用于IlluminaTM二代測序平臺的DNA 文庫。 測序完成后將初始數據進行質量評估后過濾得到高質量的數據,與參考基因組植物乳桿菌WCFS1 (NC_004567.2) 進行比對。 使用GATK 的HaplotypeCaller 分析樣品和參考基因組之間的基因型差異, 并通過DELLY、CNVnator 軟件對樣品的SV、CNV 進行檢測。根據參考基因組的注釋信息,利用SnpEff 軟件對突變進行注釋。
2 結果與分析
2.1 常壓室溫等離子體誘變菌株的篩選
2.1.1 ARTP 最佳誘變時間 通過ARTP 對植物乳桿菌DY6 的菌懸液進行誘變處理,將經過不同照射時間(0、10、20、30、40 s)的菌懸液分別涂布于MRS平板上,待長出單菌落后進行菌落計數,計算致死率。結果如圖1 所示,ARTP 誘變對植物乳桿菌DY6的致死率隨著誘變時間的增加而不斷升高,表明該菌株對ARTP 誘變非常敏感。 當處理時間為20 s時, 菌株致死率達到91.3%; 當處理時間達到40 s時,平板上無菌株生長。 由于菌株的致死率大于90.0%時,突變菌株中能有較高的正向突變且回復突變的概率較小[19],故選擇ARTP 誘變的時間為20 s。

圖1 ARTP 誘變致死率Fig. 1 Fatality rate curve of ARTP mutation system
2.1.2 ARTP 誘變菌株的初篩 將植物乳桿菌DY6的菌懸液在ARTP 誘變系統中處理20 s 后涂布于MRS 平板上,37 ℃培養48 h 挑取單菌落接種于96孔板。 依據1.2.5 中的方法篩選抑菌性能較強的菌株, 由于具有抑菌效果的植物乳桿菌上清液的添加,孔板中大腸桿菌的生長受到了抑制,因此實驗組孔板的OD600nm會低于對照組。據此,通過公式(2)計算各菌株的抑菌率,篩選抑菌率大于野生型菌株(DY6)的誘變菌株,將其編號為A1~A62(見圖2)。在所有正突變菌株中,菌株A4、A28、A55 的抑菌率有顯著提高,分別為61.48%、59.48%、60.02%。
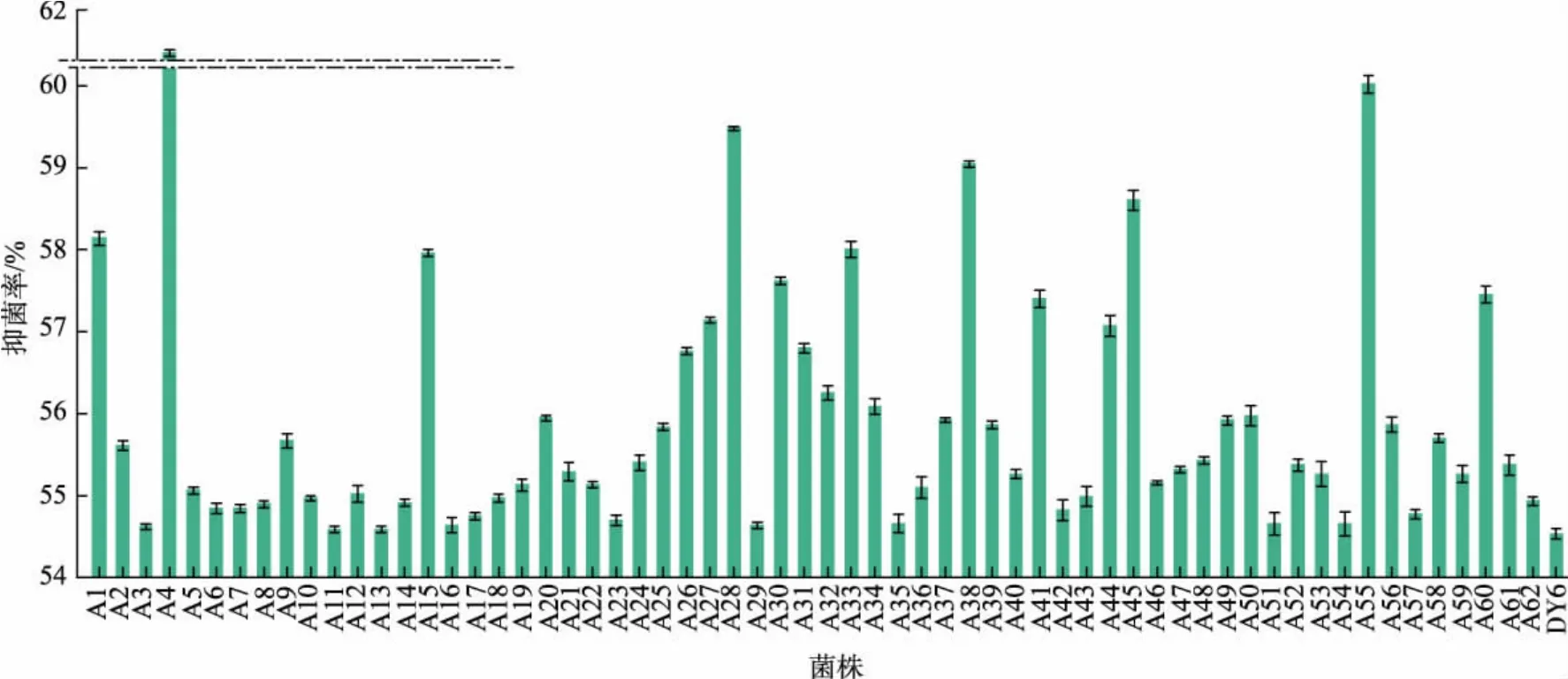
圖2 ARTP 誘變菌株的初篩Fig. 2 Preliminary screening of ARTP mutant strains
2.1.3 高抑菌活性ARTP 誘變菌株的復篩 選取抑菌性能優良的A4、A28、A38、A45、A55 共5 株誘變菌株, 通過牛津杯法測定其抑菌活性進行菌株復篩。結果如圖3 所示,5 株誘變菌株的抑菌活性均高于野生型菌株(DY6)。 其中菌株A4 和A55 的抑菌圈直徑較大, 抑菌活性相對于野生型植物乳桿菌DY6 分別提高了16.38%和14.47%。因此,后續研究中選擇菌株A4 作為復合誘變菌株。

圖3 ARTP 誘變菌株的復篩Fig. 3 Rescreening of ARTP mutant strains
2.2 復合誘變菌株的選育
2.2.1 NTG 誘變劑量優化 與ARTP 誘變一致,在進行NTG 復合誘變前, 首先需要確定NTG 的最佳處理劑量。 依照1.2.3 中的方法,向待誘變菌株菌懸液中加入不同體積的NTG 母液,控制其終質量濃度分別為0.25、0.50、0.75、1.00 mg/mL, 以未添加NTG的菌懸液作為對照,反應后涂布于MRS 平板上,計算NTG 對植物乳桿菌的致死率。 結果如圖4 所示,隨著菌懸液中NTG 質量濃度的增加,致死率也逐漸上升。 當使用0.50 mg/mL NTG 處理植物乳桿菌時,菌株的致死率達到90.0%以上。 由于過高的NTG 質量濃度會導致菌體的活力下降, 而質量濃度太低時則會導致突變菌株不穩定, 故選取0.50 mg/mL 為NTG 的最佳誘變質量濃度, 以利于正突變菌株的產生。
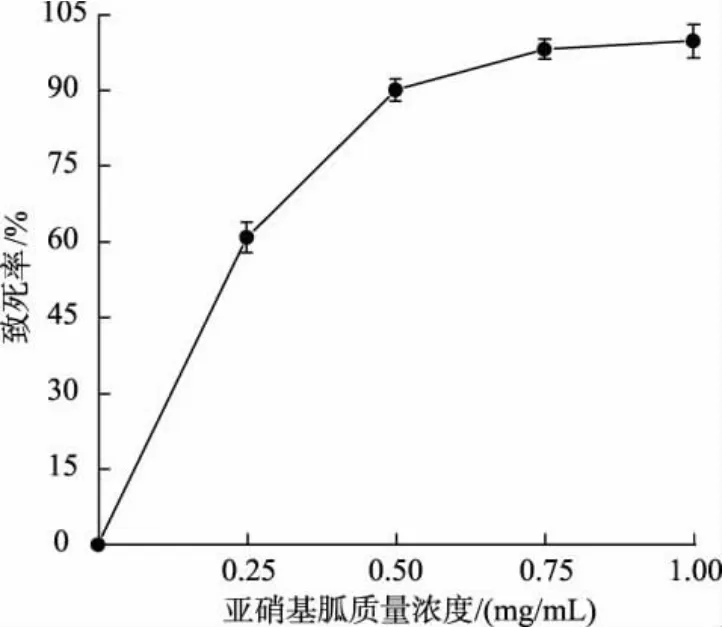
圖4 NTG 質量濃度對菌株致死率的影響Fig. 4 Effect of mass concentration of NTG on mortality rate of strain
2.2.2 ARTP 和NTG 復合誘變菌株的初篩 選取ARTP 誘變后抑菌性能最佳的植物乳桿菌A4 作為出發菌株制備菌懸液,添加終質量濃度為0.50 mg/mL 的NTG 進行誘變, 以不添加NTG 的菌懸液作為對照,誘變后涂布于MRS 平板上。 待長出單菌落后測定各菌株的抑菌率,篩選抑菌性能較高的菌株。 復合誘變后正突變菌株的數量有所增加,抑菌性能也有了進一步提升。 將所有正突變菌株分別編號為AN-1~AN-72(見圖5),其中菌株AN-55、AN-58、AN-68 的抑菌率較高,分別為63.09%、74.45%、66.55%。

圖5 復合誘變初篩結果Fig. 5 Preliminary screening results of mutants by compound mutagenesis
2.2.3 高抑菌活性復合誘變菌株的復篩 選取抑菌性能優良的AN-7、AN-34、AN-55、AN-58、AN-68 共5 株誘變菌株, 通過搖瓶發酵制備上清液,測定抑菌活性進行菌株復篩。 結果如圖6 所示,菌株AN-55、AN-58 和AN-68 的抑菌圈直徑較大, 抑菌活性相對于野生型植物乳桿菌DY6 分別提高了19.83%、21.91%和18.40%。

圖6 復合誘變復篩結果Fig. 6 Re-screening of mutants by compound mutagenesis
2.2.4 誘變菌株的遺傳穩定性實驗 由于誘變菌株在很多情況下會出現不穩定的情況,所以需要采用多次傳代的方式來排除遺傳性能不穩定的菌株。首先選取ARTP 誘變篩選得到的抑菌活性較高的菌株A4、A55 和復合誘變篩選得到的抑菌活性較高的菌株AN-55、AN-58、AN-68 進行連續傳代,測試每次傳代后各菌株的抑菌活性,共傳代8 次。 結果如圖7 所示,在每次傳代中,復合誘變菌株的抑菌活性(抑菌圈直徑)普遍高于ARTP 單一誘變菌株,表明復合誘變更有利于獲得性能優良的菌株。 在所有誘變菌株中, 菌株AN-55 和AN-58 的抑菌性能較為穩定,經8 次傳代后抑菌活性相較于野生型菌株提高了20.51%、18.84%。

圖7 突變菌株遺傳性穩定結果Fig. 7 Genetic stability of mutant strains
2.3 植物乳桿菌全基因組重測序分析
2.3.1 突變基因功能注釋 結合上述研究,選擇復合誘變后抑菌性能最穩定的菌株AN-55 和出發菌株植物乳桿菌DY6 進行全基因組重測序。以植物乳桿菌WCFS1(NC_004567.2)的基因組作為參考基因組, 將菌株AN-55 和DY6 的重測序結果與其進行比對,結果如表1 所示,誘變后的菌株AN-55 定位到參考基因組的比例相較于出發菌株有所增加。 與出發菌株植物乳桿菌DY6 相比, 菌株AN-55 中發生突變的位點有70 個, 其中單核苷酸多態性位點(SNP) 44 個,插入缺失位點(InDel)26 個;注釋到的突變基因有27 個, 所有基因的突變類型包括錯義突變、移碼突變、框內插入或缺失。 在GO 數據庫功能注釋中(見圖8),共有50 個基因被注釋到不同的功能層面,包括生物過程層面、分子功能層面、細胞組分層面以及其他層面。 生物過程層面中,這些注釋的基因主要參與了代謝途徑及細胞過程等;在分子功能層面中, 注釋的基因則主要參與轉運等過程;細胞組分層面中,在細胞膜組分中被注釋的基因較多。

表1 基因組重測序數據統計Table 1 Genetic resequencing data statistics

圖8 GO 數據庫功能注釋Fig. 8 GO database function annotation
2.3.2 突變基因分析 研究發現植物乳桿菌的抑菌能力主要來源于其代謝產物[20]。 在誘變菌株AN-55 注釋的所有突變基因中,推測與抑菌性能相關的基因及其突變位點列于表2。 其中,plnK 是一種細菌素的編碼基因,這種細菌素對于近源的細菌有較好的抑制作用。PlnK 屬于Ⅱb 類細菌素,這類細菌素通過2 個多肽相互作用發揮抑菌功能。 研究表明細菌素PlnK 和PlnJ 兩個多肽鏈混合時可以破壞細胞膜的功能,使得抑菌效果明顯增強[21]。 菌株AN-55中plnK 發生位點突變,從其抑菌效果來看,推測這一突變可能是正向的,有利于增強菌株的抑菌能力。

表2 抑菌性相關基因突變位點變化Table 2 Changes of antibacterial related gene mutation sites
糖基轉移酶(GT1 家族,基因cps4G)是一個尿苷二磷酸(UDP)糖基依賴的轉移酶超家族,主要以UDP-己糖或其衍生物為糖基供體,通過糖基化反應形成種類繁多的糖基化衍生物,其中的部分衍生物具有抑菌性能[22-23]。 糖基轉移酶也是糖苷類抗生素合成途徑中的關鍵酶,可以催化合成具有較好抑菌性能和廣泛抑菌譜的糖苷類抗生素。 Ostash 等研究明確了莫諾霉素合成途徑的GT1 催化關鍵環節,將首個糖基連接到法尼基焦磷酸上[24]。另外,熊永剛通過過表達引導糖基轉移酶將植物乳桿菌的胞外多糖產量提升了30.15%,并發現該多糖對擴展青霉等致病菌的生長具有明顯的抑制作用[25]。 在轉錄組學中,過表達糖基轉移酶基因影響了糖酵解和糖異生途徑中葡萄糖-6-磷酸的合成, 進而提高了胞外多糖的產量。由此推測誘變菌株AN-55 的cps4G 可能存在正向突變,促使菌株產生具有抑菌性能的糖基化衍生物及其他物質,進而影響其抑菌性能。
菌株AN-55 中注釋到磷酸轉移酶(PTS)系統中的甘露糖特異性EIID 組分(pts9D)、低聚糖特異性EIIBCA 組分(pts1BCA)和甘露糖特異性EIIAB組分(pts9AB)中存在較多的突變位點。 在植物乳桿菌中,PTS 系統可以將多種糖類轉運至細胞內,使得菌株可以高效利用不同碳源,進而產生大量代謝產物[26]。 根據菌株AN-55 的抑菌性能推測pts9D、pts1BCA、pts9AB 可能存在正向突變,使其具有較強的甘露糖和低聚糖的轉運能力,從而提高碳源利用率,增強有機酸等代謝產物的合成,進而達到高效抑菌的目的。此外,絲氨酸/蘇氨酸蛋白激酶(pkn1)、XRE 家族轉錄調控因子(lp_1483)、核黃素合成酶(ribB) 等的編碼基因可能發生正向或負向突變,影響菌株的生長代謝,從而間接影響了菌株的抑菌性能。
3 結 語
近年來,食品安全問題逐漸受到重視,越來越多的國內外學者致力于開發綠色、高效的天然抗菌物質。 乳酸菌因其天然的抑菌特性受到了廣泛關注,是新型綠色食品添加劑和天然防腐劑等產品研發領域中的重點研究對象。 本研究中以抑菌性能優良的植物乳桿菌DY6 為出發菌株, 通過ARTP 和NTG 復合誘變提升菌株的抑菌性能,根據抑菌率和抑菌活性對誘變菌株進行篩選,得到了到抑菌活性較強的菌株AN-55、AN-58 和AN-68, 遺傳穩定性實驗表明誘變菌株AN-55 的抑菌性能較為穩定,抑菌活性提高了20.51%。經全基因組重測序研究發現菌株AN-55 中plnK、cps4G、pts9D 等基因的突變可能是影響其抑菌性能的重要基因,為后續植物乳桿菌抑菌機理的研究及其在抗生素替代物中的應用奠定了基礎。

