枸杞多糖體外調節人體腸道菌群的功能研究
關天越, 任怡琳,2, 管祺杰, 史勁松, 許正宏, 耿 燕*
(1. 江南大學生命科學與健康工程學院 江蘇 無錫 214122; 2. 江南大學附屬醫院消化內科, 江蘇 無錫 214122;3. 江南大學生物工程學院,江蘇 無錫 214122 )
枸杞是茄科、枸杞屬植物,是我國傳統的藥食兩用植物,其中栽培范圍最廣的寧夏枸杞,主要分布在我國西北地區[1]。 枸杞果實是人們日常食用的主要部分[2-3]。 枸杞多糖(LBP)是從果實中提取的枸杞最主要活性成分,具有廣泛的藥理學作用,包括抗氧化、抗疲勞、抗衰老、抗腫瘤、保護肝臟、降血脂等功能[4-6]。 多糖作為一種大分子活性物質往往不能在胃與小腸處分解,需經腸道菌群的分解才能被人體利用[7]。 人體內腸道微生物能夠協助宿主完成大量的生理生化功能,被稱為人體的另一大器官[8],其數量約為人體細胞數量的10 倍。 因此,研究枸杞多糖對人體腸道菌群結構和功能的影響對探究枸杞多糖的藥理活性具有重要的價值。
1 材料與方法
1.1 試劑與主要儀器
枸杞粗多糖:百瑞源公司產品;AKTA 蛋白質純化系統、DEAE -Sepharose Fast Flow 10/16 柱、Sephadex G-75 葡聚糖凝膠柱: 美國GE 公司產品;UPLC 系統(LC-30A):日本島津公司產品。
1.2 枸杞多糖的制備
將購置的枸杞粗多糖溶于蒸餾水中,并不斷攪拌使多糖充分溶解, 使最終料液質量體積比為1 g∶5 mL,設置提取溫度為50 ℃,提取時間為120 min,過濾濃縮后加入乙醇,多糖溶液與乙醇溶液體積比為1∶4,并在4 ℃的條件下靜置過夜,溶液離心取沉淀干燥后得實驗用枸杞粗多糖[9-10],再應用Sevage法除蛋白質。使用氯仿、正丁醇試劑以4∶1 的體積比配制Sevage 溶液,Sevage 溶液與糖溶液以1∶1 的體積比混合,攪拌4 h 后,上層溶液為多糖溶液,中間層為蛋白質層,下層溶液為有機試劑,重復此操作3次至中間層無蛋白質析出[11]。 再對上層多糖溶液進行脫色處理,將大孔樹脂置于大燒杯中,使乙醇完全浸沒樹脂,并不斷攪拌,以除去氣泡,使之充分混合,靜置24 h;之后對樹脂進行水洗、酸洗、堿洗;大孔樹脂洗凈后,以大孔樹脂和多糖溶液1∶20 的體積比加入多糖溶液,攪拌1 h,抽濾回收濾液,濾液冷凍干燥后,進行下一步純化。
1.3 枸杞多糖的純化
使用AKTA 蛋白質純化系統對多糖進行純化處理[12-13]。 首先使用離子交換柱進行分離,分離柱選擇DEAE-Sepharose Fast Flow 10/16 柱, 超純水(A洗脫液)和1 mol/L NaCl 溶液(B 洗脫液)作為流動相進行梯度洗脫,自動收集器進行收集。 用苯酚-硫酸法測定溶液中多糖的質量濃度,繪制對應的洗脫曲線,并合并同一洗脫峰下的各管洗脫液,旋蒸濃縮并冷凍干燥,得到不同組分的洗脫樣品[14]。之后利用相對分子質量差異對已分離出的各組分再次進行分離純化, 純化柱選擇Sephadex G-75 葡聚糖凝膠柱, 使用0.1 mol/L NaCl 溶液作為流動相進行洗脫,使用自動收集器收集流出液。 用苯酚-硫酸法測定多糖的質量濃度,并繪制對應的洗脫曲線,合并同一洗脫峰下的各管洗脫液,旋蒸濃縮,透析48 h,每12 h 更換超純水,之后冷凍干燥得到純化后的枸杞多糖樣品。
1.4 體外模擬厭氧發酵
取6 名在3 個月內未接受抗生素治療的健康人(男女志愿者各3 人)糞便樣本,在PBS 溶液中離心重懸,制備成腸道菌群種子進行體外模擬厭氧發酵。 本實驗已通過江南大學醫學院倫理審核(JNU20210618IRB19)。 厭氧發酵培養基為8.0 g/L可溶性淀粉、4.5 g/L 酵母抽提物、3.0 g/L 胰蛋白胨、3.0 g/L 蛋白胨、0.4 g/L 膽鹽3 號、0.8 g/L L-半胱氨酸鹽、0.5 g/L 三氯化鐵紅霉素、4.5 g/L 氯化鈉、2.5 g/L 氯化鉀、0.45 g/L 六水合氯化鎂、0.2 g/L 六水合氯化鈣、0.4 g/L 磷酸二氫鉀、1.0 mL/L 吐溫80 和2.0 mL/L 微量元素溶液,調節pH 至6.5,121 ℃滅菌20 min。 在厭氧發酵瓶中靜置48 h 后進行接種,其中,多糖組枸杞多糖加入量為2 g/L。 空白對照的厭氧發酵瓶與加入枸杞多糖的厭氧發酵瓶分別為9個,接種的菌種種子分別為6 名志愿者提供的單獨樣本與6 名志愿者樣本經混合后的等微生物量的3個混合樣本。 其中,空白對照組為CTRL 組、混合種子空白對照組為CTRLMIX 組、 枸杞多糖組為LBP組、混合種子枸杞多糖組為LBPMIX 組。 CTRL 空白對照組與LBP 枸杞多糖組皆為6 名志愿者的樣本單獨放入厭氧發酵瓶進行發酵(n=6)。 CTRLMIX 混合種子空白對照組與LBPMIX 混合種子枸杞多糖組,皆為6 名志愿者的樣本經混合后等微生物量加入厭氧發酵瓶中發酵 (n=3)。 總空白對照組為TCTRL 組,總枸杞多糖組為TLBP 組(n=9)。
1.5 發酵液短鏈脂肪酸的測定
取接種后的腸道微生物體外模擬厭氧發酵液,于1 000 r/min 離心5 min, 吸取上清液并經0.22 μm 濾膜過濾后4 ℃保存。 參照文獻[15]通過UPLC系統測定發酵液中的短鏈脂肪酸濃度, 色譜柱為InertSustain AQ-C18(150 mm×2.1 mm,1.9 μm),流量0.5 mL/min,檢測波長210 nm,柱溫40 ℃,進樣量10 μL。 洗脫液A 液為20 mmol/L 的NaH2PO4溶液,B 液為乙腈。 UPLC 的洗脫程序為0 min 時A 液體積分數為95%, 在10 min 時A 液體積分數線性下降至60%,之后不變至12 min,分析程序結束。
1.6 16S rRNA 基因高通量測序與數據統計學分析
選擇菌群16S rRNA 基因的測序區域為V3~V4區。 取微生物基因組DNA 樣品與對應的融合引物配制PCR 反應體系,設置PCR 反應參數進行擴增,之后使用Agencourt AMPure XP 磁珠對擴增產物純化, 純化后完成cDNA 文庫的建立。 使用Agilent 2100 Bioanalyzer 對文庫的片段范圍及濃度進行檢測。檢測合格的文庫根據插入片段大小,使用HiSeq平臺測序。 應用DADA2 聚類方法, 通過去噪的序列,并以100%的相似度聚類生成ASV 序列。
兩組之間顯著性差異比較應用Wilcox Test 方法,3 組及以上比較用Kruskal Test 方法,當P<0.05時表示實驗具有統計學差異。 通過華大基因公司的微生物擴增子系統(http://meta.bgi.com) 分析處理16S rRNA 基因測序數據。 并應用GraphPad Prism 8.0 進行繪圖與統計學分析。 16S rRNA 基因測序數據匯交至國家微生物科學數據中心數據庫(https://nmdc.cn/)。 生物項目正式編號為NMDC10017931,生物樣本正式編號為NMDC20029604。
2 結果與分析
2.1 枸杞多糖對腸道微生物群落多樣性的影響
經AKTA 蛋白質純化系統純化得到了LBP(見圖1 和圖2)。 利用人體腸道菌群體外發酵體系及16S rRNA 基因擴增子測序, 研究LBP 對腸道微生物群落多樣性的影響。 首先利用Chao1 指數、ACE指數、Shannon 指數和Simpson 指數來判斷LBP 對腸道微生物的α-多樣性的影響。 如圖3 所示,LBP組和LBPMIX 組的Chao1 指數與ACE 指數均顯著上升(P<0.05),Shannon 指數也呈上升趨勢,Simpson指數則呈下降趨勢。以上結果表明LBP 能夠明顯提高腸道菌群的多樣性。
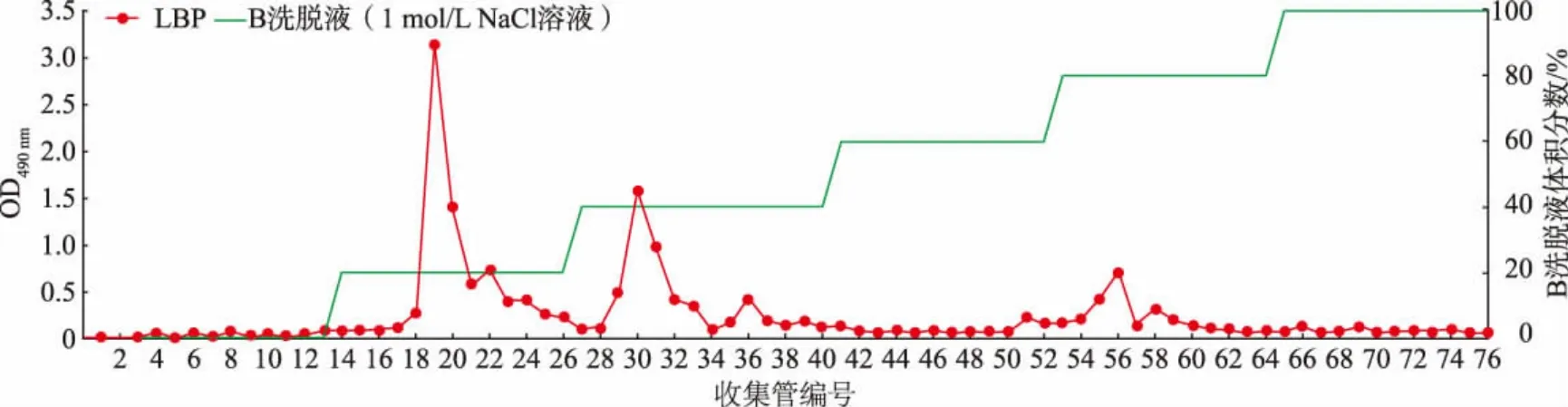
圖1 DEAE-Sepharose Fast Flow 離子交換柱色譜分離Fig. 1 Chromatographic separation of DEAE-Sepharose Fast Flow ion exchange column
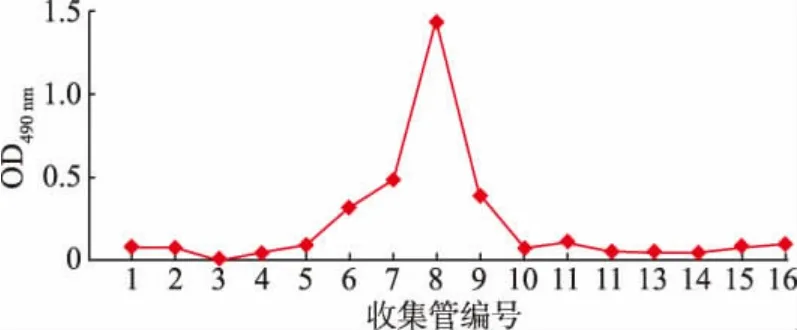
圖2 Sephadex G-75 葡聚糖凝膠柱色譜分離Fig. 2 Chromatographic separation of Sephadex G-75 sephadex column

圖3 體外發酵的人體腸道微生物菌群的α-多樣性Fig. 3 α-Diversity of human gut microbiota produced by in vitro fermentation
為了研究腸道微生物的β-多樣性的差異,基于ASV 進行主成分分析(PCA),結果如圖4 所示。枸杞多糖組與空白對照組分別位于PC1 的兩側,兩組的混合種子發酵樣本同樣在圖上分離明顯,并分別呈現聚集狀態。 其中CTRLMIX 組和LBPMIX 組組的樣本分別顯示了很好的聚集, 但未與CTRL 組和LBP 組明顯分開,說明將志愿者樣本的混合處理雖提高了菌群結構的穩定性但并沒有與單獨發酵的樣本有顯著差異,但是含LBP 的體外發酵顯著改變了腸道菌群的結構。
2.2 枸杞多糖對腸道微生物物種差異的影響
利用線性判別分析 (linear discriminant analysis effect size,LEfSe 分析),研究添加LBP 后與空白對照組相比具有差異性的腸道微生物。 如圖5所示,TLBP 組在屬水平上具有顯著性差異(LDA>2,P<0.05)的有乳酸桿菌屬(Lactobacillus)、雙歧桿菌屬(Bifidobacterium)、瘤胃球菌屬(Ruminococcus)、布勞特氏菌屬(Blautia)、多爾氏菌屬(Dorea)、毛螺菌屬 (Lachnospiracea_incertae_sedis)、 腸單胞菌屬(Intestinimonas)、羅氏菌屬(Roseburia)等。而豐度降低的有小桿菌屬 (Dialister) 、 氨基酸球菌屬(Acidaminococcus)與有害的腸道致病菌屬克雷伯氏菌屬(Klebsiella)等[16]。
2.3 枸杞多糖對腸道菌群功能差異的預測分析
通過京都基因與基因組百科全書(KEGG)通路功能預測含LBP 的體外發酵對腸道菌群功能差異的影響。 如圖6 所示,LBP 添加到腸道菌群體外發酵體系后,顯著影響了菌群與初級和次級膽汁酸代謝(primary and secondary bile acid biosynthesis)、蛋白質的消化吸收(protein digestion and absorption)、亞油酸代謝(linoleic acid metabolism) 和多糖代謝(other glycan degradation)等方面的功能(P<0.05)。

圖6 腸道菌群的功能差異分析Fig. 6 Functional difference analysis of gut microbiota
2.4 枸杞多糖對腸道微生物代謝物短鏈脂肪酸(SCFAs)生成的影響
SCFAs 對于腸道健康有著重要的作用[17],也是多糖在腸道內發酵的產物[18]。 通過超高效液相色譜系統對發酵液中的短鏈脂肪酸進行檢測,并將腸道內含量最豐富的SCFAs(如乙酸、丙酸與丁酸)的濃度進行比較。 TLBP 組的乙酸、丙酸與丁酸單獨組分濃度和總短鏈脂肪酸濃度與TCTRL 組相比都具有顯著性差別,結果如圖7 所示。
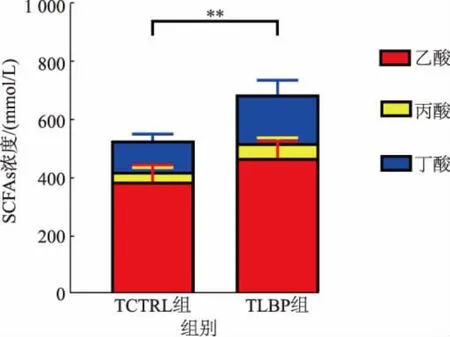
圖7 發酵液中的短鏈脂肪酸(SCFAs)濃度Fig. 7 Concertation of short-chain fatty acids (SCFAs) in the fermentation broth
2.5 討論
腸道微生物是位于腸道內部的龐大微生物群,腸道菌群的細胞數達100 萬億以上,種群至少存在1 000 種以上, 是人體擁有的最復雜的微生態系統[19]。而且它是一個對宿主健康至關重要生物反應器。 這些微生物在體內參與了宿主的營養代謝活動,并作為宿主代謝的重要參與者提供許多宿主所不能合成的代謝產物,調節機體的生化生理狀態[20]。腸道菌群的相對豐度與菌株豐富度與人的健康息息相關,膳食調節被認為是改變微生物菌群結構的重要方式[21]。許多中草藥對腸道菌群有顯著促進作用,其對腸道菌群的調節能力可能是其藥理作用的來源[22]。多糖作為一種活性物質具有改善腸道功能,枸杞多糖有可能以改變腸道微生物結構的方式發揮其藥理功能[23]。
通過對模擬人類腸道微生物體外厭氧發酵體系進行測序分析來研究枸杞多糖對腸道微生物的作用。 菌群多樣性數據顯示了在發酵培養基中加入枸杞多糖后,菌群結構發生了明顯變化,枸杞多糖提高了腸道菌群的豐度與多樣性,并且混合種子樣本的菌群豐度高于單一樣本的菌群豐度。 從主成分分析可知,對菌群種子樣本的混合可以提高發酵后腸道微生物的豐度與促進菌群結構的穩定。 并且枸杞多糖作為一種大分子活性物質可以有效影響人類的腸道微生物結構。 從兩組的功能差異可以看出,腸道微生物的改變使一系列代謝相關的功能上調,改善了腸道的消化能力。
多糖代謝往往由多種微生物共同作用[24]。 根據LDA 值,在具有顯著性的差異物種中,總枸杞多糖組的乳酸桿菌屬和雙歧桿菌屬是著名的益生菌菌屬,還有瘤胃球菌屬、布勞特氏菌屬、多爾氏菌屬、毛螺菌屬和羅氏菌屬與多糖代謝、SCFAs 生成有關,這些菌在屬水平上豐度的升高對腸道起到了調節作用。 乳酸桿菌是一種能夠發酵產生大量乳酸的益生菌, 通過拮抗有害微生物來維持腸道菌群平衡,并且是一種能夠產生SCFAs 的益生菌[25-26]。雙歧桿菌同樣是能夠產生有機酸的益生菌,促進人體對一系列營養物質的吸收,并具有抗菌、抗癌、抗衰老、保護肝臟等功能[27]。這些益生菌影響人體的消化與健康[28-29]。 多糖在腸道代謝的終產物為SCFAs,其可以調節腸道生理功能,如維持腸道系統的正常功能和結腸上皮細胞的形態和功能、發揮抗炎作用并調節免疫系統、作為能量來源并改變菌群組成[30-31]。TLBP 組的SCFAs 顯著性增加, 表明LBP 可能通過提高腸道SCFAs 的濃度發揮其藥理作用[18,32]。 除產生SCFAs 外,枸杞多糖對腸道微生物結構及其功能的影響仍有待進一步研究。
3 結 語
綜上所述,枸杞多糖能夠提高人類腸道微生物的多樣性,提高益生菌的豐度,降低腸道內致病菌的豐度, 并促進碳水化合物代謝菌產生短鏈脂肪酸,最終調節機體的健康。

