咖啡酸苯乙酯對大鼠早期腹主動脈瘤形成的抑制作用*
占 鉆,劉 勇,劉 堅,黃 亮,曹春水
(南昌大學第一附屬醫院急診科,南昌 330006)
腹主動脈瘤(abdominal aortic aneurysm,AAA)是一種常見的動脈退行性疾病,破裂后死亡率較高,破裂風險與瘤體直徑呈正比,對于大AAA(直徑>5.5 cm)的主要治療方法包括開放手術和介入腔內覆膜支架植入術;而對于小AAA(直徑<5.5 cm)手術并不能帶來獲益[1],治療目標是避免其不斷進展甚至破裂,臨床上仍沒有合適的治療策略[2],多以觀察隨訪為主。因此,尋找控制和延緩小AAA不斷增大的治療策略對于降低AAA的破裂發生率和死亡率具有重要意義。課題組既往研究發現,咖啡酸苯乙酯(caffeic acid phenethyl ester,CAPE)對小AAA可能具有保護作用[3],但具體機制有待深入研究。本研究擬通過建立大鼠AAA模型,進一步觀察CAPE的干預作用,并從炎性反應角度探討可能的作用機制。
1 材料與方法
1.1 實驗動物
健康SPF級雄性SD大鼠18只,8周齡,購自湖南斯萊克景達實驗動物有限公司,適應性喂養1周后隨機分為假手術組、模型組及CAPE干預組,每組6只。
1.2 主要試劑
兔基質金屬蛋白酶(MMP)-2多克隆抗體、兔MMP-9多克隆抗體、小鼠環氧合酶-2(COX-2)多克隆抗體購自美國Affinity公司,兔前列腺素E2(PGE2)多克隆抗體購自北京博奧森生物技術有限公司,辣根酶標記山羊抗兔IgG、辣根酶標記山羊抗鼠IgG購自中杉金橋生物技術有限公司。
1.3 方法
1.3.1模型制作及干預
大鼠AAA模型制作參考文獻[4]。術前大鼠禁食12 h,腹腔注射10%水合氯醛麻醉,充分暴露腹主動脈向上、向下分別達左腎靜脈和左側髂總動脈水平,于左腎動脈開口下方安放無損傷微動脈夾阻斷腹主動脈,左側髂總動脈前壁穿刺置管,結扎左側髂總動脈遠端及右側髂總動脈。留置管內緩慢推入肝素生理鹽水驗證腹主動脈是否完全封閉。模型組及CAPE干預組大鼠腹主動脈腔內注入(豬胰)彈性蛋白酶(250 U/mL),加壓灌注60 min,松開遠端阻斷的動脈夾,檢查有無回血漏血。確定主動脈無出血后逐層縫合。術后大鼠單籠飼養,CAPE干預組腹腔注射CAPE 10 μmol·kg-1·d-1,每日1次,持續14 d,模型組和假手術組在相同時間內注射等劑量生理鹽水。所有大鼠在彈性蛋白酶灌注前、灌注后即刻及灌注后14 d使用游標卡尺測量腹主動脈和AAA直徑。使用游標卡尺測量擴張段最大直徑超過正常腹主動脈直徑的一半作為AAA造模成功的標準。
1.3.2病理學研究
處死大鼠后,取腹主動脈及AAA組織置于10%中性甲醛溶液中固定,脫水、透明、包埋、石蠟切片,行蘇木素-伊紅染色法(HE)染色、Van Gieson(VG)染色,觀察病理學改變情況。免疫組織化學檢測血管壁組織COX-2、PGE2、MMP-2及MMP-9水平。
1.4 統計學處理
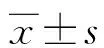
2 結 果
2.1 CAPE對大鼠AAA直徑的影響
所有大鼠均存活,造模成功。3組大鼠灌注前腹主動脈直徑無明顯差異(P>0.05)。模型組及CAPE干預組大鼠灌注后即刻AAA直徑比較無差異[(2.38±0.18)mmvs.(2.49±0.05)mm,P>0.05],但均較假手術組腹主動脈直徑(1.44±0.08)mm明顯增大,差異有統計學意義(P<0.05)。灌注后14 d模型組、CAPE干預組大鼠AAA直徑較假手術組腹主動脈直徑增大[(3.32±1.23)mm、(2.42±0.14) mmvs.(1.47±0.08) mm,P<0.05)],CAPE干預組較模型組減小(P<0.05),見圖1。
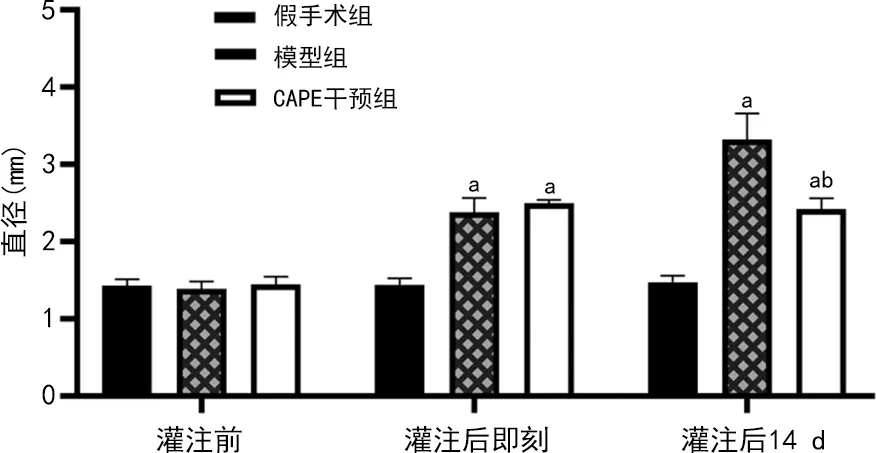
a:P<0.05,與假手術組比較;b:P<0.05,與模型組比較。圖1 大鼠腹主動脈與AAA直徑比較
2.2 CAPE對大鼠AAA形成早期血管壁病理結構的影響
HE染色顯示,模型組中動脈血管壁發生退行性病變,中膜部分組織結構紊亂,血管壁炎癥浸潤明顯。而在CAPE干預組瘤樣擴張不明顯,組織結構較模型組趨于完整,有炎癥浸潤,但較模型組明顯減少。VG染色顯示,與假手術組比較,模型組血管壁中膜肌纖維明顯減少,膠原纖維紊亂不連續,降解明顯,外膜增厚;與模型組比較,CAPE干預組血管壁中膜肌纖維增加,膠原纖維斷裂及降解情況好轉,見圖2。
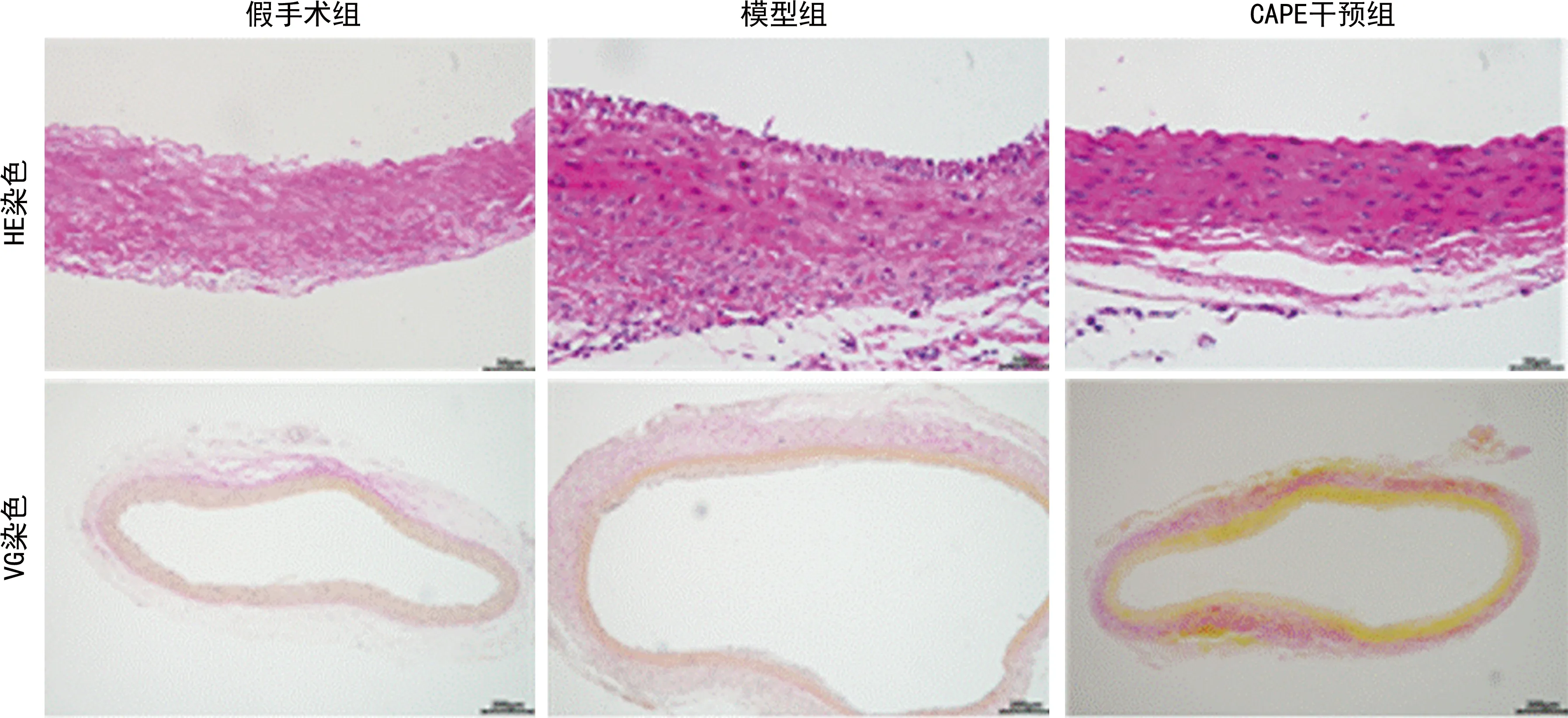
圖2 大鼠腹主動脈及AAA血管壁組織HE染色(400×)和VG染色(100×)對比
2.3 CAPE對大鼠AAA形成早期血管壁組織COX-2、PGE2、MMP-2及MMP-9水平的影響
與假手術組腹主動脈血管壁組織比較,模型組及CAPE干預組AAA血管壁組織COX-2、PGE2、MMP-2及MMP-9水平明顯升高(P<0.05)。與模型組比較,CAPE干預組AAA血管壁組織COX-2、PGE2、MMP-2及MMP-9水平明顯降低(P<0.05),見圖3、表1。
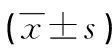
表1 各組大鼠血管壁組織COX-2、PGE2、MMP-2和MMP-9水平比較
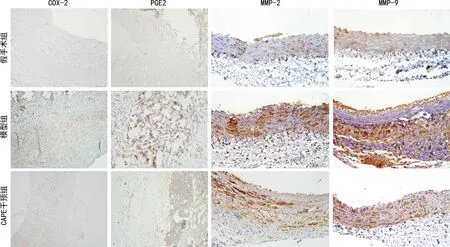
圖3 免疫組織化學檢測各組大鼠血管壁組織COX-2、PGE2、MMP-2及MMP-9水平(400×)
3 討 論
AAA的主要病理學改變包括炎性反應、血管平滑肌細胞(VSMC)減少及細胞外基質的降解和重塑[5]。其中,炎性反應在AAA發生和發展中的作用尤為重要,貫穿了從形成至破裂的全過程。研究發現,在AAA血管壁存在大量的炎癥細胞浸潤[6],巨噬細胞是血管瘤炎性反應的主要效應細胞[7],其高表達于動脈內膜和中膜。有研究發現,抑制進入主動脈壁的免疫及炎性反應可能影響AAA的進展[8-9]。
CAPE是蜂膠中提取出的一種生物活性成分,被廣泛應用于燒傷、腫瘤、心血管疾病、糖尿病、局部創傷和皮膚等的治療,已被證明其具有抗炎癥、抗氧化應激、免疫調節和抗腫瘤等多重的生物活性且無毒副作用[10-13]。本實驗研究發現,CAPE可抑制AAA不斷增大,CAPE治療后AAA血管壁炎癥細胞浸潤減少,組織破壞減輕,提示CAPE對大鼠早期AAA形成的抑制作用與抑制炎性反應有關。
PGE2是與炎性反應密切相關的一種前列腺素類化合物,具有促炎作用,其生物合成主要受磷脂酶A(phopholipase A,PLA)、COX-2及前列腺素E2合酶(mPGES-1)的調控。AAA作為一種慢性炎癥性疾病,PGE2同樣在其發病過程中起著重要作用[14]。研究表明,PGE2介導的炎性反應失調可導致AAA,人AAA組織COX-2和PGE2呈高表達,通過服用非甾體類抗炎藥物抑制PGE2的合成能明顯減慢AAA的增大速度[15]。通過COX-2/PGE2信號通路的抑制或基因敲除干擾PGE2的合成亦可抑制AAA的進展[16]。
MMPs與AAA的形成及破裂密切相關[17],其中MMP-9及MMP-2在AAA組織中表達水平明顯升高[18],其活性增強可以加速血管壁彈性蛋白降解,降低主動脈壁穩定性,進而導致動脈壁瘤樣擴張[19]。研究顯示,PGE2能夠刺激巨噬細胞分泌MMP-2和MMP-9,從而增加動脈粥樣斑塊的不穩定性,而通過降低COX-2、mPGES-1水平減少PGE2的產生,則能增加其穩定性[20]。PGE2在AAA中調控MMPs的具體機制仍不明確,MAMUN等[21]研究發現通過抑制PGE2的受體EP4通路可降低MMP-2及MMP-9水平,從而抑制動脈瘤進展。
本研究免疫組織化學檢測顯示,CAPE干預后可有效抑制大鼠AAA血管壁組織COX-2、PGE2、MMP-9及MMP-2水平的升高,提示CAPE對早期AAA的保護作用機制可能與抑制上述指標相關,但具體機制仍需進一步通過基因干擾等體內外研究驗證。

