含硒雜環的電化學合成、分析及表征綜合實驗設計
張震,王世龍,劉珊珊,李文佐,何濤,李家柱
煙臺大學化學化工學院,山東 煙臺 264005
電化學合成技術是一種綠色的化學合成手段,其通過調節電流或電極電勢控制電子轉移,實現化合物的氧化和還原。該過程使用可持續的電流作為“氧化劑”,避免了一些有毒或有害的化學氧化劑的使用,具有綠色、經濟、可持續的優勢,該技術的快速發展為合成結構多樣且復雜的有機分子提供了新的發展機遇[1]。目前在本科實踐教學環節,雖然許多高校開設了電化學實驗[2-5],但將其作為合成手段應用于化合物制備的案例仍然缺乏[6]。將電化學合成引入到實踐教學,可以使學生打破傳統化學試劑氧化的反應思路,直觀感受電化學合成的魅力,對于提升學生的綠色化學意識,具有重要指導意義[7]。
含硒雜環是一類重要的有機化合物,廣泛存在于醫藥、農藥及有機材料分子中,例如部分含硒雜環結構可以作為抗菌、抗病毒、抗癌的藥物,在生物及醫學領域具有重要的應用價值[8]。因此,探索快速高效的含硒雜環合成方法具有重要的研究意義。目前,化學合成工作者已開發了多種合成方法,其中電化學合成策略因具有綠色、經濟、可持續的優勢,擁有更廣闊的應用前景。近年來,該研究領域發展迅速并取得豐碩的研究成果[9]。基于“科研反哺教學”的育人理念,將這些前沿研究成果轉化為大學實踐教學內容,不僅可以讓學生了解前沿研究進展,拓展知識范圍,還為培養新時代化學合成領域的應用型人才提供實踐支撐[10,11]。
筆者結合團隊的研究方向,將最新的科研成果轉化為一個電化學合成含硒雜環的創新型綜合實驗[12],并對反應過程進行電化學分析,對產物進行結構表征。據筆者了解,目前本科的化學綜合實驗主要以多個單一學科的基礎實驗累積為主,缺少在一個實驗中運用多學科知識,系統開展實驗技能訓練的實踐案例,這對學生的創新和實踐能力培養極為不利[13,14]。本實驗融合多學科知識,涉及有機合成化學、電化學、分析化學等,可以很好地提升學生多學科知識的運用能力。此外,本實驗注重化學實驗的系統性,通過底物的制備→電化學合成與分析→化合物的波譜表征→晶體的培養解析等環節,使學生了解前沿的有機硒化學合成過程,并對化學合成操作、過程分析和結構解析等技能進行系統性訓練,從而更好地培養學生的化學綜合能力。
1 實驗目的
(1) 學習電化學合成的基本原理與實驗操作,了解自由基關環反應過程;
(2) 學習有機硒化合物的熔點測定、核磁和高分辨質譜檢測等表征分析方法;
(3) 學習單晶培養的基本知識和實驗操作,了解單晶解析的理論知識;
(4) 掌握胺的烴化反應原理和實驗操作,掌握柱層析的基本操作;
(5) 了解電化學合成策略作為綠色合成技術的優勢及應用前景,提升綠色化學意識。
2 實驗原理
有機硒雜環化合物是一類重要的化學分子,在藥物、農用化學品、有機材料以及催化等領域有著廣泛的應用。目前已報道的研究多集中在構建五元或六元環的含硒雜環結構[15]。本實驗中,采用綠色的電化學手段,創新性地構建有機硒七元環結構。具體思路如下:以二烯和苯硒醚為底物,通電后在室溫條件下完成有機硒七元雜環的快速合成(圖1),該反應避免了傳統化學氧化劑的使用,反應條件更加綠色、溫和。反應調控方便,通過調節電流、電壓可改變氧化能力和反應程度,可操作性強,便于教學實施。
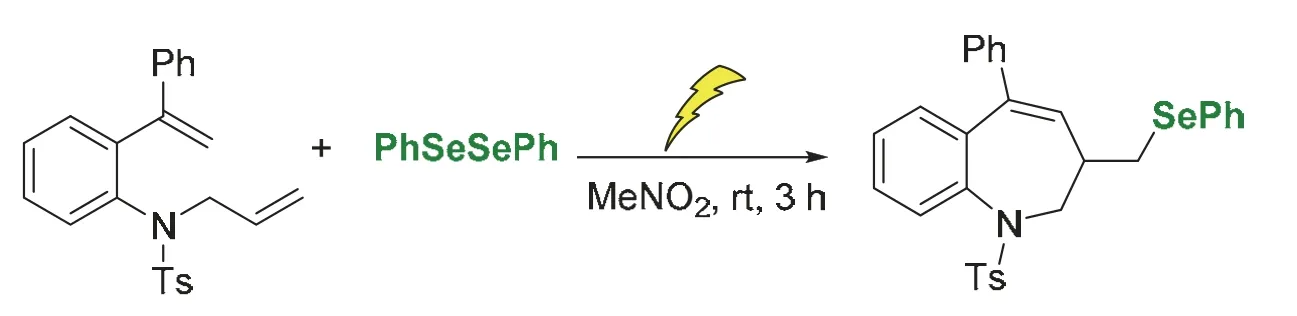
圖1 電化學合成有機硒七元雜環
具體反應機理如下:
在陽極上,二苯基二硒醚被氧化失去電子生成苯硒正離子,苯硒正離子與二烯底物中位阻較小的雙鍵反應,生成硒鎓離子。硒鎓離子中間體受到分子內另一雙鍵上電子的進攻,形成七元環芐基碳正離子,該中間體在陰極得電子,發生電解氫的過程,生成氫氣和七元有機硒化合物,完成電化學循環(圖2)。
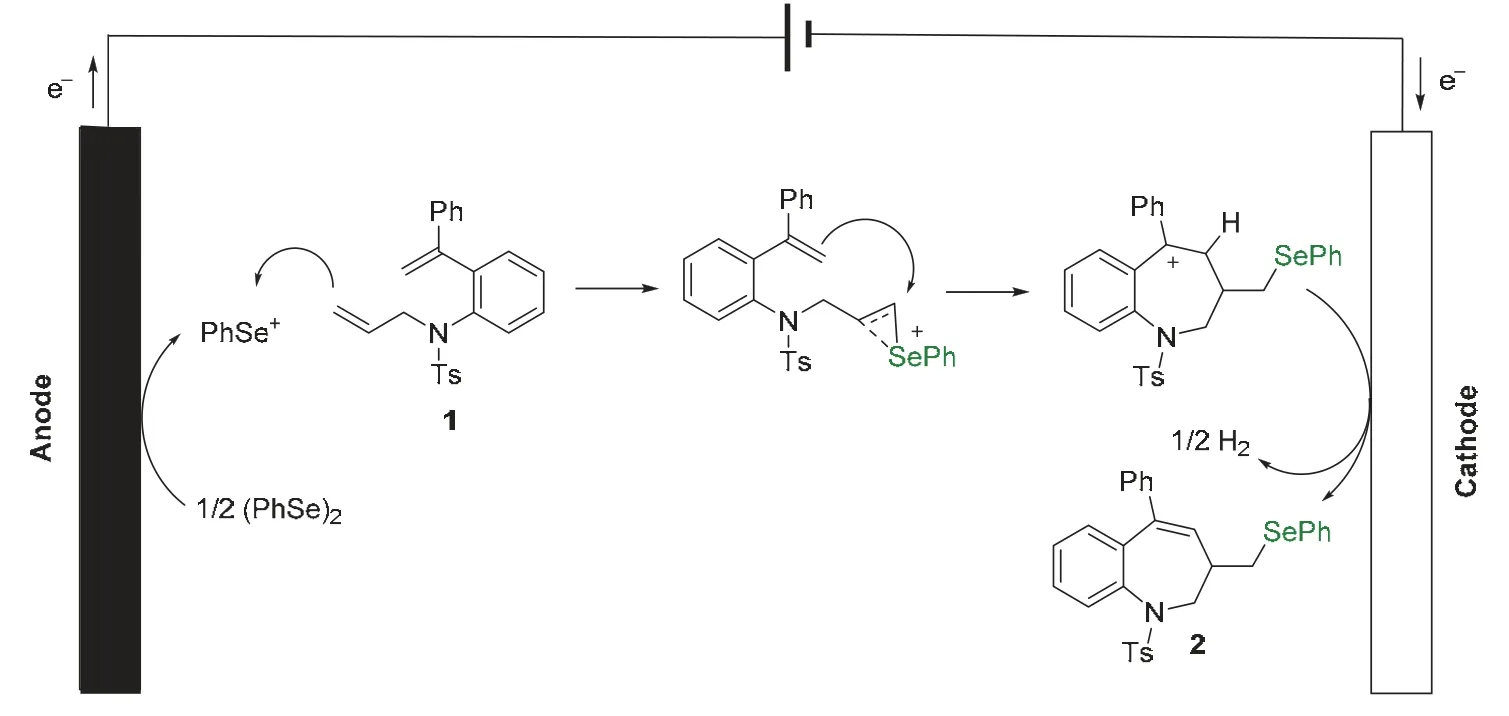
圖2 推測的電化學反應機理
3 儀器試劑
3.1 儀器
碳棒電極(120 mm)、鉑片電極(15 mm × 15 mm × 0.2 mm)、20 mL Y型管、圓底燒瓶等常用玻璃儀器、GF254薄層色譜硅膠板、電子分析天平、HSPY-1000-002直流穩壓電源、X-6數顯熔點測定儀、磁力攪拌器、旋轉蒸發儀、SHZ-D (III)循環水式真空泵、手提式紫外燈、核磁共振儀(德國Bruker 500Mz)、電化學工作站(上海辰華儀器有限公司,CHI660D)、X射線單晶衍射儀(德國Bruker D8 QUEST ECO)、高分辨質譜儀(美國Waters Xevo G2-XS)。
3.2 試劑
2-(1-苯基乙烯基)-對甲苯磺酰基苯胺(S1)、3-溴丙烯、碳酸鉀、乙腈、硝基甲烷、石油醚、乙酸乙酯、二氯甲烷、四丁基六氟磷酸銨、吡啶、二苯基二硒醚、無水硫酸鈉,上述試劑均購自安徽澤升科技有限公司,分析純。200-300目柱層析硅膠購自煙臺康匯生物科技有限公司。
4 實驗步驟
4.1 二烯底物的制備
取100 mL圓底燒瓶,分別加入中間體S1 (3 mmol,1.05 g)、碳酸鉀(3.6 mmol,495 mg)、乙腈(30 mL)和3-溴丙烯(6 mmol,720 mg)。將反應體系在油浴80 °C攪拌2 h。反應完成后,將反應體系過濾,收集濾液,真空濃縮。將殘余物通過硅膠柱色譜法純化(洗脫液為V石油醚:VEtOAc= 20 : 1-10 : 1),得到白色固體產物1 (1.06 g,收率91%,見圖3)。
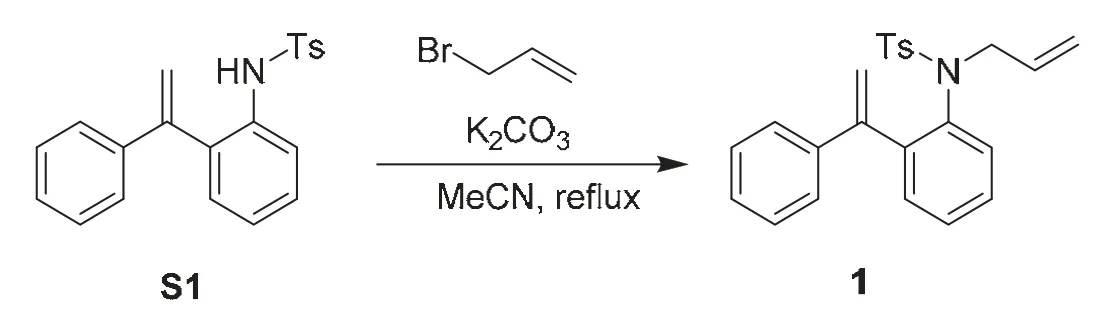
圖3 二烯底物的合成路線
4.2 電極的選用與處理
在電極選用時,主要考慮以下幾個因素:1) 所選電極不能與電解液或溶劑發生反應;2) 所研究的電化學反應不會因電極自身發生的反應而受到影響;3) 電極表面要光滑、均一,面積可根據反應的摩爾量適當改變,對于金屬片電極,反應時最好將溶劑浸沒電極。常用的“惰性”固態電極包括非金屬電極(碳棒、石墨電極、碳玻璃電極等)和金屬電極(鉑、金、銀電極等),本實驗中選用的是碳棒作為正極和鉑片電極作為負極,為保證實驗的可重復性,電極在使用前需要進行預處理,鉑片電極金屬表面需要用拋光粉(Al2O3)打磨,然后用去離子水沖洗表面并放入超聲水浴中清洗3-5 min,若清洗不徹底,可重復上述操作。
4.3 電化學合成有機硒七元雜環
反應方程式如圖4所示,將二烯底物1 (0.5 mmol,195 mg)、二苯基二硒醚(0.35 mmol,110 mg)與四丁基四氟磷酸銨(0.5 mmol,164 mg)加入Y型試管中,用5 mL硝基甲烷溶解,支口上塞上橡膠塞,插入氮氣球,上口插入碳電極和鉑電極,反應裝置如圖5所示(一臺電源可以平行串聯5組實驗),設定電流I= 5 mA,室溫下通電3-5 h。采用薄層層析法(TLC)跟蹤反應進程(圖6),反應完全后,真空濃縮溶劑,將殘余物通過硅膠柱色譜法純化(洗脫液為V石油醚:VEtOAc= 10 : 1),得到白色固體產物2(209 mg,收率76%)。
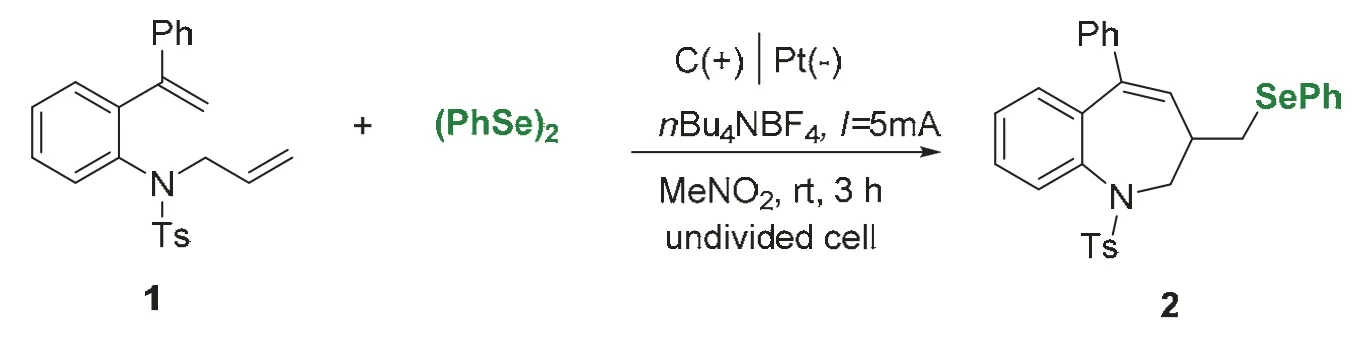
圖4 電化學合成條件和方程式

圖5 電化學反應裝置
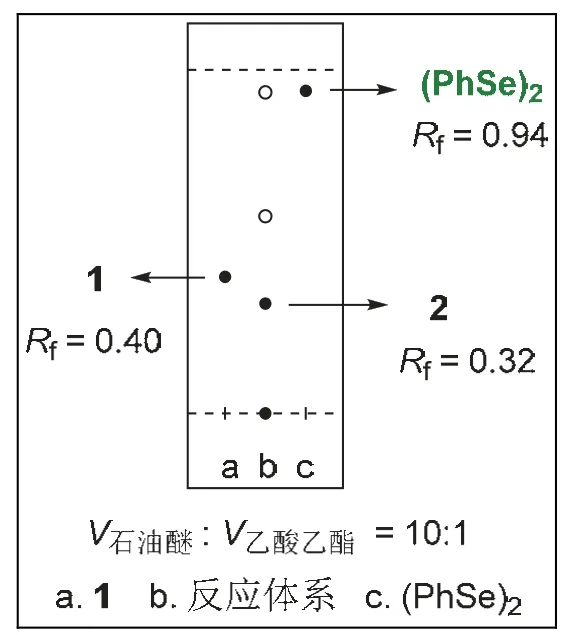
圖6 TLC監測反應進程
5 結果與討論
5.1 含硒七元環產物的結構表征
5.1.1 熔點測定
學生將自己小組分離的產物進行熔點測定,并與文獻報道的數據進行比較,檢驗產品的純度,對測定值進行記錄和分析。
5.1.2 核磁表征
制備的含硒七元環化合物將分別進行1H NMR、13C NMR和77Se NMR核磁表征,數據分析如下:
1H NMR數據分析:如圖7所示,1H NMR (500 MHz, CDCl3)δ7.53 (d,J= 7.8 Hz, 1H),7.50-7.39(m, 4H),7.28 (t,J= 7.6 Hz, 1H),7.26-7.18 (m, 5H),7.15 (t,J= 7.4 Hz, 2H),6.91 (d,J= 7.8 Hz, 3H),6.82 (d,J= 7.3 Hz, 2H),5.98 (s, 1H),4.33 (s, 1H),4.05 (s, 1H),2.97 (qd,J= 12.1, 6.6 Hz, 2H),2.71(s, 1H),2.18 (s, 3H)。其中2.18 (s, 3H)為對甲苯磺酰基中甲基的特征位移,2.71 (s, 1H)為叔碳氫的特征位移。2.97 (qd,J= 12.1, 6.6 Hz, 2H)為與氮原子相連亞甲基的特征位移。4.33 (s, 1H)和4.05 (s, 1H)為硒原子相連亞甲基的特征位移;5.98 (s, 1H)為雙鍵氫的特征位移;其余為苯環氫的位移。
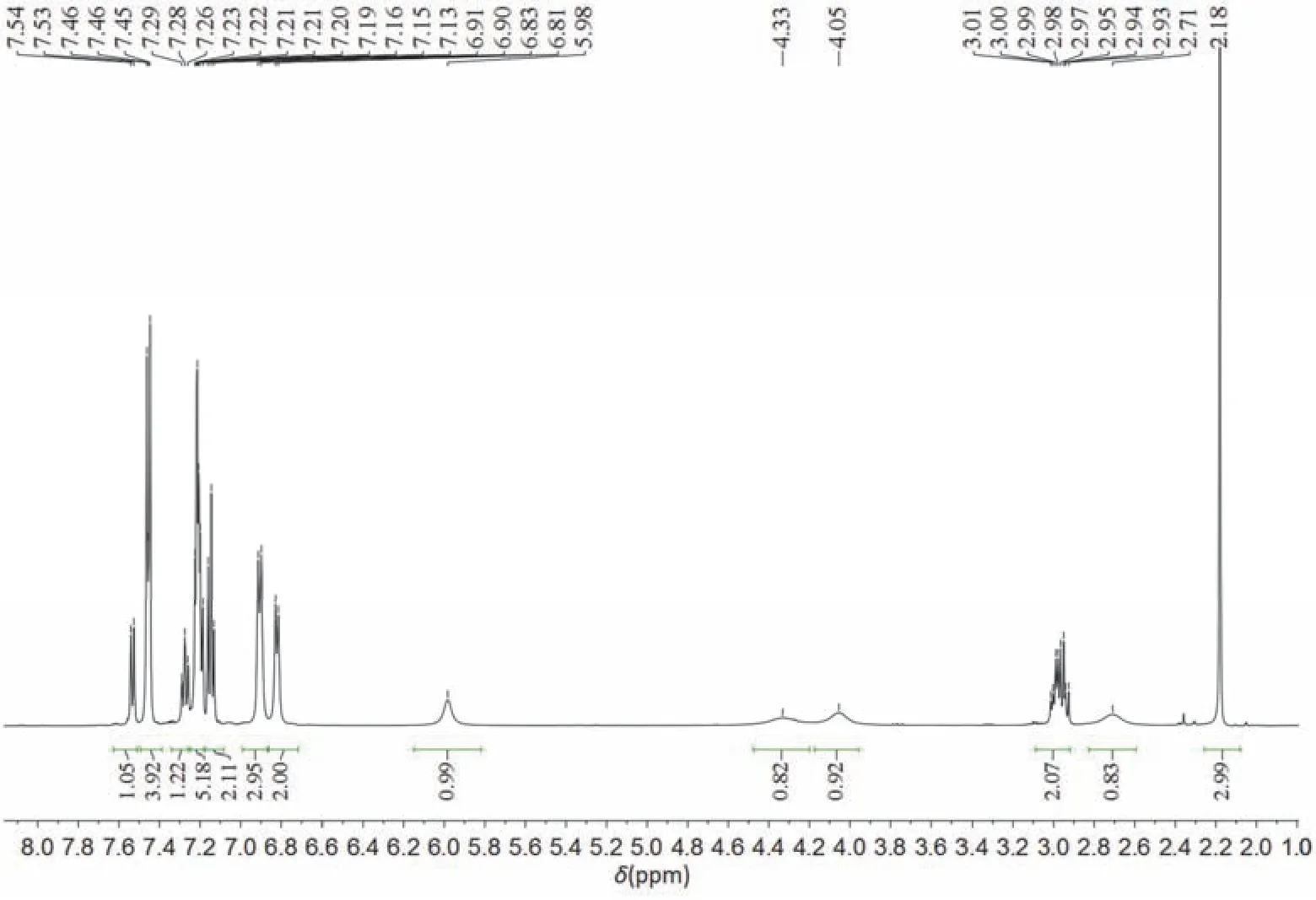
圖7 含硒七元環的核磁共振氫譜圖
13C NMR數據分析:如圖8所示,13C NMR (126 MHz, CDCl3)δ142.9,141.8,139.7,137.7,133.3,131.2,130.5,129.8,129.3,129.2,128.4,128.1,127.9,127.8,127.4,63.3,38.4,29.9,21.4。其中21.4和29.9分別為對甲苯磺酰基中甲基碳和叔碳的特征位移,38.4和63.3為氮原子和硒原子相連碳的特征位移。127.4-142.9為苯環和雙鍵碳的特征位移,由于原子之間的疊加和屏蔽效應導致出峰數量減少,峰強度低,學生可以結合波譜知識和具體結構分析。
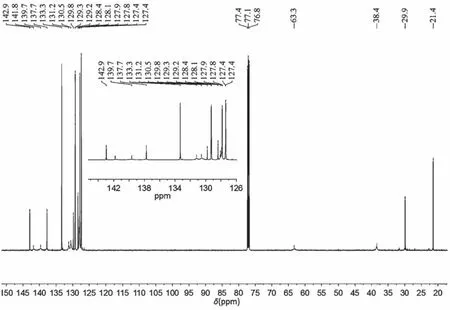
圖8 含硒七元環的核磁共振碳譜圖
77Se NMR數據分析:考慮到硒原子有77Se同位素,還將進行77Se NMR核磁表征。如圖9所示,77Se NMR數據如下:77Se NMR (76 MHz, CDCl3)δ280.1。

圖9 含硒七元環的核磁共振硒譜圖
5.1.3 高分辨質譜表征
含硒七元環化合物2的高分辨質譜圖譜如圖10所示,HRMS (ESI)m/z:[M + H]+理論計算值為546.1001;實際測定值為546.1003,在誤差允許范圍內。硒原子有多個同位素峰79Se、77Se、75Se,在質譜圖上可以清晰地看到544.1008,542.0958的特征峰,進一步表明合成的目標化合物中含有硒原子。

圖10 含硒七元環的高分辨質譜圖
5.2 電化學分析
循環伏安法采用三電極電池(燒杯型電池)在室溫下進行。工作電極是穩定的玻璃碳電極,對電極是鉑絲電極。參比電極是浸沒在飽和KCl水溶液中的Ag/AgCl電極,并通過鹽橋與反應分離。實驗中,將5 mL含有0.05 mol·L-1nBu4NPF6的MeNO2加入電池中。在0.02 mol·L-1濃度下進行二烯底物1、PhSeSePh、二烯底物1和PhSeSePh混合的循環伏安測定。掃描速率為0.1 V·s-1,范圍為-2.0 - 2.0 V。
如圖11所示,通過與空白對照,二烯底物1在2.0 V (vs. Ag/AgCl)范圍內并未出現氧化峰,而PhSeSePh分別在0.085 V (vs. Ag/AgCl)和0.705 V (vs. Ag/AgCl)出現兩個氧化峰,這表明二苯基二硒化物經歷了兩次氧化,并在陽極相對于二烯底物優先被氧化。因此,可以得出結論由于兩底物氧化電位的差異保證了電化學轉化順利進行。

圖11 循環伏安
5.3 硒化七元環產物的單晶培養和X射線單晶衍射
取三支15 mL試管,清洗干凈后,分別加入20 mg產物,并依次用二氯甲烷(8 mL)、乙酸乙酯(8 mL)、丙酮(8 mL)進行溶解,如圖12a所示,試管用紙巾密封,橡皮筋纏繞,在紙巾上扎幾個小孔,放置于通風櫥,靜置3-5天,待溶劑緩慢揮發后,觀察單晶析出情況。通過三種溶劑的對比,可以看到溶劑類型和揮發速度會影響單晶的析出效果。實驗結果表明,當丙酮做溶劑時,單晶析出效果較好,管壁可以清晰看到均勻的片狀晶體(圖12c),推測主要原因是丙酮的沸點介于二者之間,揮發速度適中,利于該晶體的析出。將析出較好的單晶進行X射線衍射,數據解析后,可以觀察到分子中七元環結構,硒原子與環的連接方式及各原子的空間分布。

圖12 單晶的培養和解析
6 教學實施及效果
本實驗主要針對擁有一定知識儲備的高年級學生開設。實驗總學時設置為16學時,分兩次完成,一般3-5名學生為一組。前10個學時主要進行底物和含硒雜環的制備,單晶的培養;后6個學時進行表征和分析實驗,其中核磁、質譜表征及電化學分析實驗,各小組可以穿插交替進行。分析表征實驗結束后,要求學生及時跟蹤反饋的實驗數據,所有數據由各小組成員自行處理和分析,形成實驗報告。通過該實驗,學生不僅可以訓練常規有機合成操作,鞏固胺類化合物烴化反應、氧化環化反應、波譜解析等理論知識,還可以學習電化學相關知識和實驗操作等內容。在單晶培養實驗中,除學習晶體學知識外,由于單晶培養充滿了不確定性,學生期待性強,有助于提升實驗學習的積極性。
為了使學生更深入地學習和思考該實驗,可以設置以下思考題供學生預習和討論:
(1) 部分同學分離出來的產物,其熔點測定值會比文獻報道的數據偏低或偏高,試分析造成該現象的原因有哪些?
(2) 結合波譜分析知識,試解釋產物在13C NMR表征時,為什么芳環區峰數目較少且信號較弱?
(3) 電化學合成中能否采用恒定電壓的方法進行?會對反應產生哪些影響?
(4) 在單晶培養過程中,為什么二氯甲烷和乙酸乙酯做溶劑單晶析出效果較差?溶劑的類型和揮發速度對晶體的生長有哪些影響?
7 結語
該實驗基于“科研反哺教學”的育人理念,將最新的科研成果轉化為可用于實踐教學的綜合化學實驗。通過底物的制備→電化學合成與分析→化合物的波譜表征→晶體的培養解析等環節,對學生的合成操作、過程分析和結構解析等技能進行系統訓練,為學生進行化學科學研究奠定良好的基礎。實驗內容打破傳統外加化學氧化劑的反應思路,采用更加綠色環保的電化學合成策略,一方面學生可以學習電化學知識,訓練電化學實驗操作,另一方面有助于提升學生的綠色化學意識,激發實驗學習興趣。實驗中還引入了硒元素,合成的含硒雜環分子具有潛在的生物活性,可以促使學生更深入地了解“長壽元素”硒。總之,該實驗具有較好的前沿性和綜合性,適用于高年級本科生的實踐教學。

