芳香化酶抑制劑對眼表微環境影響的分析
徐 鵬,趙媛媛,袁 琛,劉 超
目的:分析芳香化酶抑制劑(AIs)對服用者眼表微環境的影響。
方法:橫斷面觀察性研究。研究對象為2022-11/2023-05我院乳腺科就診的接受AIs治療的藥物絕經后的女性,根據AIs的種類分為甾體組和非甾體組。對照組為年齡相匹配的職業健康體檢女性。所有參與者都進行了眼表疾病指數(OSDI)問卷評分,詳細的眼科檢查包括:最佳矯正視力、眼壓、眼軸、角膜曲率、淚河彎曲面的曲率半徑、淚液滲透壓、淚膜破裂時間、角膜熒光素鈉染色評分、淚液分泌試驗(SchirmerⅠ試驗)、瞼板腺紅外線評分。
結果:對照組與甾體組、非甾體組的年齡、最佳矯正視力、眼壓、眼軸、角膜曲率比較均無差異(P>0.05);甾體組和非甾體組的藥物服藥時長比較無差異(P>0.05)。對照組與甾體組、非甾體組的OSDI評分、淚河彎曲面的曲率半徑、淚液滲透壓、淚膜破裂時間、角膜熒光素鈉染色評分、SchirmerⅠ試驗、瞼板腺紅外線評分比較均有差異(P<0.05);甾體組和非甾體組SchirmerⅠ試驗結果比較有差異(P<0.05),其余數據之間均無差異(P>0.05)。
結論:接受AIs治療的藥物絕經后女性患者,眼表微環境改變明顯,干眼的發生既有淚液分泌不足,也存在淚液蒸發過強。特別是接受非甾體類AIs者主淚腺分泌減少更明顯。
?KEYWORDS:dry eye; aromatase inhibitor; breast cancer; ocular surface microenvironment
0 引言
芳香化酶抑制劑(aromatase inhibitors,AIs)是絕經后女性激素受體陽性乳腺癌的標準治療方案[1]。乳腺癌是女性中最常見的腫瘤之一,2022年報告了220萬例新發患者,激素受體陽性乳腺癌是世界上最常見的乳腺癌亞型,約占所有診斷的75%[2-3]。年輕女性通過藥物維持絕經狀態,AIs將體內雌、孕激素維持在極低水平,治療時間一般為5~10a,作為目前發病率最高的腫瘤,可以預測未來會有越來越多的女性使用此類藥物[4]。雌激素和孕激素受體廣泛存在于角膜、晶狀體、虹膜、睫狀體、結膜、淚腺、副淚腺和瞼板腺,對眼表微環境的穩定性和功能起著至關重要的作用[5]。AIs分非甾體類(來曲唑、阿那曲唑)和甾體類(依西美坦),AIs治療的婦女中,報告出現干眼癥狀的比例為4%~46%[6-7],AIs對眼表微環境的影響及不同類型藥物的影響是否存在差異性將是本研究的主要目標。
1 對象和方法
1.1對象橫斷面觀察性研究。研究對象為2022-11/2023-05我院乳腺科就診的接受芳香化酶抑制劑治療的藥物絕經后的女性,藥物治療時間≥6mo,根據AIs的種類分為甾體組和非甾體組。對照組為年齡相匹配的職業健康體檢女性。年齡27~49(平均39.00±6.73)歲。排除標準:既往眼部手術史(包括但不限于,如翼狀胬肉、斜視、視網膜脫離、抗青光眼等)、角膜疾病及手術史、配戴隱形眼鏡、青光眼、高度屈光不正(±6.00D以上)、糖尿病、高血壓(收縮壓>140mmHg和/或舒張壓>90mmHg)、既往診斷為干眼、吸煙和有風濕病,其他需要長期使用甾體、非甾體類藥物治療者。本研究遵循《赫爾辛基宣言》,并已通過青島市中心醫院倫理委員會審批{[Y]KY202210101}。研究開始前,工作人員向受試者詳細講解此次研究的目的、內容、操作流程、風險和可能出現的情況,并簽署知情同意書。
1.2方法所有參與者都進行了國際上常用于干眼的主觀癥狀量化問卷(眼表疾病指數、OSDI)評分,詳細的眼科檢查,包括:最佳矯正視力(LogMAR視力表示)、眼壓、眼軸、角膜曲率、淚河彎曲面的曲率半徑、淚液滲透壓、淚膜破裂時間、角膜熒光素鈉染色評分、淚液分泌試驗(SchirmerⅠ試驗)、瞼板腺紅外線評分。
1.2.1淚河彎曲面的曲率半徑檢查裂隙燈使用窄光帶,45°切入后通過眼前節照相獲取照片,應用圖片系統自帶測量圖形功能,沿淚河轉折處兩條切線做圓形,圓形的半徑為淚河彎曲面的曲率半徑,可反映淚河高度[8]。
1.2.2淚液滲透壓檢查熒光素染色前,用微量淚液收集管在外側結膜囊收集0.1μL淚液,放入摩爾濃度滲透壓儀中測量。
1.2.3淚膜破裂時間檢查檢測時用圓頭超細玻璃棒蘸取0.125%熒光素鈉溶液,在患者結膜囊內滴入1滴后囑患者閉眼,熒光素均勻分布于角膜表面,在裂隙燈顯微鏡下用鈷藍光觀察角膜前淚膜的情況,記錄最后一次瞬目到開始出現第一個干燥斑的時間。
1.2.4角膜熒光素鈉染色評分檢測時染色同淚膜破裂時間,在裂隙燈下用鈷藍光觀察,若角膜表面出現著色點則說明該處存在角膜上皮缺損。角膜熒光素鈉染色評分標準參考文獻[9]。
1.2.5 SchirmerⅠ試驗將Schirmer試紙折疊端輕輕放置于每個受試者未麻醉的下眼瞼中外1/3處,持續5min,記錄試紙顯示的數據。可直接反映主淚腺的分泌功能。
1.2.6瞼板腺紅外線評分評分標準:腺體無萎縮0分;腺體萎縮占整體的1/3為1分;腺體萎縮占整體的2/3為2分;腺體萎縮占整體的2/3以上為3分;上下瞼板腺評分相加,最高分數6分[10]。
統計學分析:采用SPSS 22.0軟件進行數據分析。計量資料以均值±標準差表示,三組間比較采用單因素方差分析,進一步的兩兩比較采用LSD-t檢驗;兩組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
本研究中,OSDI評分≥13分的,對照組2例(14%),甾體組4例(29%),非甾體組5例(36%)。對照組與甾體組、非甾體組的年齡、最佳矯正視力、眼壓、眼軸、角膜曲率比較,差異無統計學意義(均P>0.05);甾體組和非甾體組的藥物服藥時長比較,差異無統計學意義(P>0.05)。對照組與甾體組、非甾體組的OSDI評分、淚河彎曲面的曲率半徑、淚液滲透壓、淚膜破裂時間、角膜熒光素鈉染色評分、SchirmerⅠ試驗、瞼板腺紅外線評分比較,差異有統計學意義(均P<0.05);甾體組和非甾體組SchirmerⅠ試驗結果比較,差異有統計學意義(P<0.05),其余數據之間的差異無統計學意義(均P>0.05),見表1。
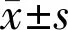
表1 三組受試者參數比較
3 討論
AIs通過抑制外周組織中將雄激素轉化為雌激素的芳香化酶而發揮作用。甾體類AIs是不可逆的芳香化酶滅活劑,是雄烯二酮衍生物,可競爭性與芳香化酶的底物不可逆的結合,阻斷雄激素轉化成雌激素;非甾體藥物是可逆的芳香化酶抑制劑,與內源性配體競爭活性位點,可與芳香化酶的血紅素鐵原子結合成牢固但可逆的配價鍵,從而阻斷雌激素的生成[11-12]。AIs治療過程不但會干擾體內性激素的水平,還會影響性激素之間的穩態,從而影響眼表各種組織結構,引起眼表微環境的紊亂,導致干眼的發生和發展[13]。
本研究中觀察到AIs治療組OSDI評分明顯高于對照組,OSDI評分≥13分的,對照組2例(14%),甾體組4例(29%),非甾體組5例(36%),干眼患病率明顯高于對照組[9,14]。AIs治療組干眼的患病率與老年女性的干眼患病率大致相同,這與體內性激素水平降低、反饋機制改變、受體結合位點改變等多種機制相互作用,降低眼表穩態,最終導致干眼的觀點相一致[5,15-17]。

本研究中,甾體組和非甾體組SchirmerⅠ試驗結果比較,差異有統計學意義(P<0.05),非甾體組主淚腺的刺激性分泌更低,這可能與依西美坦除了抑制芳香酶活性外,還具有多種生物學功能,如抗增殖、抗炎和抗氧化活性,以及依西美坦及其主要代謝物具有微弱的雄激素活性,共同參與保護主淚腺[21-23]。
總之,接受AIs治療的藥物絕經后女性患者,眼表微環境改變明顯,干眼的發生既有淚液分泌不足,也存在淚液蒸發過強。特別是接受非甾體類AIs者主淚腺分泌減少更明顯。對接受AIs治療者,建議加強治療期間眼表相關指標的檢測和對眼表的保護。

