17β-雌二醇抗BALB/c與C57BL/6小鼠視網膜光照損傷的比較
李紅波,劉鑫宇,鐘 華,姬佳彤,方佳妮,李炳武,尚雯婕,李曉楠
目的:通過建立BALB/c與C57BL/6小鼠視網膜光損傷模型,研究17β-雌二醇(17β-estradiol, E2)的視網膜神經保護作用,為成功構建E2抗視網膜光損傷模型提供實驗數據。
方法:成年雌性BALB/c、C57BL/6小鼠各40~45只,實驗分組如下:正常對照組,去勢手術對照組,去勢光照組(小鼠去勢手術14d后進行持續10000lx白光光照刺激4、8、12、16、24h組),玻璃體腔注射假手術組,生理鹽水組和E2預處理組(去勢手術14d后暗適應24h后分別行玻璃體腔注射2μL生理鹽水或10-5mol/L E2),每組各6只。通過石蠟切片HE染色、TUNEL染色、視網膜電圖檢測視網膜形態及功能變化。
結果:去勢光損組視網膜內核層/外核層厚度從白光10000lx光照4h組開始顯著減小;玻璃體腔注射E2預處理可顯著抑制兩種品系小鼠視網膜各層細胞的凋亡(P<0.01)以及C57BL/6小鼠視網膜電圖檢測中最大混合反應a波和b波波幅的下降(P<0.05)。
結論:相同光照條件對兩種品系小鼠光損敏感性存在差異;E2對BALB/c小鼠無論是視網膜形態學及功能學上都產生了保護作用,而對C57BL/6小鼠功能學保護作用顯著。
?KEYWORDS:retina light damage model; BALB/c mice; C57BL/6 mice; 17β-estradiol
0 引言
隨著電子產品使用頻率增加和照明設備的多樣化普及,長時間光照射所引起的視網膜光損傷(light-induced retinal damage,LIRD)不斷發生。目前,LIRD具體的發病機制尚未系統闡述。研究表明,過量光照造成的光損傷可介導線粒體裂變導致活性氧(reactive oxygen species, ROS)大量產生、小膠質細胞活化以及NLRP3炎性小體形成,造成視網膜結構改變和視覺功能損傷[1]。年齡相關性黃斑變性(age-related macular degeneration, ARMD)是臨床上常見的視網膜神經退行性疾病,大多數情況下表現為萎縮性ARMD,其特征主要為視網膜色素上皮(retinal pigment epithelium, RPE)細胞和光感受器細胞的緩慢變性;另外一部分表現為新生血管性ARMD,其特征是脈絡膜新生血管(choroidal neovascularization,CNV)導致視網膜脫離和失明[2]。光損傷的病理過程與ARMD及視網膜色素變性等疾病存在較多相似之處,所以對LIRD作用及其機制的深入研究有著重要的臨床和理論價值。考慮到臨床試驗的限制性以及藥物誘導神經退行性模型的不穩定性,目前各類研究中常通過構建大鼠LIRD模型用以研究神經退行性疾病的發生機制和治療方法。不同品系大鼠的視網膜對光照損傷的敏感性不同。17β-雌二醇(17β-estradiol, E2)是人體內循環最豐富也是活性最強的雌激素,被認為是中樞神經系統的神經保護劑。目前大量的相關研究均觀察到E2在視網膜中的神經保護作用,但具體分子機制有待研究。本實驗采用成年雌性去勢BALB/c與C57BL/6小鼠構建LIRD模型,探究小鼠LIRD模型的構建條件,比較兩種常見的具有代表性的品系小鼠視網膜對光照損傷的差異,為成功構建小鼠LIRD模型提供實驗數據,并在上述兩種小鼠品系光損動物模型的基礎上,進一步通過E2玻璃體腔注射預處理建立E2抗視網膜光照誘導的氧化應激(oxidative stress, OS)損傷的保護模型,為后續深入開展E2抗視網膜光照誘導的OS損傷的神經保護作用機制的研究奠定基礎。
1 材料和方法
1.1材料每批次實驗根據具體實驗分組所需小鼠的數量選擇正常成年雌性8周齡BALB/c小鼠和C57BL/6小鼠各40~45只(購于西安交通大學醫學部SPF級實驗動物中心)。觀察所有小鼠體型適中,精神狀態良好,眼球正常無晶狀體混濁,排除角膜炎、白內障等眼部疾病后將納入實驗的各品系正常小鼠隨機分組,每組6只。BALB/c小鼠LIRD模型實驗分組如下:正常組(normal control, NC),去勢手術對照組(ovariectomized control, OC),去勢光損組(ovariectomized light, O-Light);根據光照時間分為:去勢光照4h組(O-light 4h),去勢光照8h組(O-light 8h),去勢光照12h組(O-light 12h),去勢光照16h組(O-light 16h)。C57BL/6小鼠LIRD模型實驗分組如下:正常組,去勢手術對照組,去勢光照4h組,去勢光照8h組,去勢光照12h組,去勢光照16h組,去勢光照24h組。E2預保護實驗分組如下:正常組,去勢手術對照組,去勢光損組:小鼠去勢手術14d后進行持續10000lx白光光照刺激12h,假手術對照(ovariectomized lightdamaged-shamecontrol, OI-Shame)組:去勢手術14d后暗適應24h后行玻璃體腔注射假手術,生理鹽水組(ovariectomized lightdamaged-saline intravitreal injection, OI-Saline):去勢手術后暗適應24h再行玻璃體腔注射2μL生理鹽水,E2預處理組(ovariectomized light damaged-E2 intravitreal injection, OI-E2):去勢手術后暗適應24h再行玻璃體腔注射10-5mol/L E2 2μL。本實驗所涉及的動物處理過程得到西安醫學院動物倫理委員會批準,并符合公認的研究動物倫理標準和視覺與眼科學研究協會關于動物使用的聲明。
1.2方法
1.2.1去勢手術去勢組小鼠異氟烷氣體麻醉后進行摘除卵巢的去勢手術。小鼠背部髖關節連線上一指,于背部后正中線旁左右,備皮,充分暴露手術視野,在無菌條件下,向下做縱行切口約0.5~1cm,依次剪開皮膚,筋膜層,肌肉,找到卵巢后,在子宮末端與卵巢之間手術線結扎后將卵巢全部切除,縫合肌肉層和皮膚,消毒清理手術切口。術后將小鼠置于無菌墊料籠內,并在小鼠身下墊無菌棉紗布保溫,防止小鼠在麻醉中失溫死亡。在溫暖干凈通風處待蘇醒。術后3d密切觀察皮膚切口及小鼠精神狀態及進食進水情況,預防感染。待小鼠蘇醒能正常活動后轉入飼養單元飼養2wk,充分代謝體內殘余雌激素。
1.2.2建立光損模型本實驗所采用的光損實驗裝置為本實驗小組依照嚴格的設計標準進行研發,并已獲批實用新型專利證書(ZL 2018 2 1068693. 8)。光照強度范圍為1000~10000lx。光源采用三基色LED燈,光線直接照射在裝置底部,可分為8檔對光照強度進行調節。本實驗采用10000lx照度。實驗小鼠可在實驗裝置動物籠內自由飲食、活動,通過實驗裝置外部溫度調節及裝置內部通風設施以保持光照刺激期間裝置內溫度維持在24℃。光照刺激實驗前將小鼠放入暗室中暗適應24h,以增強小鼠視網膜對光照刺激的敏感性,之后根據實驗分組進行不同時間的光照刺激,光照刺激實驗結束后立即將小鼠放入暗室中暗恢復24h,進行后續實驗檢測,比較不同光照持續時間條件下視網膜形態及功能的變化情況,選擇最佳的光損實驗條件。
1.2.3玻璃體腔給藥選擇正常成年雌性8周齡BALB/c小鼠和C57BL/6小鼠,除對照組以外小鼠均行去勢手術后進行玻璃體腔給藥。去勢實驗小鼠在暗適應24h后,腹腔注射氯胺酮(120mg/kg)和甲苯噻嗪(6mg/kg)進行深度麻醉。我們之前的實驗證實10-5mol/L E2可有效預防神經細胞凋亡[3],故按照實驗分組分別進行玻璃體腔注射2μL 10-5mol/L E2、2μL生理鹽水以及構建假手術對照。具體操作方法如下:手術鑷分離小鼠眼瞼,固定并使眼球突出,眼球表皮滴加表面麻醉劑鹽酸奧布卡因滴眼液,以顳側虹膜邊緣外1~2mm為進針點,斜行45度進針約2mm,進針后有明顯落空感,觀察并確定微量注射器針尖進入玻璃體腔后注射。玻璃體腔給藥在暗室中紅光照射下進行,以保持暗適應。
1.2.4視網膜電圖檢測小鼠光照刺激結束后,暗恢復24h后立即進行視網膜電圖(electroretinogram,ERG)檢測,根據小鼠體質量腹腔注射戊巴比妥鈉(國藥集團化學試劑有限公司)與速眠新Ⅱ注射液(軍事醫學科學院軍事獸醫研究所試制)進行深度麻醉與肌松。待小鼠麻醉后在小鼠眼球表面滴加復方托吡卡胺滴眼液,作用5min以充分擴瞳,滴加表面麻醉劑鹽酸奧布卡因,以便檢測操作。將小鼠放于檢測臺上,檢測一側的眼球充分暴露正對光源,另一側貼黑色膠布,避免光源影響,放置角膜電極,尾電極和頰電極,待波形穩定后依次進行ERG五項基本反應檢測,檢測完畢后檢測對側眼球。整個過程均在暗室中進行,采用儀器為RETI-scan系統(Roland Consult)。
1.2.5制作石蠟切片完成ERG檢測后將小鼠正常飼養7d,心內注射大劑量麻醉劑處死小鼠,摘取左眼眼球制作標本。每個眼球在角膜12∶00方向,距角鞏膜緣約1mm處使用紋身液做標記,采用對軟組織破壞小的固定液(冰醋酸∶生理鹽水∶40%甲醛∶75%乙醇=1∶2∶7∶10)固定眼球,常規脫水、透明、包埋,將事先標記好視神經乳頭的蠟塊修切整齊,將蠟塊按正確方向放置于石蠟切片機上,從視神經乳頭鼻側區開始切片,設置切片厚度為10μm,隨時在顯微鏡下進行觀察切片進展情況,待蠟塊切面接近視神經乳頭處時,調整切片厚度為4μm,顯微鏡下觀察切割過視神經乳頭進入顳側區開始,連續切取石蠟切片15張。
1.2.6 HE染色取5張組織切片充分干燥后進行HE染色,顯微鏡下觀察比較視網膜乳頭部附近各層細胞的結構變化,對距乳頭部不同距離處(每次間隔5μm)的內外核層厚度進行測量,取5張切片的平均值,累計6個獨立重復樣本后對結果進行統計學分析。
1.2.7 TUNEL檢測眼球石蠟切片于烘箱干烤脫蠟后,按照TUNEL染色試劑盒(南京凱基生物科技發展有限公司)流程說明進行染色,顯微鏡下選擇距視神經乳頭相同距離的視網膜部位,觀察比較光損傷后不同品系大鼠視網膜陽性染色細胞分布情況,并分別統計比較陽性染色細胞數。
統計學分析:采用GraphPad Prism 7.0a軟件程序進行數據分析。多組間差異檢驗采用ANOVA分析,結合Tukey檢驗進行兩組分析,P<0.05為差異有統計學意義。
2 結果
2.1正常組BALB/c小鼠與C57BL/6小鼠視網膜組織形態比較正常組C57BL/6小鼠視網膜內核層(inner nuclear layer, INL)與外核層(outer nuclear layer, ONL)厚度均顯著小于BALB/c,差異均有統計學意義(P<0.01),見圖1。說明正常生理條件下,C57BL/6與BALB/c小鼠視網膜INL與ONL厚度自身存在顯著差異。
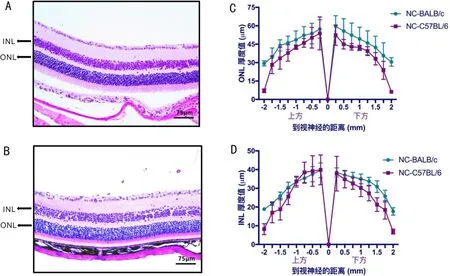
圖1 正常組BALB/c與C57BL/6小鼠視網膜HE染色和視網膜厚度蛛網統計圖 A:BALB/c小鼠;B:C57BL/6小鼠;C:ONL厚度蛛網統計圖;D:INL厚度蛛網統計圖。
2.2不同光照時間下BALB/c小鼠視網膜組織形態變化
10 000lx白光照射刺激4~16h的BALB/c小鼠各組視網膜INL、ONL厚度均較正常對照組顯著減小,差異均有統計學意義(P<0.01),見圖2。說明從10000lx白光照射刺激4h開始,即可造成BALB/c小鼠視網膜組織損傷,特別是光損12h以后視網膜損傷尤為嚴重,ONL細胞幾乎完全消失,INL界限顯著縮小,ONL的損傷較INL更為敏感。
2.3不同光照時間下C57BL/6小鼠視網膜組織形態變化
與正常對照組相比,去勢光照各組中10000lx白光照射刺激4~24h ONL厚度變化并不顯著,但INL厚度顯著降低,差異均有統計學意義(P<0.01),見圖3。說明在相同的光照損傷刺激條件下,C57BL/6小鼠視網膜INL由于富含三類重要的神經元,即視錐視桿細胞、雙極細胞和神經節細胞,所以對光損條件較ONL更為敏感。
2.4 E2玻璃體腔注射預處理下光損BALB/c小鼠視網膜組織形態變化與去勢光照12h組相比,E2預處理組小鼠視網膜INL、ONL厚度顯著升高,差異均有統計學意義(P<0.01),見圖4,進而說明E2預處理可顯著抑制光損導致的BALB/c小鼠視網膜ONL及INL厚度的減小。

圖4 玻璃體腔給藥預處理后光損BALB/c小鼠視網膜HE染色和視網膜厚度蛛網統計圖 A:正常組;B:去勢手術對照組;C:去勢光照12h組;D:假手術對照組;E:生理鹽水組;F:E2預處理組;G:ONL厚度蛛網統計圖;H:INL厚度蛛網統計圖。
2.5 E2玻璃體腔注射預處理下光損C57BL/6小鼠視網膜組織形態變化與正常組相比去勢光照12h組C57BL/6小鼠視網膜ONL、INL厚度顯著減小,差異均有統計學意義(P<0.05),而E2預處理組與去勢光照12h組相比可增加ONL及INL厚度但差異無統計學意義(P>0.05),見圖5。實驗結果表明,形態學上E2抗C57BL/6小鼠視網膜細胞光損的作用表現并不顯著。
2.6 E2玻璃體腔注射預處理下光損BALB/c小鼠視網膜功能學變化與去勢手術對照組相比,光損12h后BALB/c小鼠內外層顯著出現凋亡陽性染色,差異有統計學意義(P<0.01),與去勢光照12h組相比,E2預處理組陽性細胞凋亡百分比顯著下降,差異有統計學意義(P<0.01),見圖6。說明E2可顯著抑制由光損導致的BALB/c小鼠視網膜細胞凋亡。
2.7 E2玻璃體腔注射預處理下光損C57BL/6小鼠視網膜功能學變化與去勢手術對照組相比,光損12h后BALB/c小鼠內外層出現凋亡陽性染色,差異有統計學意義(P<0.01);與去勢光照12h組相比,E2預處理組陽性細胞凋亡百分比顯著下降,差異有統計學意義(P<0.01),見圖7。說明E2可顯著抑制由光損導致的C57BL/6小鼠視網膜細胞的凋亡。
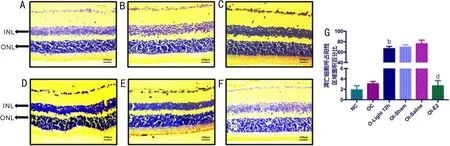
圖7 不同玻璃體腔給藥預處理后光損C57BL/6小鼠視網膜TUNEL染色 A:正常組;B:去勢手術對照組;C:去勢光照12h組;D:假手術對照組;E:生理鹽水組;F:E2預處理組;G:視網膜凋亡陽性細胞染色統計圖。bP<0.01 vs 去勢手術對照組;dP<0.01 vs 去勢光照12h組。
2.8 E2玻璃體腔注射預處理下光損C57BL/6小鼠的功能保護作用在10000lx光照12h后對正常C57BL/6小鼠并不會產生顯著作用,對去勢光損小鼠均使得最大混合反應a波波譜及b波波幅顯著下降,差異有統計學意義(P<0.05),見圖8。
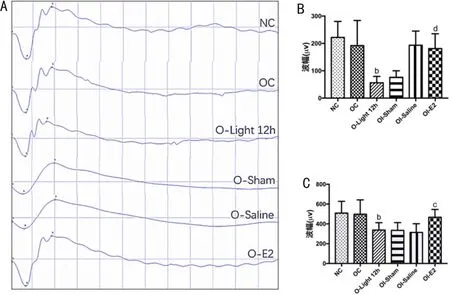
圖8 玻璃體腔給藥預處理后光損C57BL/6小鼠視網膜ERG檢測 A:成年雌性去勢C57BL/6小鼠玻璃體腔給藥預處理后光損下視網膜ERG檢測圖;B:ERG檢測中最大混合反應a波振幅統計圖;C:ERG檢測中最大混合反應b波振幅統計圖。bP<0.01 vs 去勢手術對照組;cP<0.05,dP<0.01vs去勢光照12h組。
3 討論
不同光源以及光照強度、持續時間對光損動物模型建立產生著重要影響。頻率高、能量大的藍光是光損模型構建的良好選擇。研究表明,藍色LED光源構建光損傷效率明顯優于正常白光,而且藍光可誘導視錐感光細胞凋亡,并改變視紫紅質定位[4]。同時過度暴露于藍光下可通過增加細胞內鐵離子濃度誘導RPE細胞氧化應激平衡的破壞以及脂質氧化物的沉積,進而造成細胞鐵死亡發生[5]。白光可反應多種混合光的綜合作用以及具有模擬日光對視網膜損傷的特點,被大部分學者采用。在光照強度以及時間的選擇上,大多數學者采用4000~5000lx,且短時間進行強光照射可構建急性光損模型。研究表明采用短暫強光條件造成的光損傷可誘導血管內皮生長因子上調,促進CNV生長進而促進進行性視網膜變性的發展,這也表明急性光損傷模型可能將專門用作新生血管性ARMD的模型[6]。基于上述因素,我們的實驗采用10000lx白光并發現照射12h及以上能構建相對穩定的LIRD模型。
基于哺乳類實驗動物來源廣泛的便捷性,目前動物模型構建主要以大鼠、小鼠為主。大鼠視網膜的背中央區被認為與人類視網膜黃斑區功能類似,與年齡相關的視網膜病存在密切聯系。SD大鼠光損傷的敏感性最強,在構建LIRD模型被廣泛應用。小鼠在光損模型應用上主要包括BALB/c、C57BL/6以及其他特異性基因敲除小鼠。我們的實驗對BALB/c、C57BL/6小鼠同時進行LIRD模型構建,分別觀察兩種不同品系小鼠在不同光照強度下視網膜結構和功能的變化。C57BL/6小鼠為非白化鼠,視網膜存在RPE細胞。C57BL/6小鼠可表達RPE65(450Met)的耐光變體,對光誘導損傷具有一定的抵抗能力,更接近人類對光損的敏感性。研究表明RPE細胞既可以向光感受器運輸營養物質,如ω-3脂肪酸、葡萄糖和視黃醇,也可將特定離子、水和代謝終產物從視網膜下間隙輸送到脈絡膜血管,在維持視網膜正常代謝中起到了不可或缺的作用[7]。同時RPE細胞中含有大量的對光損傷敏感的物質如線粒體和不飽和脂肪酸,過量光照可造成OS失衡并產生活性氧自由基導致感光細胞外段解體、內節線粒體腫脹變性,進一步加快了RPE細胞的凋亡[8]。BALB/c小鼠為白化鼠,視網膜沒有RPE細胞,不能直觀地反應光照對人視網膜的損害。此外,C57BL/6與BALB/c小鼠的光感受器損失率存在顯著差異,在整個成年期BALB/c小鼠中發生視桿細胞的丟失更多,C57BL/6小鼠視網膜形態和功能在成年后期將保持穩定[9]。故我們的實驗選取抗光損能力更強、更接近人體正常眼球結構的C57BL/6小鼠來構建LIRD模型。
E2是中樞神經系統中一種強抗氧化劑,已在各種神經元細胞和中樞神經系統疾病的動物模型中顯示出對神經退行性疾病具有保護作用,包括阿爾茨海默病(Alzheimer’s disease,AD)和帕金森病[10]。E2通過增強大腦中調節認知功能的不同區域的棘突生成來改善嚙齒動物的海馬形態、可塑性和記憶功能[11],這可能會成為干預甚至逆轉AD中神經變性的途徑之一。視網膜富含神經元,可作為神經系統的外延器官之一來研究E2的神經保護作用。研究表明,E2可以顯著抑制光誘導的大鼠視網膜RPE細胞損傷,也可通過抑制toll樣受體2介導的炎癥反應從而保護視網膜神經細胞免受OS破壞[12]。OS是許多視網膜疾病的重要致病因素,在體光誘導損傷時OS在LIRD模型建立中起重要作用[13]。抗氧化劑的干預成為防止LIRD病情加重的重要措施之一。E2在視網膜細胞中可發揮顯著的抗氧化作用,通過減少ROS的產生來阻止OS誘導的視網膜神經元、RPE細胞和人晶狀體上皮細胞的凋亡,延緩視網膜變性的發生發展[14-15]。此外,研究表明E2預處理對藍光誘導的RD和H2O2誘導的氧化應激具有顯著的保護作用,這種保護作用可能通過減少視網膜細胞凋亡和增加自噬來實現[16]。這些發現表明E2及其結構功能類似物具有良好的藥物研發前景進而治療視網膜神經退行性疾病。本研究中,我們發現白光照射可導致視網膜形態嚴重破壞,2μL 10-5mol/L E2預處理可以顯著抑制BALB/c小鼠光感受器損害和ONL厚度減少以及抑制視網膜細胞的凋亡,同時在C57BL/6小鼠中形態學上E2并未表現出顯著的預保護作用,但可顯著抑制視網膜功能障礙,主要體現在顯著減少視網膜凋亡細胞的比例和顯著抑制最大混合反應a、b波的下降。a波主要反映視網膜光感受器的功能,對視桿細胞較為敏感,而b波來自視網膜INL的電活動,與視網膜雙極細胞有密切關系[17]。實驗結果說明E2對于抗光照誘導的C57BL/6小鼠視網膜OS損傷具有重要的神經細胞功能的保護作用。分析原因:(1)可能是因為BALB/c小鼠相對于C57BL/6小鼠在相同的光損條件刺激下,經歷了更為劇烈的損傷,各組比較時E2保護作用的顯著性更容易突顯;(2)可能是由于品系的差異,E2對C57BL/6小鼠視網膜保護作用在形態學改變相對于ERG等功能學改變更加滯后,光損7d后形態學上尚未累積到顯著變化。
綜上所述,不同品系小鼠對光損造成視網膜損傷的敏感性存在一定差異,通過相同條件下對兩種不同品系小鼠光損模型建立對比發現,BALB/c小鼠ONL層對光損更敏感,而C57BL/6小鼠INL層對光損更敏感,采用C57BL/6小鼠品系造模更能模擬人正常眼球視網膜的光照損傷過程,對大多數光照損傷和視網膜病變更具有代表性。此外E2的玻璃體腔預處理對視網膜功能的保護作用顯著,深入研究其保護作用機制將為臨床抗視網膜及中樞神經系統退行性疾病的治療藥物研發提供重要的實驗數據。

