蘭州百合多糖與有氧運動對鏈脲佐菌素誘導的糖尿病大鼠腎組織的保護機制
李守漢,高文峰,崔治家
(1.蘭州大學體育教研部,甘肅 蘭州 730000;2.甘肅中醫藥大學藥學院,甘肅 蘭州 730000)
糖尿病(diabetes mellitus,DM)是一種具有長期性的代謝紊亂疾病,并伴有多種并發癥[1],其特點是血糖高,是由胰島素(insulin,INS)分泌缺陷、INS功能下降或兩者同時引起的。INS分泌不足和血液中高濃度葡萄糖的產生還可能造成一些器官衰竭,甚至功能喪失[2]。DM可通過代謝應激、組織損傷和細胞死亡的自催化循環而導致自由基產生的抑制作用及清除機制受損,從而進一步加劇氧化應激[3]。糖尿病治療的主要目標是使血糖、血脂和脂蛋白水平接近正常水平,并清除自由基,使各組織功能得到恢復。糖尿病腎病(diabetic nephropathy,DN)是糖尿病患者最重要的并發癥之一。糖尿病的微血管并發癥與高血糖有關,其原因是高血糖通過代謝紊亂導致DN的發生與發展[4]。DN由多因素導致,而以高血糖、晚期糖基化終產物和氧化應激為主要因素,造成的免疫細胞浸潤和腎臟慢性炎癥是公認的病理機制[5]。
從植物中提取的多糖由于其低毒性和多種藥理活性而受到研究人員的廣泛關注[6]。多糖由單糖單元組成并通過糖苷鍵連接,其具有的抗糖尿病特性已成為一個重要的研究領域[7]。已有研究表明,百合多糖既可提高糖代謝酶的活性,促進葡萄糖的攝取和利用;又可增加INS分泌,調節1型糖尿病大鼠的血糖[8]。蘭州百合(Lilium davidiivar.unicolor)為多年生鱗莖類草本植物,是百合科百合屬川百合的一個變種,僅適宜在蘭州周邊二陰山區種植;研究發現,蘭州百合多糖(Lanzhou lily polysaccharide,LLP)含有乙酰基葡萄糖與甘露糖結合的結構[9],具有治療支氣管擴張、抗腫瘤、抗疲勞、調節免疫、降血糖、抗氧化、抑菌等作用[10]。目前,運動療法是一種安全、簡單、有效的治療糖尿病的方法,其有效性已在基礎研究和臨床應用中得到證實[11]。然而對LLP與有氧運動(aerobic exercise,AE)降血糖及對糖尿病并發癥作用的研究報道較少。本研究旨在研究LLP與AE結合對糖尿病鏈脲佐菌素所致糖尿病大鼠空腹血糖、脂質過氧化及腎臟保護作用的影響。
1 材料與方法
1.1 動物、材料與試劑
清潔級健康成年雄性W i s t a r 大鼠,體質量200~220 g,來自甘肅中醫藥大學動物實驗中心,合格證號:N062000800000023,生產許可證號:SYXK(甘)2020-0009。
蘭州百合購自蘭州市黃河藥材市場。
LLP的制備方法:蘭州百合廢棄鱗莖→粉碎(過100 目篩)→干燥→稱質量→超聲波協同復合酶提取→酶滅活→抽濾、取上清液→4 000 r/min離心15 min,取上清液→減壓濃縮→真空干燥至恒質量→蘭州百合多糖[12]。實驗前以蒸餾水為溶劑配制成一定濃度樣品,4 ℃低溫保存,備用。
鏈脲佐菌素(streptozocin,STZ) 美國Sigma公司;檸檬酸 北京華越洋生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、INS試劑盒 南京建成生物工程研究所;蘇木精-伊紅(hematoxylin and eosin,HE)試劑盒、Western blot二抗 北京索萊寶科技有限公司。
1.2 儀器與設備
Accu-Chek血糖測定儀 瑞士羅氏集團;血糖儀美國強生公司;7600-010全自動生化分析儀 日本日立公司;H54AR分析天平 瑞士梅特勒-托利多公司;Biofuge fresco低溫離心機 德國Heraeus公司;Vanox光學顯微鏡 日本Olympus公司;RY-2235病理切片機徳國Leica公司。
1.3 方法
1.3.1 實驗分組
選取大鼠50 只,遵循相關倫理學要求,所有動物實驗均在標準籠中飼養并保持室溫(24±1)℃、相對濕度(50±10)%,自然光照,自由飲食飲水。動物房及用具等定期用紫外燈消毒滅菌。適應性喂養1 周之后隨機分為正常對照組(n=10)和DM模型組(n=40),前者腹腔注射一定劑量(60 mg/kgmb)0.1 mol/L pH 4.2檸檬酸緩沖液,后者腹腔內注射STZ(60 mg/kgmb)誘發糖尿病,48 h后,大鼠出現多飲、多食、多尿,尿液檢驗試紙檢測尿糖為+++到++++,再以空腹尾靜脈采血,用血糖儀測定大鼠空腹血糖濃度在16.67~26.00 mmol/L之間則確認糖尿病建模成功。之后將糖尿病組再分為糖尿病對照組(DM)、有氧運動組(DM+AE)、LLP給予組(DM+LLP)和綜合治療組(DM+LLP+AE)4 組。
1.3.2 動物運動訓練與喂藥
注射STZ 1 周后,DM+AE組和DM+LLP+AE組大鼠進行6 周游泳訓練,水池水溫在34~36 ℃左右,水深50 cm,為保證游泳期間能夠持續活動,大鼠在水面活動的面積平均為250 cm2。每周游泳5 d,游泳時間為:第1~2周每日40 min,第3~4周每日60 min,第5~6周維持在90 min。這兩組每日進行游泳訓練結束后,用吸水紙將大鼠身體上水擦干并用電吹風機烘干大鼠毛發。
糖尿病建模成功后,DM+LLP組和DM+LLP+AE組以LLP 150 mg/kgmb灌胃,用蒸餾水將LLP配制成質量濃度為15 mg/mL溶液,灌服量為1 mL/l00 gmb,每天1 次;正常對照組、DM組、DM+AE組每天灌服蒸餾水1 mL/100 gmb。
1.3.3 樣本采集
第6周訓練結束后,休息24 h。然后所有組大鼠利用2.5%戊巴比妥納注射液以50 mg/kgmb注射量腹腔注射麻醉。處死、破腹、左心室取血,離心(3 500 r/min)20 min,取上清液,-4 ℃保存備用。
血液采集后,進行腹部切口取雙腎,一部分腎組織固定于4%中性甲醛溶液中,其余腎組織于-80 ℃液氮中保存,以備腎臟組織學觀察。
1.3.4 生化指標測定
血糖測定儀檢測空腹血糖(fasting blood glucose,F B G)濃度,全自動生化分析儀檢測甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)、血尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)濃度;利用試劑盒檢測血清INS濃度、SOD活力和MDA濃度。
1.3.5 腎臟組織病理學觀察
在室溫下,腎組織在4%中性甲醛溶液中固定24 h后,從不同的組中采集小部分腎組織,通過梯度乙醇(體積分數分別為70%、80%、90%、95%、100%)系列脫水,然后在二甲苯中脫水透明,嵌入石蠟中,切成4 mm厚的切片。組織切片用HE染色,光學顯微鏡下觀察。
1.3.6 Western blot法測定Bax/Bcl-2和Caspase-3的表達量
按照總蛋白提取試劑盒說明書裂解腎組織細胞,提取總蛋白。BCA法測定總蛋白濃度。十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulphatepolyacrylamide gel electrophoresis,SDS-PAGE)分離蛋白質;經濕轉將蛋白質轉移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上;然后將膜用TBST溶液(含質量分數5%脫脂奶粉、0.1% Tween-20)室溫封閉2 h。置于稀釋一抗中,4 ℃振蕩過夜,用TBST溶液洗4 次,在二抗中孵育30 min后,用TBST溶液洗3 次;在暗室中將顯色液ECLA和ECLB以體積比1∶1混合后覆蓋在膜上,1~2 min后去盡殘液,進行曝光。曝光后的膠片用顯影、定影試劑進行顯影和定影。依不同的發光強度調整曝光條件。用圖像分析系統對Western Blot結果進行灰度掃描,以目的蛋白條帶灰度值和內參蛋白條帶灰度值的比值作為相應樣本的蛋白表達量。
1.4 數據統計分析
采用SPSS 19軟件對所有數據進行處理,結果用平均值±標準差表示,利用單因素方差分析(one-way analysis of variance,ANOVA)檢驗結果的差異顯著性,P<0.05表示差異顯著。
2 結果與分析
2.1 LLP和AE對DM大鼠FBG與INS濃度的影響
由圖1可知,與正常對照組相比,STZ誘導的糖尿病大鼠FBG濃度顯著升高(P<0.05),INS濃度顯著降低(P<0.05)。與DM組比較,DM+AE組、DM+LLP組和DM+LLP+AE組FBG濃度顯著降低(P<0.05),DM+LLP組和DM+LLP+AE組INS濃度顯著升高(P<0.05)。表明LLP與有氧運動都具有降低血糖和提高INS水平的作用,而LLP與有氧運動同時干預對降低血糖的效果更明顯。
2.2 LLP和AE對糖尿病大鼠的血清SCr、BUN、TC和TG濃度的影響
圖2顯示,注射STZ后,SCr、BUN、TC和TG濃度顯著高于正常對照組大鼠(P<0.05)。與DM組相比,DM+AE組、DM+LLP組和DM+LLP+AE組血清SCr、TC和TG濃度顯著降低(P<0.05),DM+LLP組和DM+LLP+AE組BUN濃度顯著降低(P<0.05),DM+AE組BUN濃度變化不顯著。表明服用LLP和長期進行有氧運動可降低糖尿病高血脂癥,預防動脈粥樣硬化的形成,減輕對腎臟組織的損傷。


圖2 LLP和AE對糖尿病大鼠的血清SCr(A)、BUN(B)、TC(C)和TG(D)濃度的影響Fig.2 Effect LLP and AE on SCr (A), BUN (B), TC (C) and TG (D) in diabetic rats
2.3 LLP和AE對糖尿病大鼠腎組織SOD活力和MDA濃度的影響
圖3 顯示,與正常對照組比較,D M 組大鼠中SOD活力顯著降低(P<0.05),MDA濃度顯著升高(P<0.05)。與DM組大鼠相比,DM+LLP+AE組SOD活力顯著升高(P<0.05),DM+AE組、DM+LLP組SOD活力無顯著變化,DM+LLP組與DM+LLP+AE組MDA濃度顯著降低(P<0.05),DM+AE組MDA濃度無顯著變化。

圖3 LLP和AE對糖尿病大鼠腎組織SOD活力(A)和MDA濃度(B)的影響Fig.3 Effects of LLP and AE on SOD activity (A), and MDA content(B) in kidney tissue of diabetic rats
2.4 LLP和AE對糖尿病大鼠腎組織病理學的影響
圖4顯示,正常對照組腎小球的結構正常,毛細血管結構完整、清晰,系膜區無增生,基底膜完整無增厚,未見炎性細胞浸潤。DM組腎臟中的腎小球硬化、間質纖維化、脂質積累,出現細胞凋亡和炎癥細胞浸潤。與DM組相比,LLP和有氧運動治療及二者結合治療的糖尿病大鼠中,腎小球的結構和形態特征得到改善和恢復。表明LLP和有氧運動可改善腎小球肥大和腎小球系膜擴張。
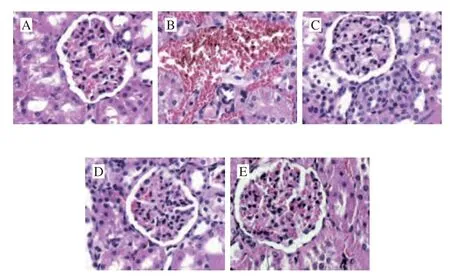
圖4 LLP和AE對糖尿病大鼠腎組織病理學的影響(×400)Fig.4 Effects of LLP and AE on kidney injury in diabetic rats (× 400)
2.5 LLP和AE對糖尿病大鼠腎組織細胞Bax/Bcl-2及Caspase-3相對表達量的影響
Western blot結果顯示(圖5),與空白對照組比較,DM大鼠腎臟的Bax/Bcl-2及Caspase-3相對表達量均顯著上調(P<0.05)。與DM組大鼠相比,DM+LLP組與DM+LLP+AE組Bax/Bcl-2相對表達量顯著降低(P<0.05),DM+AE組Bax/Bcl-2相對表達量無顯著變化,DM+LLP+AE組Caspase-3相對表達量顯著降低(P<0.05),DM+AE組、DM+LLP組Caspase-3相對表達量無顯著差異。


圖5 LLP和AE對糖尿病大鼠腎組織細胞Bax/Bcl-2及Caspase-3表達量的影響Fig.5 Effects of LLP and AE on protein expression of Bax/Bcl-2 and Caspase-3 in kidney tissue of diabetic rats
3 討 論
3.1 LLP和AE對DM大鼠FBG與INS及脂質代謝的影響
DM是一種代謝紊亂疾病,其特征是由于身體產生激素或對INS的反應能力受損而導致的高血糖癥[13]。造成INS效力不足的原因包括胰導β細胞分泌INS的量不足或INS氨基酸排列異常、在血液中有INS拮抗物質存在、組織對INS有拮抗性。研究發現,有氧運動能顯著降低DM大鼠FBG水平,增加INS敏感性[14]。運動能改善人類和動物的INS抵抗和葡萄糖敏感性,可能是因為促進了AMPK、PGC-1α和其他參與線粒體生物發生的基因的表達[15]。本實驗中,單獨給予LLP和有氧運動都能使DM大鼠FBG濃度顯著下降(P<0.05),單獨給予LLP及補充LLP的同時進行有氧運動均能顯著增加INS的分泌量(P<0.05),這可能是由于有氧運動或LLP的生物活性改善了機體的INS敏感性。表明長期補充LLP的同時進行有氧運動能更加減輕DM大鼠的胰島β細胞的損傷,使INS的分泌量增加,從而降低了血糖。同時服用LLP和進行有氧運動能顯著降低DM大鼠血清TG、TC濃度(P<0.05),這可能是LLP和氧運動通過增加DM大鼠INS的釋放使3-羥基-3-甲基戊二酸單酰輔酶A還原酶水平升高,從而達到降脂的作用。
3.2 LLP和AE對DM大鼠腎組織SOD活力及MDA含量的影響
氧化應激可促進DN發病及其并發癥的發生發展[16],主要原因之一是活性氧(reactive oxygen species,ROS)會損傷細胞內DNA并最終導致細胞凋亡的發生[17]。ROS還可通過激活DM患者中的內質網應激促進腎小管細胞凋亡[18]。DM患者體內多余的血糖通過葡萄糖自動氧化、多元醇途徑和蛋白質的非酶糖化誘導自由基形成從而引起氧化應激[19]。研究發現,STZ誘導的DM大鼠表現出大多數DM并發癥,通過介導氧化應激產生破壞β細胞的自由基[20]。Hui Heping等從蘭州百合的鱗莖中分離純化得到一種含O-乙酰基的甘露葡聚糖(BHP-1),發現其具有明顯的體外抗氧化活性和抗菌活性[21]。本實驗結果顯示,與正常對照組相比,DM大鼠抗氧化酶SOD活力顯著下降,MDA濃度顯著增加,而LLP和有氧運動均可改善這兩個指標,可能是通過抑制ROS的生成降低了氧化應激水平,從而保護DM大鼠的β細胞結構和功能,抑制DN的進一步發展。
3.3 LLP和AE對DM大鼠腎組織的保護作用
在DM的進展期間,高血糖和高脂血癥的代謝失調會引發DN,DN伴有白蛋白尿,其特征是腎小球濾過率降低、腎小球肥大、蛋白尿、腎小球基底膜增厚、系膜擴張、足細胞丟失、腎小球硬化和間質纖維化[22]。高脂血癥可通過激活轉化生長因子(transforming growth factor,TGF)-β1通路來誘導腎損傷,從而促進腎內活性氧的生成,并導致單核細胞和巨噬細胞的腎小球浸潤[23]。研究表明,2型DM大鼠經黑洋蔥粗多糖灌胃后,肌酐水平顯著降低,腎小球形態較完整,說明多糖對DM大鼠的腎臟組織具有一定的保護和修復作用[24]。牡丹皮多糖能明顯改善DN大鼠腎臟組織病理損傷及相關腎臟指標,主要通過調節氧化應激和調節炎癥因子達到保護DN大鼠腎臟的作用[25]。在本研究中觀察到DM大鼠腎小球損傷、慢性炎癥和固有細胞壞死。在LLP與有氧運動單獨治療DM組的腎臟切片中觀察到腎微結構輕微變形,腎小管結構大部分改變,在LLP聯合有氧運動的情況下,大鼠腎小球的結構和形態特征得到改善和恢復;表明LLP和有氧運動可改善STZ誘導的DM大鼠腎臟腎小球肥大和腎小球系膜擴張,有效保護腎臟。
3.4 LLP和AE對DM大鼠腎臟Bax、Bcl-2及Caspase-3表達的影響
細胞凋亡是一種受調節和程序化的細胞自主死亡[26]。細胞凋亡途徑主要包括線粒體途徑(或稱內在途徑)和死亡受體途徑(或稱外在途徑)[27]。細胞凋亡涉及多種蛋白質,包括Bcl-2和Caspase家族。線粒體介導的凋亡通路受Bcl-2家族蛋白的調控,其中Bcl-2和Bax分別是主要的抗凋亡蛋白和促凋亡蛋白[28]。研究表明,Bax/Bcl-2表達量比值在確定細胞凋亡的執行方面可能比單獨的任一蛋白質的表達更重要,因為Bax/Bcl-2表達量增加會上調Caspase-3表達量,后者會激活DNA酶,導致細胞凋亡[29]。在多種病理條件下Caspase活化且最終使細胞凋亡過程完成[30]。Caspase-3被認為是細胞凋亡過程中的關鍵執行者,它通過切割各種蛋白質底物,包括細胞核、細胞骨架、內質網和細胞溶膠中的蛋白質,最終導致細胞凋亡[31]。由于氧化應激和炎癥協同作用誘導細胞凋亡,通常認為Caspase-3是參與細胞凋亡蛋白酶級聯反應的必需蛋白質,因此Caspase-3的活化是凋亡進入不可逆階段標志[32]。黃芪多糖可促進高糖誘導的腎小管上皮細胞增殖,抑制細胞凋亡及轉分化,其機制與下調Janus激酶(Janus kinase,JAK)/信號轉導子和轉錄激活子(signal transducer and activator of transcription,STAT)信號通路有關[33]。從本實驗的Western blot結果可知,與正常對照組相比,STZ誘導的DM腎臟細胞Caspase-3和Bax/Bcl-2相對表達量顯著上調。LLP聯合有氧運動對降低腎臟細胞Caspase-3及Bax/Bcl-2的相對表達量最有效。結果提示,LLP和有氧運動能有效地下調Bax/Bcl-2和Caspase-3的表達,明顯抑制DM大鼠腎臟細胞凋亡。
綜上,LLP聯合有氧運動能降低DM大鼠空腹血糖,增加INS的分泌,有效降低DM大鼠血脂水平,增加腎組織抗氧化酶的活性,使腎組織的結構和形態特征得到改善和恢復,明顯抑制糖尿病腎臟細胞凋亡。

