糖尿病與宿主腸道菌群的關系及飲食介導的菌群調控作用研究進展
王丹萍,徐珒昭,張曉航,寧 可,劉 葉,徐遠志,解慶剛,許曉曦,*
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.東北農業大學 乳品科學教育部重點實驗室,黑龍江 哈爾濱 150030;3.黑龍江飛鶴乳業有限公司,黑龍江 齊齊哈爾 164800)
糖尿病是胰島素分泌不足(和/或利用障礙)引發的代謝性疾病,典型的糖尿病臨床表現為“三多一少”癥狀,即多飲、多尿、多食、體質量下降,以及高血糖、高尿糖癥狀[1-2]。近年來,隨著生活節奏的加快、超加工食品的泛濫及生活、工作壓力的日益加劇,糖尿病發病人數激增且呈現年輕化趨勢。國際糖尿病聯盟在2021年調查數據顯示,全球糖尿病患者人數已達5.37 億,其中中國患病人數約為1.36 億,較2020年增長了2.8%[3]。糖尿病患者的快速增長給各個國家均帶來巨大的經濟負擔,2007—2017年美國用于糖尿病的支出從2 320億 美元增加到7 270億 美元,且預計到2045年突破7 600億 美元[4]。
飲食在生命體過程中發揮著至關重要的作用。近期有研究指出[5],與物種的體型和壽命相比,引起動物死亡風險的更關鍵因素是飲食。糖尿病的發生、發展與飲食結構和方式密切相關,高脂高糖飲食被機體代謝后會促進腸道致病菌生長,產生毒力因子脂多糖(lipopolysaccharide,LPS)、氧化三甲胺(trimethylamineN-oxide,TMAO)以及吲哚等,也可使血漿中游離脂肪酸升高,損傷胰島素分泌功能,進而導致肥胖及糖尿病[6-10]。腸道微生物作為吸收飲食成分產生相應代謝物的轉換載體,其組成結構的動態平衡與糖尿病的發生、發展密切相關,一旦失衡可直接導致糖、脂、氨基酸代謝異常,出現非感染性炎癥,腸屏障通透性增加,使腸道致病菌產生的毒素直接入血。近年來,一些研究結果表明腸道菌群是飲食與疾病之間的主要介導因素。科學飲食可增加菌群的多樣性、建立良好的腸道環境并加固腸道屏障,激發機體自身保護機制降低糖尿病發生率及其惡化;與其相反的是,不良飲食(高脂、高糖、高鹽、少膳食纖維等)會促進有害菌增殖,破壞腸穩態及屏障作用,降低腸道免疫功能。已有不少臨床研究結果證實,不同類型糖尿病的腸道菌群結構特征以及與其他檢測指標具有直接的相關性。歸納、整理糖尿病患者的腸道微生態特征,充分闡述飲食介導腸道菌群及其代謝產物通過調節腸免疫達到預防和調控糖尿病的原理及方法至關重要,同時可以指導患者通過科學飲食有效緩解并延緩糖尿病并發癥,也為糖尿病的及早發現和干預指明方向。
1 腸道微生物與糖尿病的關系
糖尿病患者往往會出現腸道微生物群系穩態失衡、屏障受損、免疫功能下降等現象,嚴重者會誘發如中風、冠狀動脈阻塞、視網膜病變,以及肝臟、腎臟等組織器官功能減退、衰竭等并發癥[11-13]。是否能夠通過其腸穩態改變及一些菌群代謝產物的變化進行糖尿病的預判還需深入研究。
1.1 不同類型糖尿病及其患病個體腸道菌群特征
不同類型糖尿病患者的基因、生活環境、飲食習慣各異,致使其腸道微生物特征也存在明顯差異。腸道微生物標志性特征可作為糖尿病診斷的表征之一。
1.1.1 1型糖尿病
腸道微生物組與糖尿病在病理生理學方面有著密切聯系,菌群結構的改變可以影響1型糖尿病(type 1 diabetes,T1D)患者的糖代謝與脂肪代謝。T1D主要由遺傳因素引起,是由易感個體細胞免疫介導的胰腺細胞自我破壞引起胰島素缺乏導致的自身免疫性疾病。大部分T1D患者是先天性,即從出生開始腸道有益菌就低于正常水平,其腸道微生物群的短鏈脂肪酸(short-chain fatty acids,SCFAs)生物合成、支鏈氨基酸分解代謝以及細菌發酵能力相對較弱[14]。T1D患者腸道菌群特征表現出α多樣性顯著降低,糞桿菌屬(Faecalibacterium)、考拉桿菌屬(Phascolarctobacterium)、芽孢桿菌屬(Bacillus)、雙歧桿菌屬(Bifidobacterium)等相對豐度降低,擬桿菌屬(Bacteroides)、布勞特氏菌屬(Blautia)、鏈球菌屬(Streptococcusgenera)等相對豐度顯著升高[15],瘤胃球菌(Ruminococcus)、韋榮球菌屬(Veillonella)等在不同文獻中結果存在差異性,普雷沃菌屬(Prevotella copri)、惰性真桿菌及Alistipes inops富集。在門水平上T1D患者和健康人群也存在差異,兩者優勢菌門分別是擬桿菌門(Bacteroidetes)和厚壁菌門(Firmicutes)[16]。T1D患者腸道內細菌代謝活性減弱,相應的外分泌胰腺蛋白質水平較低,在T1D患者體內發現其血糖控制性指標糖化血紅蛋白水平與普雷沃氏菌科豐度呈負相關,腸桿菌目豐度與平均血糖指數呈正相關[17]。
1.1.2 2型糖尿病
2型糖尿病(diabetes mellitus type 2,T2DM)患者類型占總糖尿病患者的90%,目前已發現瘤胃球菌豐度與T2DM呈正相關,而產生丁酸鹽細菌(如毛螺菌屬、布勞特氏菌屬)的豐度與T2DM呈負相關[18]。腸道內擬桿菌屬(Bacteroides)和雙歧桿菌屬(Bifidobacterium)是糖尿病研究中最常見的有益菌屬,較多研究結果表明雙歧桿菌在糖尿病患者體內比例顯著減少[19-20],擬桿菌屬豐度則與T2DM無明顯相關性。阿克曼菌屬(Akkermansia)作為一種新發現的對宿主代謝有益的共生菌群成員,其豐度與T2DM呈顯著負相關,也因此被作為糖尿病患者腸道標志菌[21-22]。小鼠腸道菌群失調,如疣微菌在門、綱、目等水平增加,擬桿菌在科、屬、種水平減少,普氏菌在科、屬水平減少會促進其T2DM的發展[23]。研究進一步發現,一些腸道菌群超出相對穩定的閾值范圍會增加血清LPS、連蛋白水平,使腸道屏障功能受損,促進T2DM的惡化[24-25],而在對T2DM小鼠進行糞菌移植后,其腸道屏障功能增強,血清LPS、LPS結合蛋白和促炎細胞因子水平均呈降低趨勢。
1.1.3 妊娠糖尿病
妊娠期孕婦生理變化明顯,是糖尿病易感人群,誘發妊娠糖尿病(gestational diabetes mellitus,GDM)內部原因是遺傳因素,其決定個體易感性,外部原因則是飲食不規律引起機體炎癥,GDM是一種異質性代謝紊亂疾病,患者容易發生高血壓和產后出血等隱患,對后代健康也會有一定影響[26]。糖尿病易致使腸道穩態發生較大變化,大多數患者GDM腸道菌群α多樣性降低,放線菌門(Actinobacteria)、變形菌門(Proteobacteria)豐度呈上升、擬桿菌門豐度普遍呈下降趨勢。水痘克雷伯菌、產堿桿菌屬(Alcaligenes)等豐度增加,而甲烷短桿菌(Methanobacilerium)、另枝菌屬(Alistipes)豐度相對降低[27-28]。其中條件致病菌產堿桿菌屬作為潛在的病原體可能會誘發肺炎、腹膜炎甚至結直腸癌等,不同時期GDM患者腸道菌群變化差異很大,但是仍能看出GDM的發生與一些菌群存在相關性。
1.1.4 其他類型糖尿病
某些糖尿病的癥狀介于T1D和T2DM之間且區別于兩者,包括莫迪型糖尿病(Mody diabetes,MODY2)、成人隱匿自身免疫性糖尿病(latent autoimmune diabetes in adults,LADA),以及胰腺外分泌疾病、矮妖綜合征A型胰島素抵抗、藥物引起的皮質激素異常、感染青少年一型、免疫介導性一型等糖尿病。研究發現,MODY2患者腸道內普雷沃菌豐度顯著升高,瘤胃球菌和擬桿菌豐度顯著降低[12]。LADA患者則嚴重缺乏SCFAs產生細菌,腸道微生物群結構與T1D患者更相似[29]。
1.2 微生物對糖尿病的調控作用
微生物群代謝產物及衍生物通過腸道上皮細胞進入機體,直接或間接影響炎癥調節、腸道通透性變化以及糖脂代謝而發揮重要調控作用,調控路徑匯總如圖1所示。腸道通透性決定了某些菌群代謝產物通過特定分子通道而被吸收。例如,腸道菌群代謝的SCFAs等刺激小腸L細胞釋放胰高血糖素樣肽-1(glucagon-like peptide-1,GLP-1)和肽YY,影響胰島素合成、飽腹感和脂肪組織的活躍程度。同樣,黑皮質素樣肽通過黑皮質素-1受體發揮作用,抑制細胞因子釋放以響應促炎刺激反應[30-32]。三甲胺、LPS、咪唑丙酸、吲哚等促進促炎細胞因子、趨化因子釋放,引發炎癥。脂肪細胞是脂肪酸代謝和內分泌器官,非酯化脂肪酸釋放的增加抑制了骨骼肌中胰島素刺激的葡萄糖代謝,從而引發胰島素敏感性以及T2DM[33-34]。
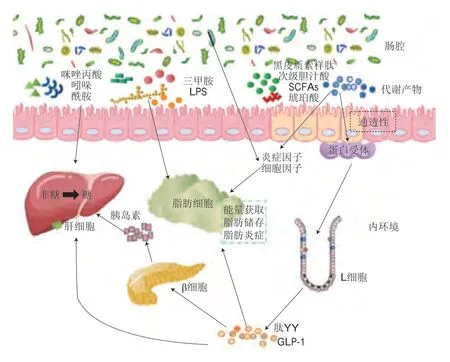
圖1 微生物菌群參與T2DM調控的路徑Fig.1 Pathways by which the intestinal microbiota is involved in diabetes mellitus type 2 (T2DM) regulation
1.2.1 參與脂肪代謝
腸道微生物參與機體的脂肪代謝過程,結腸中微生物可將未完全消化的碳水化合物轉變為S C FA s。S C FA s 中丁酸的益菌效應尤為突出,產丁酸菌主要包括梭菌科(Clostridiaceae)、消化鏈球菌科(Peptostreptococcaceae)、巴氏桿菌科(Pasteurellaceae)等[35]。普雷沃菌、雙歧桿菌、糞桿菌屬、羅斯氏菌屬等[36]也可以增加腸道中SCFAs水平。SCFAs可以通過激活G蛋白偶聯受體(G protein-coupled receptor,GPR)43和GPR109A[37],降低炎癥水平[38]并作為脂質和葡萄糖的合成原料[39]而達到預防和穩定糖尿病的目的[40]。空氣污染及不良飲食對機體健康造成的不利影響體現在腸道菌群失穩,產黑普氏菌(Prevotella melaninogenica)等產生的LPS可抑制小鼠微粒體甘油三酯轉移蛋白的表達[41],使脂代謝異常及SCFAs含量降低,同時腸道益生菌的減少也會影響機體對脂類的代謝,如介導炎癥因子、脂肪因子和IgA免疫應答發生變化,誘導肥胖、胰島素抵抗和糖尿病的發生[42-44]。膳食對腸道菌群結構產生一定影響,而腸道菌群變化也影響宿主對食物及能量的攝取,乳桿菌屬、雙歧桿菌屬、鏈球菌屬等益生菌可顯著降低糖尿病患者的空腹血糖、甘油三酯及胰島素水平[45-46]。此外,阿克曼菌屬可增加脂肪組織中2-油酰基甘油、2-棕櫚酰甘油、2-酰基甘油的水平,從而促進脂肪酸氧化和脂肪細胞分化[47]。多種益生菌尤其是產丁酸菌會參與脂肪代謝過程,而通過膳食增加產丁酸菌數量可有效改善腸道微生態紊亂,調控炎癥,緩解糖尿病。
1.2.2 調控炎癥因子
糖尿病可誘發機體促炎細胞因子、趨化因子和炎癥蛋白水平升高。LPS可促進抗炎細胞因子和趨化因子表達引起代謝性內毒素血癥和低級別炎癥,腸道菌群衍生物琥珀酸也可促進解偶聯蛋白1表達,增加脂肪能量消耗[48-49];腸黏膜發生炎癥和腸屏障損傷時,菌群產生的內毒素、細菌成分和代謝物易位進入循環系統,削弱肝臟清除力,促進代謝炎癥發生[50];白細胞介素(interleukin,IL)-22是能恢復胰島素敏感性和緩解糖尿病的抗炎細胞因子,研究證實T1D模型小鼠中腸黏膜受損,腸道屏障功能改變,誘導IL-22表達的分節絲狀菌豐度減少,使IL-22表達顯著降低[51-52]。目前的研究證明,腸道益生菌群的攝入可以降低人體炎癥,如羅氏菌屬(Roseburia)、擬桿菌、阿克曼菌以及乳酸菌屬(Lactobacillus)等微生物誘導IL-10過度表達并抑制腫瘤壞死因子α表達從而降低胰島素抵抗[53-55]。同樣,多種乳酸菌可降低IL-1β、單核細胞趨化蛋白-1、細胞間黏附分子-1、IL-8、CD36蛋白和C反應蛋白等炎癥蛋白水平表達[56-57]。羅氏菌屬和普拉梭菌均為產丁酸菌,通過抑制核因子κB的活性而降低炎癥[58-59]。干酪乳桿菌(Lactobacillus casei)會降低促炎細胞因子II型干擾素的產生[60]。由此表明,腸道菌群的調節可從抵抗炎癥、維持腸道菌群穩態以及恢復腸黏膜功能方面顯著改善糖尿病。
1.2.3 改變腸道通透性
腸道屏障通透性增加是T2DM的一個特征,腸道通透性增加導致腸道微生物代謝物易位進入血液容易引起代謝性內毒素血癥[61]。糖尿病患者腸黏膜屏障功能破壞以及血糖升高導致胞間連接完整性降低,使腸道上皮細胞滲透性增加,影響抗原的吸收,最終誘發全身病理性免疫反應[62-63]。以往研究證明了腸道微生物對腸道通透性的重要作用,擬桿菌屬可上調結腸中緊密連接蛋白基因的表達,降低腸道通透性,從而減少LPS的產生,改善內毒素血癥[64]。阿克曼菌可通過激活上皮中的腺苷酸活化蛋白激酶改善腸道緊密連接,該菌的外膜蛋白Amuc-1100可增強緊密連接蛋白的表達,還能抑制腸道中的大麻素1型受體表達,降低腸道通透性和全身LPS水平[65]。由普拉梭菌和羅氏菌屬產生的丁酸鹽可以通過血清素轉運體降低腸道通透性。腸道微生物作為生物屏障的重要部分,可阻止糖尿病的惡化和并發癥的產生。
1.2.4 影響腸促胰素效應
糖尿病患者腸促胰素效應受損,進餐后GLP-1濃度的升高幅度減小。作為機體代謝的關鍵調節因子,GLP-1可刺激胰島素分泌[66],提高心率、保護心臟、降低中風風險,還可作用于大腦以抑制進食和保護神經[67],GLP-1受體激動劑可治療T2DM和肥胖,Tirzepatide是一種包括GLP-1受體的雙重激動劑,可顯著降低糖化血紅蛋白、空腹血糖濃度及體質量,并提升糖化血紅蛋白達標率,且安全性良好[68]。腸道是GLP-1的主要分泌器官,胰島和胃也可通過分泌GLP-1發揮調控血糖的作用[69],但遠端腸道是調控GLP-1分泌的關鍵位點。碳水化合物、脂肪和蛋白質的攝入可刺激小腸L細胞分泌GLP-1,抑制胰高血糖素分泌、胃排空和食欲,增加飽腹感和參與心血管活動等[70]。除此之外,腸道菌群的代謝產物可影響GLP-1的產生,阿克曼菌產生的P9蛋白通過與細胞間黏附分子2結合而誘導GLP-1的分泌,從而改善小鼠的糖穩態及肥胖[71]。該菌還可通過降低β-鵝脫氧膽酸、促進胰島素分泌和糖原合成從而抑制糖異生作用[72]。
1.3 基于腸道微生態介導的糖尿病治療方法
迄今為止糖尿病仍無法根治,現有的主要治療方法為飲食調整、加強運動、口服藥物以及注射胰島素。而一些關于利用益生菌干預(口服益生菌制劑及糞菌移植術)對糖尿病治療的臨床試驗及動物實驗研究都證明了基于微生態治療糖尿病具有良好的效果。
1.3.1 糖尿病傳統治療方法
糖尿病傳統治療方法主要為藥物治療,二甲雙胍具有明顯的降糖效果,是治療T2DM的重要藥物,可顯著降低糖尿病患者體質量和低密度脂蛋白膽固醇[73]。近年來,研究還發現其具有抗腫瘤等其他功效。此外,還有一些具有控糖或減少糖攝入的藥物,如羅格列酮和阿卡波糖[74]、胰島素注射類的諾和靈3R(筆芯)[75]等。這些藥物可使糖尿病患者血糖水平恢復正常,并有效縮短尿糖達標時間,但攝入藥物過多會引起皮質激素異常等新問題[76]。目前一些具有改善葡萄糖穩態等糖尿病癥狀的中草藥成分被發現,如黃連素可抑制NOD樣受體熱蛋白結構域相關蛋白3的活化并減少促炎因子釋放、降低胰島素抵抗,姜黃素可維持腸道屏障功能,人參皂苷對改善膽堿能及抗氧化系統并降低血糖也具有積極作用[77-78]。與西藥相比,中草藥成分對人體的副作用相對較小,但是見效相對較慢且需要多重成分共同作用。此外,更多研究顯示中藥成分發揮作用與腸道菌群存在重要關聯。
1.3.2 基于微生態治療糖尿病方法
健康機體中各項成分均保持著動態平衡,人體內環境動態平衡的變化表現為疾病的發生發展,腸道菌群的動態變化對應機體系統組件的改變,因此通過腸道菌群預測、預防和調控疾病成為未來醫學研究領域的新趨勢。分析腸道菌群的高維分子數據(如轉錄組、表觀基因組、糖組、微生物組)可以對發病系統組織成分進行描述和監測[79]。相比傳統的按照直線因果關系原則治療,用系統論的原理和方法解決醫學問題效果更為有效。研究發現,與定期服用降血糖藥物常規治療方法相比,規范化治療對糖尿病患者的療效更顯著[80]。人為的菌群干預,如糞菌移植、服用益生菌制劑或者使用益生元介導腸道菌群逐漸成為調控糖尿病的新方式。
糞菌移植是一種將健康人體糞便中的功能菌群移植到患者胃腸道內,實現腸道疾病治療的新技術。將健康小鼠的腸道菌群轉移到T2DM小鼠可以顯著提高糖尿病小鼠的腸道菌群多樣性以及降低受體小鼠的胰島素敏感性[81],糞菌移植改變了糖尿病小鼠的腸道菌群結構,并改善糖脂代謝、增加胰島面積和β細胞比例。目前,糞菌移植技術以其標準化、人性化特點在相關領域得到廣泛的運用。糞菌移植可顯著促進T2DM患者菌群的定植,且糞菌移植結合生活方式干預還可減少總膽固醇及低密度脂蛋白膽固醇水平,降低肝臟硬度[82-83],多酚結合糞菌移植也可產生降血脂作用,黃連中提取的植物生物堿小檗堿協同益生菌可以提高肝臟低密度脂蛋白攝取和脂肪褐變[84]。
補充益生菌、益生元或合生制劑或可改善糖尿病患者的腸道菌群失調、促進胰島素分泌、減少胰島素抵抗從而調控糖尿病進程[85-86]。雙歧桿菌可通過與膽固醇結合、阻斷宿主腸道吸收或改變宿主膽汁酸信號轉導改善血脂異常,實現T2DM風險控制[87]。菊粉可通過改善T1D小鼠腸道菌群組成變化而恢復胰腺正常功能,并顯著提高胰島素敏感性,恢復機體本身對血糖的控制并減少食物和水分攝入[88]。磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,AKT)-哺乳動物雷帕霉素靶蛋白信號通路是經典的胰島素信號響應通路[89]。有研究發現,紫蘇油可通過PI3K/AKT信號通路調控T2DM小鼠腸道菌群,恢復腸道菌群多樣性并緩解胰島素抵抗[90],藥食同源性的紫蘇油可能是一種潛在的治療糖尿病的功能性食品。
2 飲食通過腸道微生物介導調控糖尿病
現代醫學及營養學逐漸發現并驗證了通過改善腸道菌群、靶向菌群調節、精準營養等手段可有效對抗糖尿病。科學的個性化飲食可預防及糾正腸道炎癥引發的機體糖代謝紊亂、免疫力下降、長期高血糖狀態、胰島素抵抗等癥狀(圖2)。

圖2 飲食通過腸道菌群干預糖尿病Fig.2 Diet affects diabetes by regulating the intestinal microbiota
2.1 科學配伍飲食對糖尿病預防與調控
科學配伍飲食可以維持腸道微生物穩態、建立良好的腸道環境以及加固腸道屏障,利用機體自身保護機制降低糖尿病發生幾率和發展。植物膳食中含有豐富的天然功能性化合物及膳食纖維,有利于促進腸道益生菌群的定植并發揮其功效,影響菌群結構并提高SCFAs含量從而驅動機體的免疫代謝。合理的進食時間也可通過腸道微生態的改變發揮預防和改善T2DM血糖調控的作用[91-92]。
2.1.1 素食飲食和地中海飲食
以往素食飲食作為宗教傳統以及可緩解肥胖、改善代謝被大眾所接受和認知。其中植物性食物成分如VC、類胡蘿卜素及其復合生物標志物可以降低血糖和尿糖排泄量、血漿總膽固醇、甘油三酯和極低密度脂蛋白膽固醇濃度等[93-94],且攝入量與T2DM發病率呈負相關[95-96],可見素食飲食可以降低疾病風險,是對糖尿病患者適用性較高的一種飲食模式。研究發現,素食飲食對腸道微生物的作用效果同樣明顯。植物性食物中多酚、多糖、聚糖等成分具有腸道益生作用。多酚包括黃酮和酚酸,黃酮類化合物具有廣泛的生物學作用,如調節酶活性、抑制細胞增殖、抗氧化和抗炎特性。素食飲食干預顯著改變腸道菌群的組成,增加碳水化合物降解菌,如雙歧桿菌屬、乳桿菌屬[97],改變SCFAs水平[98]。目前研究較多的DASH(dietary approaches to stop hypertension)飲食和地中海飲食均屬于半素食飲食,DASH飲食可顯著降低代謝綜合征患者收縮壓、降壓藥需求及身體質量指數,并改變腸道菌群組成及功能,如影響SCFAs產生等。大量研究結果顯示,長期堅持DASH飲食對降低炎癥高血壓[99]、糖尿病的降壓[100]、降糖[101]效果明顯。研究發現,地中海飲食干預可顯著改善患者的血糖、胰島素水平及胰島素抵抗,并誘導毛螺菌科及瘤胃球菌科的富集,通過影響膽汁酸代謝而調控胰島素水平[102-103],同時具有調節新陳代謝、降低體質量、提高運動能力的效果[104]。研究表明,地中海飲食的老年人步行速度更快、膝關節肌肉力量更大、整體認知水平更高以及記憶力更好,且與低脂飲食相比,地中海飲食老年人的頸動脈內膜中層厚度和頸動脈斑塊高度降低更多[105-106],說明地中海飲食改善動脈粥樣硬化效果更明顯。因此對于糖尿病患者,運動結合地中海飲食是相對較好的選擇。
與治療糖尿病常采用的生酮飲食相比,素食飲食的可持續性更好[107],生酮飲食干預使患者缺乏纖維、VC、葉酸及鎂等多種營養元素。因此生酮飲食方法不利于心腦血管疾病患者。
2.1.2 發酵食物或益生菌干預
近年來益生菌產業爆炸式發展,且很多發酵類食品產業也呈快速增長趨勢。以往諸多研究已證實,某些益生菌可顯著降低患者的糖化血紅蛋白、空腹血糖和空腹胰島素的水平以及胰島素抵抗指數,且多菌株和高劑量的益生菌補充劑對血糖穩態更有益[108]。而GDM患者補充含有嗜酸乳桿菌、干酪乳桿菌、兩歧雙歧桿菌、發酵乳桿菌的益生菌產品可改善其過氧化物酶體增殖物激活受體γ、轉化生長因子β和血管內皮生長因子的表達,以及血糖控制、血脂狀態、炎癥標志物和氧化應激[109]。研究表明,T2DM患者服用含有菊粉和產丁酸細菌拜氏梭菌(Clostridium beijerinckii)、丁酸梭菌(Clostridium butyricum)、厭氧丁酸菌(Anaerobutyricum hallii),復雜低聚糖降解細菌阿克曼菌、嬰兒雙歧桿菌的益生菌制劑可顯著降低患者的餐后血糖、糖化血紅蛋白及血糖增量,且安全性及耐受性良好[110]。另一項研究結果表明,含乳桿菌屬、雙歧桿菌屬及鏈球菌屬活菌株的益生菌補充劑可使T2DM患者的空腹血糖水平顯著下降,高密度脂蛋白膽固醇水平顯著上升[111]。對前驅糖尿病成年患者分別補充包含凍干的乳桿菌屬及雙歧桿菌屬菌株的多菌種益生菌、基于菊粉的合生制劑,發現其可顯著改善糖代謝相關參數,穩定血糖穩態。進一步研究發現,益生菌還可改善高密度脂蛋白膽固醇水平,但療效存在一定的個體差異[112]。目前文獻中關于益生菌的種類、劑量以及功效等級不一而同,但是基本認為乳酸菌和雙歧桿菌是用于降低臨床前和人群試驗的空腹血糖和胰島素水平最廣泛應用的益生菌[113]。
2.1.3 間歇性禁食
除飲食結構和成分對糖尿病具有一定調節功效外,近期的研究發現禁食也可通過能量與糖分限制調控腸道微生態而改善機體代謝。間歇性禁食可引起細菌比例適應性變化,從而完成細胞和組織器官在進食和禁食期間的源物質在葡萄糖和脂肪酸/酮體間轉換。常見的間歇性禁食模式有隔日禁食和限時進食。限時進食是通過調節晝夜節律系統影響體質量控制和生化參數,并通過影響瘦素分泌改善飽腹感調控系統;而隔日禁食在促進體質量控制激素調節的同時,還需要在禁食日減少能量攝入。二者均可顯著減輕體質量、改善代謝并調節腸道菌群,通過改變厚壁菌門/擬桿菌門比例和增加有益菌屬(如乳桿菌屬和阿克曼菌)豐度而抑制體質量增長[114]。間歇性禁食是一種相對接受度更高的飲食干預措施,可實質性重塑腸道微生物組,產丁酸的毛螺菌科豐度明顯上調[115]。改變能量攝入的時間對成人T2DM肥胖患者不僅具有降低體質量、血糖,改善胰島素抵抗等作用,改善心血管方面的問題,如顯著降低甘油三脂、總膽固醇、低密度脂蛋白含量[116-117]。目前又發現一種新型的間歇性禁食方法,即早限時進食(只在8:00—16:00期間進食),結果顯示,與對照進食相比,早限時進食可改善全身胰島素敏感性并增加餐后骨骼肌對葡萄糖和支鏈氨基酸營養素的攝取[118]。
2.2 不健康飲食影響腸道微生物誘發糖尿病
目前,西方飲食、快餐飲食(外賣)等不健康的飲食方式通過介導腸道微生物結構改變成為糖尿病發病的高風險誘因。高動物脂肪和蛋白質及低植物纖維飲食誘導宿主蛋白酶發生蛋白水解,生成含硫氨基酸和芳香族氨基酸,這些氨基酸與代謝性疾病有關的異常菌群發生硫酸鹽還原反應、脫氨基反應、脫羧反應等多種復雜反應,生成硫化氫、氨、胺、氫氣、二氧化碳、甲烷、有機酸、苯乙酸、對甲酚、苯丙酸、吲哚丙酸、LPS等代謝物,使腸上皮細胞黏液分泌減少,乙醛及腸腔內pH值增加,支鏈脂肪酸和TMAO等有害物質增加,引起血糖上升、胰島素分泌下降。西式飲食使機體有益細菌(如約氏乳桿菌和格氏乳桿菌)減少和致病菌(如Romboutsia ilealis)增多,增加疾病風險。補充這兩種乳桿菌可提高血液中還原型谷胱甘肽水平,改善肝臟的線粒體形態和功能,減少肝臟脂質、改善系統性糖代謝[119]。動物實驗研究顯示,某些腸道菌發酵膳食纖維產生的SCFAs(尤其是乙酸鹽)使鼠檸檬酸桿菌的初期定植受到抑制,而鼠檸檬酸桿菌滯留感染促進了小鼠腸道低度炎癥和胰島素抵抗[120]。高脂飲食會引起小鼠腸道黏膜炎癥,并導致上皮細胞線粒體活性下降,從而造成呼吸鏈電子受體(氧氣和硝酸鹽)的增加[121]。
現有研究已證實,飲食成分越單一,糖尿病患病概率越高,超加工食物的攝入會增加25%的T2DM患病風險[122]。肥胖者體內脂肪越多,其胰島素抵抗和糖代謝異常更明顯,T2DM風險越大。高脂肪食物的攝入會改變菌群結構,富含植物多糖的飲食與普雷沃氏菌的主導腸型相關,而高脂高糖飲食與擬桿菌屬的主導腸型相關[123]。微生物群改變還會增加對食物過敏的易感性,有研究對小鼠進行12 周的高脂飲食喂飼誘導小鼠肥胖,證明過敏反應與腸道效應細胞反應失調、腸道通透性增加和腸道生態失調有關[124-125],腸乳酸桿菌的豐度與大鼠脂肪質量和體質量呈負相關,高脂飲食使腸乳酸桿菌大幅減少、致病菌豐度增加,其代謝產物導致內毒素血癥發生并誘導產生炎癥[126-128]。
食物的攝入種類、攝入量、攝入方式、攝入時間等均會引起機體包括腸道菌群穩態發生變化,不健康的生活方式(熬夜、吸煙、飲酒等)、精神狀態(焦慮、抑郁等)及不良飲食(高脂、高糖、高鹽、低膳食纖維、少新鮮綠葉蔬菜等)是糖尿病產生的主因。
3 結 語
以系統醫學為代表的現代醫學及營養學秉承了中國傳統醫學“食為藥”的理念,將天然食物(或藥食同源食材)作為預防及治療疾病的一種特殊個性化方式,正逐漸被醫護工作者和普通大眾所認知和接受。可根據糖尿病患者的腸道微生態和健康人群之間的顯著差異及早對糖尿病進行篩查,進而根據個體自身特點(菌群特征、遺傳基因等),科學地、因人而異地制定健康飲食模式(如DASH飲食、間歇性飲食、地中海飲食和益生菌飲食),并且保持規律的生活方式更利于提高機體自愈能力,抵抗糖尿病風險,而采用糞菌移植或服用益生菌及益生元制劑可更為快速地調節腸道微生態,減少胰島素抵抗并有效預防糖尿病并發癥的發生。

