潰瘍性結腸炎患者臨床特征及腸道菌群變化分析
周淑萍 盛曉曼 蔣燦燦
潰瘍性結腸炎(ulcerative colitis,UC)屬于多因素起源的慢性腸道炎癥,病變可浸潤至黏膜層和黏膜下層,可由遠向近侵及整個結腸[1,2]。UC在發達國家的發病率居高不下,在發展中國家也不斷攀升,UC發病率較克羅恩病高出很多[3,4]。UC病程從無癥狀、輕度到廣泛結腸病變不等,有20%~30%的UC患者可出現侵襲性病程,其中10年內累積復發風險為70%~80%,近半數的患者需住院治療[5]。因此,早期分層和早期識別有疾病進展和(或)重癥風險的患者是潰瘍性結腸炎治療的關鍵。盡管UC的發病機制目前尚不明確,當前被廣泛接受的病因學框架涉及遺傳易感性、微生物與環境生態失調和免疫反應異常等,人們普遍認為腸道微生物生態失衡與UC的發病機制存在密切聯系,而腸道微生物群被認為是反映UC自然史的“指紋”,因為其與UC臨床嚴重程度、緩解和突發反應等有關[6,7]。來自UC患者的腸道菌群通常以兼性厭氧菌的相對豐度增加,以及專性厭氧菌的消耗為特征[8]。短鏈脂肪酸(short-chain fatty acids,SCFA)是厭氧菌對復雜且難消耗糖鏈進行生化分解的最終產物,若產生SCFA的保護性細菌數量減少,可使黏膜通透性增加,相反,某些細菌濃度升高會增加有毒代謝物的產生,例如,H2S會增加黏膜通透性并阻斷丁酸鹽代謝[9]。丁酸鹽是SCFA的一種,除了改善上皮和黏膜屏障功能以外,還可為結腸細胞的生長增殖提供能量[10]。微生態學缺陷以及相關的代謝途徑和分子機制在UC腸黏膜的先天免疫中起著關鍵作用,鑒于世界范圍內UC患病率的不斷增加,以及失調性腸道微生物與UC關系的研究熱度較高,本文聚焦于UC發病的宿主易感因素,觀察UC患者腸道菌群的特征性變化,以期為UC臨床靶點的尋找提供依據。
1 資料與方法
1.1 一般資料 選取2018年4月至2021年12月就診淮南市第一人民醫院消化內科的UC患者50例為UC組,男24例,女26例;平均年齡(49.84±14.19)歲;經結腸鏡檢查及病理組織學確認,均符合2018年《中國炎癥性腸病診斷與治療的共識意見》的診斷標準[11]。對照組為同時期就診的30例健康者,男14例,女16例;平均年齡(48.90±11.27)歲;經檢查均無消化道疾病。取樣前4周所有納入人員均未給予抗生素等藥物干預。
1.2 樣本采集 留取上述納入人員新鮮糞便6 g,凍存于-80℃冷凍庫中。同時收集納入人員的基本情況(包括病程、年齡、性別、既往史等)及臨床特征等。
1.3 方法
1.3.1 DNA提取:按說明書操作提取樣品的DNA,通過紫外微量分光光度計及凝膠電泳檢測對DNA濃度進行定量,隨后評價DNA完整性(Agilent 2100),質控合格的DNA納入文庫構建。
1.3.2 文庫構建:以不同樣本DNA為模板,選擇16S rRNA基因V3-V4可變區進行擴增,并加上測序儀所需的接頭、測序引物和index序列,構建文庫。
1.3.3 16S rRNA測序:使用高通量測序平臺進行測序。
1.3.4 生物信息學分析:對測序結果予以質控及過濾得到新的優化后序列,繼而采用CD-HIT軟件進行聚類分析,并對這些優化序列進行可操作分類單位(operational taxonomic units,OTUs)分析。并通過宏基因組分析手段對不同樣本間的菌群進行差異性分析。
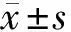
2 結果
2.1 UC患者臨床主要特征表現 50例UC患者慢性復發型40例(80%),發病時處于活動期42例(84%),且重度較多(19例),多累及全部結腸(25例)。見表1。

表1 入組患者的疾病特征
2.2 病變范圍與疾病嚴重程度的關系 不同病灶位置與疾病的嚴重程度存在相關性(P<0.05),即UC波及范圍越廣,其病情越重。見表2。

表2 病灶范圍與疾病嚴重程度的關系 例
2.3 腸道菌群構成 使用16S rRNA測序技術對UC組和對照組的腸道微生物群的構成進行了分析,2組樣本共檢出11個門。2組樣本均以擬桿菌門、厚壁菌門、變形菌門和放線菌門為優勢菌門,但菌群的比例結構存在明顯差異,相較于正常對照組,UC患者腸道菌群構成的多樣性顯著減少,且UC組變形菌門的相對豐度明顯更高(P<0.01)。見表3,圖1。

圖1 門水平上2組豐度比較

表3 UC患者組和健康對照組腸道菌群門水平物種相對豐度比較 %,中位數(范圍)
2.4 重度UC的腸道菌群變化 研究對比UC組和對照組中腸道微生物群的分布情況發現,在屬水平上,與Hespellia菌屬、Faecalibacterium(普拉梭菌)、Enterococcus(腸球菌)、Atopobium(奇異菌屬)、Streptophyta(鏈形植物)相比,UC組大腸桿菌的比例升高最明顯(P=0.028)。見表4。

表4 UC患者組和健康對照組腸道菌群的特征菌屬比較 %,中位數(范圍)
3 討論
UC作為一種炎癥性腸道疾病,其臨床表現多為復發與緩解交替出現,且以易反復、診療困難等為特點。長期以來,UC的發病率持續走高,對全球數百萬人的正常生活造成困擾。臨床資料分析顯示,有4/5的UC患者處于慢性復發型,且絕大多數是活動期(占比84%),同時,本研究還發現,病變范圍未超過左半結腸的多為輕度UC,而超出左半結腸的以重度為主,即病變范圍與疾病的嚴重度密切相關。
目前的研究報告了UC患者腸道微生物群平衡的變化,這是微生物菌群在UC發病機制中可能起作用的基礎。盡管尚不清楚生態失調是腸道炎癥的病因還是結局,但許多研究表明,腸道微生物群是宿主免疫系統、腸道相關淋巴組織的關鍵元素[12]。在健康條件下,寄居于腸道的微生物數量約是人體細胞數的10倍[13]。腸道微生物群主要定植于胃腸道,特別是在結腸中,后者可為其提供生長所需的氧和營養[14]。盡管腸道微生物群的組成存在相當大的個體差異,但在較高的分類水平下,不同個體間微生物群是相似的。放線菌門、擬桿菌門、厚壁菌門、變形桿菌門是腸道微生物的四個主要門,其中擬桿菌門和厚壁菌門占比九成以上[15]。
眾所周知,腸道菌群不但可以維持胃腸道正常生理功能,還是阻止其他胃腸道病原體入侵的屏障。腸道微生物的穩態是維護腸道正常功能的關鍵,而微生物群的生態失調可能是某些疾病的促成因素。腸道黏膜的完整性取決于它與腸道微生物群間的相互平衡,若兩者間出現不平衡狀態,勢必會影響腸道防御功能及免疫調節功能。在本研究中,我們發現相較于對照組,UC組中微生物群的多樣性明顯減少,且以厚壁菌門表達顯著降低為主,這與其他研究者的結論相同[16-18]。此外,在許多腸道微生物組研究以及我們的分析中,已經觀察到健康受試者以及UC患者中腸道菌群顯示出巨大的個體差異,進一步驗證表明,UC患者腸道中變形菌門所占比例明顯增加,且以大腸桿菌的增加為主,這與健康參與者的構成比例顯著不同,該結果與Forbes等[19]的結論相似。有研究表明,大腸桿菌與炎癥相關,因其可產生大量過氧化氫,這反過來又導致厭氧菌數量的減少,并且可以刺激免疫細胞釋放促炎因子[20]。UC患者和對照組之間的物種差異性在我們的研究中也通過分析得到證實,該分析表明2組樣本中不同微生物門、屬間存在很大的差異性。UC和健康隊列之間的差異性可能是由于疾病引起的腸道微生物群環境的變化而引起的。
研究發現UC患者與健康者的腸道菌群存在著明確的菌群結構失調以及菌群結構改變,但作為初步探索性研究,仍存在一定的缺陷性。首先,盡管16S rRNA分析提供了腸道中存在的微生物分類組成,但其未對微生物群在UC中發揮的作用作出分析。其次,未明確區分不同時期UC患者腸道微生物群落的差異,難以為后期治療提供依據。最后,可能需要更大的樣本量來證實我們的數據,且需進一步的研究來更好地表征腸道微生物群的代謝產物在UC患者中的作用。
本研究對UC的疾病特征進行了總結,并闡明腸道微生物群在UC發病機制中起到關鍵作用。健康的微生物群具有與宿主保持體內平衡狀態的能力,而腸道菌群穩態的恢復可有助于UC患者的轉歸。

