基于數據挖掘和實驗驗證探究大黃素治療膿毒癥相關急性腎損傷的作用機制
歐 賢,周金瑤,孫 饒,王亞萍,吳禎祥,趙凱奇,汪華學,2*
1蚌埠醫學院第一附屬醫院重癥醫學科;2蚌埠醫學院第一附屬醫院急危重癥研究所;3蚌埠醫學院,蚌埠 233000
膿毒癥是宿主對感染的反應失調導致的危及生命的器官功能障礙[1]。腎臟是膿毒癥最常見的受累器官之一,膿毒癥相關急性腎損傷(sepsis-associated acute kidney injury,SA-AKI)常常成為膿毒癥患者死亡的直接原因,具有極高的死亡率[2],給臨床醫生帶來了前所未有的挑戰。AKI遷延不愈,成為慢性腎病(chronic kidney disease,CKD)的潛在風險增加,存活患者往往不可避免地進展到終末期腎病(end stage renal disease,ESRD),嚴重威脅患者的生活質量和生命安全[3]。
遺憾的是,目前預防和治療SA-AKI的能力非常有限。積極的基于液體的治療可能并無可靠的循證醫學證據,甚至是有害的。使用血管活性藥物維持血壓,需要兼顧大循環和微循環,維持血壓目標的多少才有助于避免AKI的發生尚無定論。如果腎臟預防失敗則不得不采用腎替代(renal replacement therapy,RRT)治療,但RRT干預的最佳時機和方式并不明確[4]。如果SA-AKI患者存活,雖然大多數患者腎功能會恢復,但對腎臟修復或腎功能修復失敗的機制知之甚少,并且進展到CKD和ESRD的終身風險更高。迄今為止,尚無確切可靠的治療AKI的藥物,臨床常規的治療措施主要還是腎替代和對癥綜合治療,腎臟功能的修復依賴于機體整體可靠的支持下的腎臟本身。因此,探索能夠早期及時有效預防或治療SA-AKI的藥物或措施,避免慢性腎病的發生或促進腎臟修復,對于降低膿毒癥患者病死率和提高存活患者的生活質量,具有重要的臨床價值。
大黃素是一種自大黃、虎杖等中草藥中提取的天然化合物,具有抗炎、抗病毒、抗腫瘤等多種藥理作用。既往研究證實大黃素對膿毒癥患者具有保護作用;最近的研究顯示,大黃素對氧化應激、炎癥和細胞凋亡導致的損傷具有保護作用[5]。然而,尚不清楚大黃素能否改善SA-AKI患者的預后。本研究將通過生命科學相關數據庫探尋SA-AKI發病過程的關鍵基因,并分析關鍵基因所涉及的炎癥信號通路;繼之通過動物實驗探討大黃素是否影響SA-AKI的炎癥通路和對SA-AKI大鼠的保護作用及其機制,為其防治提供新思路。
1 材料與方法
1.1 數據庫分析
1.1.1 SA-AKI發病過程關鍵靶點篩選
利用GEO數據庫(www.ncbi.nlm.nih.gov)搜索SA-AKI相關數據集,其中GSE186822符合條件,包含3個盲腸結扎穿刺(cecal ligation and puncture,CLP)模型和2個正常模型鼠腎的原始測序數據,將原始數據利用R語言DESeq2包處理,條件設定logFC>1,P<0.05,篩選出SA-AKI發病過程中的關鍵基因。最后利用GeneToList(www.genetolist.com)將差異基因的ID與名稱進行比對,舍棄無法對應的基因ID。
1.1.2 潛在靶點的GO和KEGG 分析
基因本體論(gene ontology,GO)中生物過程數據庫(biological process,BP)、細胞成分數據庫(cellular component,CC)和分子功能數據庫(molecular function,MF)分別描述了基因產物涉及的生物過程、所處的細胞環境和可能的分子功能。基因和基因組(kyoto encylopaedia of genes and genomes,KEGG)路徑包括大多數已知的代謝途徑和一些已知的調控途徑。為了更進一步了解SA-AKI發病過程所涉及的生物學過程,進行了GO和KEGG富集分析。
1.1.3 PPI分析和核心網絡構建
STRING網站(cn.string-db.org)是一個在線蛋白質相互作用(protein-protein interaction,PPI)分析數據庫,它可以使用計算預測來補充現有的蛋白質與蛋白質相互作用的信息。將SA-AKI發病過程關鍵靶點生成PPI網絡,以鼠為研究對象,最小相互作用得分為0.4。利用Cytoscape3.8.2軟件將PPI結果導入,采用MCODE插件進行核心互作網絡分析并展示,同時將KEGG富集分析的炎性信號通路涉及的核心靶點構建信號通路與核心靶蛋白的互作網絡。
1.2 動物實驗驗證
1.2.1 藥物、主要試劑和儀器
大黃素(貨號為:E886074,純度 ≥ 96%,上海麥克林生化科技股份有限公司);羧甲基纖維素鈉和BSA封閉液(貨號為:C8620、A8020,Solarbio公司);蘇木素-伊紅染液(貨號為:KGA224,江蘇凱基生物技術股份有限公司);Scr、BUN和MDA(貨號為:C011-2-1、C013-2-1、A003-1-2,南京建成生物科技有限公司);IFN-γ、IL-17和TNF-α的ELISA檢測試劑盒(貨號為:YX-E21193、YX-E21019、YX-E21174,上海優選生物科技有限公司);一抗TNF-α、IL-17A、TRAF6、NF-κBp65、IκBα和p-IκBα(貨號為:AF7014、DF6127、AF5376、AF5006、AF5002、AF2002,Affinity公司);內參GAPDH(貨號為:AF2819,上海碧云天生物技術有限公司);HRP標記的山羊抗兔IgG和BCA蛋白定量試劑盒(貨號為:GB23303、G2026,武漢賽維爾生物科技有限公司);ECL化學發光試劑盒、SDS-PAGE凝膠配制試劑盒、上樣緩沖液和蛋白Marker(貨號為:SQ202、PG112、WJ103、LT101S,上海雅酶生物醫藥科技有限公司);電熱扶風干燥箱(貨號為:101AS-3,上海圣欣科學儀器有限公司);冰箱(貨號為:BCD-258A/C,海爾);生物熒光顯微鏡(貨號為:BX63,Olympus);天平(貨號為:E200,賽多利斯);酶標儀(貨號為:1681130,Bio-rad);TOUCH IMAGER接觸式化學發光成像儀(貨號為:E-BLOT XLi,E-Blot)。
1.2.2 動物模型、模型構建和分組方法
6~8周雄性SDF級Wistar大鼠(許可證號為:SCXK(魯)20190003,濟南朋悅實驗動物繁殖有限公司),體重200~220 g。所有操作流程按照蚌埠醫學院倫理委員會指定的實驗室動物使用和護理指南進行,同時符合國際實驗動物護理和使用指南建議(倫理審批號為:倫動科批字[2022]第403號)。將40只Wistar大鼠喂食普通飼料兩周后,隨機選取30只后按照隨機數表法分為3組:假手術組(Sham)、膿毒癥組(CLP)和藥物組(CLP+EMO),每組各10只。造模前大鼠禁食12 h,自由飲水。CLP模型利用水合氯醛(40 mg/kg)麻醉大鼠,然后取腹部正中切口2 cm,暴露盲腸,用18號針頭穿刺,少量盲腸內容物通過穿刺傷口擠出,關閉剖腹術切口,并給予無菌生理鹽水(24 mL/kg)進行液體復蘇。Sham組除未用18號針頭穿刺盲腸,其余步驟與CLP組相同。CLP+EMO組在造模前5 d內灌胃(35 mg/(kg·d))含大黃素的羧甲基纖維素鈉混懸液,另兩組大鼠給予相同劑量的0.5%羧甲基纖維素鈉混懸液進行灌胃,最后一次灌胃后2 h時制備CLP模型[6]。干預期間,觀察大鼠的一般情況,并記錄各組死亡數目。造模后24 h時處死大鼠,留取腎組織及血液標本。
1.2.3 腎組織病理學檢測
將大鼠腎組織浸泡于4%多聚甲醛溶液中,經過梯度乙醇脫水后用石蠟包埋并切片,常規HE染色,在光鏡下隨機選取3個視野進行病理性觀察并拍照。
1.2.4 腎功能和氧化指標測定
將經腹主動脈采集的血液經3 000 r/min離心10 min取上清液于-80 ℃保存備用。分別采用脲酶法和肌氨酸氧化酶法對各組血清肌酐(serum creatinine,Scr)和血尿素氮(blood urea nitrogen,BUN)進行檢測;硫代巴比妥酸法測定大鼠血清丙二醛(malondialdehyde,MDA)。
1.2.5 血清IFN-γ、IL-17、TNF-α濃度測定
采用雙抗體夾心ELISA測定-80 ℃保存的大鼠血清,嚴格按照試劑盒說明書進行實驗操作測量干擾素-γ(interferon gamma,IFN-γ)、白細胞介素-17(interleukin 17,IL-17)和腫瘤壞死因子-α(tumor necrosis factor,TNF-α)含量。
1.2.6 Western blot
利用細胞裂解液和蛋白酶抑制劑混合液提取腎組織蛋白,BCA法測定其樣品蛋白濃度。制備SDS-PAGE膠在120 V電壓下電泳60 min,然后轉移至PVDF膜后轉膜120 min,BSA室溫封閉2 h,TBST洗膜3次后加入稀釋的一抗:TNF-α、IL-17A、TRAF6、NF-κBp65、p-IκBα、IκBα和GAPDH在冰箱中4 ℃過夜,TBST洗膜3次后加入二抗稀釋液搖床孵育1 h,再次洗膜后加入顯影液后進行曝光。
1.3 統計學分析
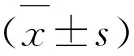
2 結果
2.1 關鍵靶基因篩選
利用R語言的DESeq2設定logFC>1,P<0.05篩選出2 814個SA-AKI發病過程中與健康對照組之間存在顯著差異的基因,經過GeneToList將ID與基因名稱對應共2 801個匹配成功,故舍棄13個基因,將匹配成功的基因繼續用于后續分析。圖中展示了差異基因的火山圖(見圖1)。

圖1 差異基因的火山圖 Fig.1 Volcano diagram of differential genes
2.2 GO和KEGG分析
將2 801個關鍵基因進行了GO和KEGG分析,并將富集排名前十結果進行展示。GO中BP主要富集于脈管系統發育的調節、血管調節、內皮發育、傷口愈合、上皮細胞增殖、創傷反應、細胞-基質黏附和小GTP酶介導的信號轉導等。CC則是富集于含膠原的細胞外基質、細胞頂端、膜筏、膜微區、基底外側質膜、膜區、頂質膜、基底膜、細胞皮質和肌動蛋白細胞骨架等。MF富集于核苷、嘌呤核苷、核糖核苷、GTP、鳥苷酸、鳥苷酸核糖核苷酸、細胞粘附分子和整合素的結合以及GTP酶活性等(見圖2)。KEGG則是富集于ECM-受體相互作用、IL-17信號通路、脂質和動脈粥樣硬化、MAPK信號通路、NF-κB信號通路、破骨細胞分化、PI3K-Akt信號通路、小細胞肺癌、TNF信號通路和弓形蟲病(見圖3)。

圖2 GO功能富集分析 Fig.2 GO functional enrichment analysis

圖3 KEGG通路分析Fig.3 KEGG pathway analysis
2.3 PPI分析和核心網絡構建
由于PPI互作網絡最多允許2 000個蛋白之間進行構建,因此將2 801個基因通過差異倍數絕對值大小篩選出前2 000個基因進行分析。結果含有1 850個節點數和15 591條邊。MOCDE篩選的核心互作網絡含有69個節點和1 190條邊,核心節點排名前十的基因為C-X-C基序趨化因子配體10(CXCL10)、腫瘤壞死因子(TNF)、白細胞介素1β(IL-1β)、白細胞介素6(IL-6)、C-C基序趨化因子配體2(CCL2)、信號轉導和轉錄激活因子3(STAT3)、JUN原癌基因(JUN)、前列腺素內過氧化物合成酶2(PTGS)、Toll樣受體2(TLR2)和整合素亞單位αM(ITGAM)(見圖4)。同時將5條炎性信號通路與所涉及的36個核心靶點構建互作網絡(見圖5)。

圖4 69個核心靶標的PPI互作網絡Fig.4 PPI interaction network of 69 core targets

圖5 炎性信號通路與核心靶標的互作網絡Fig.5 Interaction network between inflammatory signaling pathways and core targets
2.4 各組大鼠一般情況觀察和死亡率比較
Sham組灌藥期間死亡2只,手術后24 h未出現死亡,大鼠皮毛順滑,呼吸正常,行為良好。CLP組灌藥期間未死亡,造模24 h后死亡2只,大鼠皮毛順滑度較低,盲腸化膿性感染呈深黑色,反應較遲鈍,全身乏力。CLP+EMO組灌藥期間死亡1只,造模24 h后死亡2只,癥狀相對CLP組有所緩解,但出現腹瀉癥狀。Sham組、CLP組和CLP+EMO組6 d死亡率分別為20.00%、20.00%和30.00%,3組死亡率比較無統計學意義(P> 0.05)(見表1)。

表1 大鼠一般情況和死亡率Table 1 General condition and mortality of rats
2.5 腎組織病理學結果
通過HE染色法觀察到Sham組的腎小球結構清晰,大小無改變,腎小管無腫脹、水腫,未見空泡化改變,高倍鏡下無炎細胞浸潤;而CLP組則腎小球大小不一,有萎縮和分裂現象,腎小管擴張,空泡樣改變多見,高倍鏡下可見大量炎性細胞浸潤;CLP+EMO組相比于CLP組腎小球大小不一,有萎縮和分裂現象,腎小管擴張,空泡樣改變減少,高倍鏡下見炎性細胞浸潤減少(見圖6)。
2.6 大鼠血清腎功能和氧化應激指標
與Sham組相比,CLP組大鼠血清Scr和血漿BUN水平顯著升高(P<0.001),同時反映機體脂質過氧化的程度的MDA含量也顯著升高(P<0.001),與CLP組比較,CLP+EMO組中的Scr、BUN和MDA水平降低(P<0.01)(見表2)。
2.7 大鼠血清TNF-α、IL-17 和 IFN-γ 水平
與Sham組比較,CLP組大鼠血清中TNF-α、IL-17和IFN-γ表達均明顯增高(P<0.001),與CLP組比較,CLP+EMO組的TNF-α、IL-17和IFN-γ水平顯著降低(P<0.001)(見表3)。結果提示大黃素可能參與調節Th17/Treg信號軸減弱膿毒癥大鼠的炎癥反應。

表3 血清 TNF-α、IL-17 和 IFN-γ 水平比較Table 3 Comparison of serum TNF-α,IL-17 and IFN-γ
2.8 大黃素對IL-17/NF-κB和TNF/NF-κB信號通路相關蛋白的影響
對IL-17/NF-κB和TNF/NF-κB信號通路主要示意圖進行繪制(見圖7)。在大黃素對上述信號通路的作用中發現,與Sham組相比,CLP組腎組織中TNF-α、IL-17A、TRAF6、NF-κBp65蛋白表達及IκBα磷酸化水平升高(P<0.05),與CLP組比較,CLP+EMO組中上述蛋白均呈現不同水平的降低(P<0.05)(見圖8)。提示大黃素可能通過減少大鼠腎組織中IL-17A和TNF-α的表達減弱NF-κB信號通路的激活。

圖7 IL-17/NF-κB和TNF/NF-κB主要信號通路Fig.7 Main signaling pathways of IL-17/NF-κB and TNF/NF-κB

圖8 大黃素對 TNF-α、IL-17A、TRAF6和NF-κB信號通路蛋白的影響Fig.8 Effect of emodin on TNF-α,IL-17A,TRAF6,and NF-κB signaling pathway 注:與Sham組比較,#P<0.05,##P<0.01,####P<0.0001;與CLP組比較,*P<0.05,**P<0.01,****P<0.0001。Note:Compared with Sham group,#P<0.05,##P<0.01,####P<0.0001;Compared with CLP group,*P<0.05,**P<0.01,****P<0.0001.
3 討論與結論
研究顯示,導致SA-AKI的發病因素多且復雜,涉及炎癥、微循環功能障礙和代謝重編程之間的相互作用,其病理生理學涉及多種細胞類型的損傷和功能障礙。在膿毒癥發病過程中,細菌釋放內毒素或內毒素樣物質,致使機體中性粒細胞、單核巨噬細胞、血管內皮細胞等炎性細胞激活,釋放出大量的內源性炎癥介質進入血液循環中,一方面造成包括腎臟在內的多器官損害,另一方面又激活更多的炎性細胞參與發病,形成惡性的免疫網絡反應[7]。在脂多糖(lipopolysaccharide,LPS)誘導的SA-AKI的SD大鼠模型中,橙花叔醇通過抑制NF-κB和Toll樣受體4(toll like receptor 4,TLR4)信號通路減輕SA-AKI[8]。TLR4/NF-κB通路被證實參與腎臟炎癥應答的過程,抑制TLR4/NF-κB介導的炎性反應對LPS誘導的AKI具有保護作用。可見,炎性反應是SA-AKI發病的重要機制,抑制炎性反應通路是治療膿毒癥的一種重要的治療方案,為臨床上治療SA-AKI患者提供了新思路。
本研究借助于生物數據庫分析出包含了2 801個SA-AKI發病過程的關鍵靶點,對靶點KEGG分析結果表明共5條關鍵的炎癥反應信號通路,其中TNF信號通路與IL-17信號通路排名靠前,并且NF-κB信號通路作為兩者的樞紐共同參與SA-AKI發病進程。在TNF信號通路中,TNF-α不僅是上游激活NF-κB信號的關鍵,同時又作為NF-κB信號通路的下游響應分子,提示其通過正反饋促進NF-κB信號通路,且二者相輔相成。在IL-17信號通路中,IL-17家族中IL-17A是主要的啟動因子,Th17細胞是其主要分泌細胞。在CLP誘導的模型中發現IL-17A在腹腔中的高表達,且在嚴重膿毒癥后的炎癥反應中起關鍵作用,并且通過中和腹腔中的IL-17A則能夠減少促炎性細胞因子的產生[9]。同時有研究表明樹突狀細胞(dendritic cell,DC)中Toll樣受體9(toll like receptor 9,TLR9)介導γδT細胞產生的IL-17A可能在SA-AKI的發展中起關鍵作用[10];另有研究表明敲除IL-17A可預防SA-AKI[11]。上述表明TNF-α與IL-17A是膿毒癥的促炎因子,且TNF信號通路與IL-17信號通路廣泛參與膿毒癥的發生發展過程中,與數據分析結果相吻合。
而大黃素對膿毒癥的治療也已有較多研究,主要集中于腦、血液、心肌、腸道和肺組織。在膿毒癥相關性腦病(sepsis-associated encephalopathy,SAE),大黃素可以改善認知功能障礙和病理損傷,并且通過上調 BDNF/TrkB 信號抑制 CLP 誘導的小鼠炎癥反應[12]。在血液系統中,大黃素下調P-選擇素,改善膿毒癥后期的血小板數量和聚集能力,同時改善內源性凝血因子活性和纖維蛋白原功能,發揮抗炎作用[13]。在膿毒癥心肌病中,發現大黃素可以逆轉膿毒癥大鼠心功能不全并改善心肌狀況,這可能與其抑制炎癥小體的激活有關[14]。在膿毒癥誘導腸損傷中,大黃素可以改善腸道黏膜損傷,表現為炎癥因子和氧化應激標志物水平的降低,而其作用機制可能與VDR/Nrf2/HO-1通路有關[15];并通過提高緊密連接(tight junction,TJ)蛋白表達水平保護腸屏障完整性,抑制腸屏障通透性[6]。除改善腸道的炎癥反應和屏障功能外,大黃素還能阻止大腸埃希菌的位移,防止細菌的擴散轉移,減少細菌所引起的二次危害[16]。在膿毒癥相關急性肺損傷中,大黃素可抑制NF-kB和高遷移率族蛋白B1(high mobility group box 1,HMGB1)通路[17],從而減輕肺部氧化應激和炎癥反應。另一項關于肺部的研究是基于自噬通路所探討的,在大黃素的干預下可以有效的阻止急性肺損傷發病進程[18]。不僅如此,另有研究表明大黃素可通過調節水通道蛋白(aquaporin,AQP)、TJ、炎癥因子和肺細胞凋亡等途徑有效減輕膿毒癥急性肺損傷中的肺組織水腫[19]。大黃素對于SA-AKI的研究尚未報道,通過本研究發現CLP模型大鼠經過大黃素的治療后,ELISA結果顯示TNF-α、IL-17和IFN-γ表達降低,這與大黃素抑制膿毒癥炎癥反應結果相一致。
同樣的對大黃素影響Th17/Treg炎癥軸也已被闡述。在對急性胰腺炎的研究中發現,大黃素通過調節IFNγ/IL-17比例抑制嚴重急性胰腺炎免疫反應進而緩解腸屏障功能障礙[20]。而本研究發現在SA-AKI中,大黃素同樣可以減少IL-17A的表達,并且改善其炎癥反應。
綜上所述,本研究通過數據挖掘,確立了大黃素發病過程的2 801個關鍵基因,GO生物過程分析提示這些靶點的生物學功能主要涉及膜信號轉導、血管調節和傷口愈合。KEGG 通路富集分析顯示,TNF、IL-17、PI3K-Akt、NF-κB和MAPK信號通路是富集與炎癥相關的信號通路。實驗驗證大黃素治療SA-AKI腎功能好轉,且氧化應激水平(MDA)與炎性細胞因子(TNF-α、IL-17和IFN-γ)水平降低,IL-17A、TNF-α、TRAF6、NF-κBp65蛋白表達和IκBα磷酸化水平與CLP組相比明顯下降,這與數據分析結果相符。提示大黃素可改善大鼠SA-AKI,可能與IL-17/NF-κB和TNF/NF-κB信號通路有關。

