蒼術多糖與正丁醇部位對脾虛大鼠線粒體自噬的影響
徐慧穎,丁奕輝,董 昊,趙雪岑,柏 陽,才 謙
遼寧中醫藥大學藥學院,大連 116600
脾虛屬臟腑辯證中常見之證型,通常表現為消瘦、食欲不振、胃脘痛、脹氣、乏力、面色萎蔫、便溏等。脾虛表明機體處于低能量代謝狀態,尤其與胃腸功能障礙有關[1]。值得關注的是,線粒體是機體胃腸蠕動的重要能量來源,通過氧化磷酸化以ATP的形式產生能量,是“脾主運化”的重要環節[2]。氧化損傷、營養缺乏等外界刺激易導致線粒體損傷,對此,宿主細胞可啟動自噬機制清除損傷的線粒體,維持細胞內的環境穩態[3]。如自噬功能受損不能及時清除損傷的線粒體,可誘導細胞死亡。研究發現,脾虛動物骨骼肌、神經、肝臟、心肌等細胞中均發現線粒體自噬異常[4,5]。
蒼術Atractylodeslancea(Thunb.) DC為菊科多年生草本植物,具有燥濕健脾之功效。《中國藥典》規定其基源為菊科植物茅蒼術或北蒼術的根莖[6]。茅蒼術野生資源主要分布于湖北、安徽宣城、江西武寧和陜西漢中等地區,北蒼術野生資源主要分布東北、內蒙、河北等地區。傳統認為江蘇茅山地區的蒼術質量最好,為道地藥材。在泰國、日本等許多國家,蒼術也常用來治療消化系統疾病。現代藥理研究表明,蒼術可以調節大鼠血清中胃腸激素水平[7];蒼術提取物對胃癌細胞(bgc-823和sgc-7901)[8]與幽門螺桿菌的生長[9]均有抑制作用。蒼術含有多種類型的化學成分,分別為揮發油、多糖、苷類和低極性非揮發物質。課題組之前研究發現,蒼術多糖與正丁醇部位(苷類)對脾虛具有治療作用[10,11],本實驗是在此基礎上,首次從線粒體自噬的角度對蒼術有效部位調節脾虛的作用機制進行探究,旨在為蒼術的合理應用奠定基礎。
1 材料與方法
1.1 藥物與制備
生茅蒼術采自于湖北羅田中藥種植基地(非道地藥材),番瀉葉購自海王星辰藥店(生產批號:20210801),經遼寧中醫藥大學中藥鑒定教研組許亮教授鑒定分別為菊科植物茅蒼術Atractylodeslancea(Thunb.) DC.根莖、豆科植物狹葉番瀉CassiaangustifoliaVahl的干燥小葉。
1.1.1 麩炒蒼術正丁醇萃取物的制備
取麩炒茅蒼術(根據中國藥典記載方法炮制),粉碎后過60目篩。稱取一定量粉末加8倍量溫水浸泡1 h,80 ℃提取3 h,提取出揮發油,提取液過濾,濾液減壓濃縮作為水提液。藥渣加入8倍量70%的乙醇再次提取3 h,過濾,濾液減壓濃縮作為醇提液。合并上述水提液與醇提液,依次用二氯甲烷、正丁醇萃取3次,回收正丁醇溶劑得到麩炒蒼術正丁醇萃取物,收率為3.2%。
1.1.2 麩炒蒼術多糖的制備
將上述萃取后的剩余液加入4.2倍量的95%乙醇,靜置12 h,過濾得沉淀,沉淀冷凍干燥,得麩炒蒼術粗多糖,收率為20%。
1.1.3 藥液的配置
根據課題組前期研究結果,蒼術在0.945 mg/g劑量下對脾虛大鼠有治療作用,本次試驗選取0.945 mg/g劑量進行研究。結合收率將正丁醇萃取物加入0.5%羧甲基纖維素鈉配制成0.012 g/mL的藥液,折合生藥量0.378 g/mL。結合收率將多糖加入蒸餾水配制成0.075 6 g/mL的藥液,折合生藥量0.378 g/mL。
1.1.4 番瀉葉水煎液的制備
稱取適量番瀉葉,加10倍量水,大火燒開后再改小火煎煮30 min,過濾,濾液小火濃縮至含生藥0.125 g/mL的水煎液。
1.2 主要試劑及儀器
ATP檢測試劑盒(南京建成生物工程研究所,貨號:A095-1-1);BCA總蛋白定量測定試劑盒(南京建成生物工程研究所,貨號:A045-4-2);H2O2檢測試劑盒(上海Beyotime 生物公司,貨號:S0038);JC-1線粒體膜電位檢測試劑盒(上海 Beyotime 生物公司,貨號:C2006);cDNA反轉錄試劑盒(德國Thermo公司,貨號:#K1622);ECL化學發光檢測試劑盒(武漢百仟度生物科技有限公司,貨號:Ba1059);PINK1抗體(美國Affinity公司,貨號:DF7742);Parkin抗體(美國CST公司,貨號:2132s);p62抗體(美國CST公司,貨號:23214S);LC3B抗體(美國 Abcam公司,貨號:ab192890);β-actin抗體(美國Abcam公司,貨號:ab227387);山羊抗兔Ⅱ抗、山羊抗小鼠Ⅱ抗(美國 KPL公司,貨號分別為:074-1506、074-1806)。
HT7700型透射電子顯微鏡(日本hitachi公司);754紫外可見分光光度計(上海菁華科技儀器有限公司);SpectraMax Gemini XPS型熒光酶標儀(上海美谷分子儀器有限公司);熒光定量PCR儀(上海宏石醫療器械有限公司);TGL-16型冷凍離心機(湖南湘儀實驗室儀器開發有限公司);L4158型掃描儀(EPSON公司)。
1.3 實驗動物與分組
60只SPF級雄性SD大鼠,體質量(200±10)g,購于遼寧長生生物技術有限公司(合格證號:SCXK-遼-2021-0004)。室溫:20~23 ℃,相對濕度:45%~55%,適應性飼養1周后,復制脾虛動物模型。本研究方案通過遼寧中醫藥大學實驗動物倫理委員會審核(2019YS-DW-028-01)。
60只大鼠隨機分為空白組(control group,Con)、模型組(model group,Mod)、麩炒蒼術多糖組(FD)、麩炒蒼術正丁醇部位組(FZ)、生蒼術多糖組(SD)、生蒼術正丁醇部位組(SZ)。除空白組外,均采用飲食不節、疲勞過度加苦寒瀉下的復合因素法復制脾虛大鼠模型。方法如下:第1~14 d,單日灌胃豬油,劑量為:10 mL/(kg·d),給予飼料喂養;雙日游泳,游至耐力極限,并喂飼甘藍不給予飼料。第15~21 d,灌胃給予苦寒傷脾藥物番瀉葉的水煎液,劑量為:10 mL/(kg·d)。第22~28 d,FD、FZ、SD、SZ分別灌胃藥液劑量為:10 mL/(kg·d)。給藥期間,空白組和模型組給予相同體積的0.9% NaCl溶液。
1.4 檢測指標與方法
1.4.1 取材
末次給藥24 h后,各組大鼠采取吸入式麻醉并剖開腹腔,冰上剪取胃竇組織,放入預冷的生理鹽水中洗去血液,部分冰上切成約1 mm3小塊,迅速投入2.5%戊二醛4 ℃固定,用于線粒體超微結構觀察;部分分裝后-80 ℃凍存用于其他檢測。
1.4.2 線粒體超微結構觀察
取戊二醛中固定的胃竇組織,磷酸鹽緩沖液漂洗,1%的鋨酸再固定,之后進行乙醇、丙酮梯度脫水,經浸透、包埋、超薄切片(60~80 nm)、鈾鉛雙染色后,透射電鏡下觀察胃竇組織線粒體超微結構。
1.4.3 ATP水平測定
取凍存胃竇組織加入煮沸雙蒸水充分勻漿,沸水浴10 min后離心取上清液待測。按照BCA蛋白測定試劑盒說明書要求,取待測樣品置于96孔板,加入BCA工作液,37 ℃孵育30 min后,使用酶標儀測定A562 nm,根據標準曲線計算各樣品的蛋白濃度。
按照ATP試劑盒說明書要求,設置空白管、標準管、測定管及對照管,空白管和標準管分別加入30 μL標準液,對照管和測定管分別加入30 μL待測樣本,分別加入不同反應劑,反應結束后用紫外可見分光光度計測定各管OD值(636 nm)。按照如下公式計算樣品的ATP濃度。
ATP濃度=
(OD測定-OD對照)/(OD標準-OD空白)×A×N/C
式中,A:標準品濃度,N:測定樣本稀釋倍數,C:樣品蛋白濃度。
1.4.4 H2O2水平測定
取凍存胃竇組織加入H2O2檢測裂解液,充分勻漿,離心取上清。吸取上清與H2O2檢測試劑置于96孔板內,輕輕振蕩使溶液混勻,室溫放置30 min后使用酶標儀測定A560 nm,根據標準曲線計算出樣品中H2O2的濃度。同時,采用BCA試劑盒測定勻漿液中的蛋白濃度,并用蛋白濃度校正H2O2濃度。蛋白濃度測定方法同“1.4.3”。
1.4.5 線粒體膜電位水平(MMP)測定
按照線粒體提取試劑盒說明書要求,取凍存胃竇組織加入Lysis Buffer,冰上研磨組織20余次得到勻漿混懸液,低速離心取上清,再高速離心取沉淀,所得的沉淀即為線粒體粗提物,加入Wash Buffer對線粒體粗提物進行洗滌,離心后取線粒體沉淀置于Store Buffer中重懸,即得到純化的線粒體。
按照線粒體膜電位檢測試劑盒說明書要求,將純化的線粒體與JC-1緩沖液混合后使用熒光酶標儀進行檢測,激發波長為485 nm,發射波長為590 nm。紅色熒光和綠色熒光分別代表正常線粒體和去極化線粒體。以紅色熒光/綠色熒光的比值表示MMP。
1.4.6 RT-PCR法檢測PINK1、Parkin、p62、LC3 mRNA表達水平
采用Trizol法提取各組大鼠胃竇組織總RNA,使用cDNA反轉錄試劑盒合成RNA樣品的第一鏈cDNA,并用PCR儀進行qRT-PCR分析采用Trizol法提取各組大鼠胃竇組織總RNA,使用cDNA反轉錄試劑盒合成RNA樣品的第一鏈cDNA,并用PCR儀進行qRT-PCR分析。PCR反應體系:2(SYBR Gree qPCR Master Mix 5 μL,上、下游引物各0.2 μL,cDNA 2 μL,滅菌去離子水2.6 μL,共10 μL。PCR反應條件:預變性(95 ℃ 300 min),40次循環(95 ℃ 10 s,60 ℃ 30 s),溶解曲線(65~105 ℃)。
所有引物由天一輝遠公司合成,結果用2-△△Ct方法進行分析,各基因引物序列見表1。
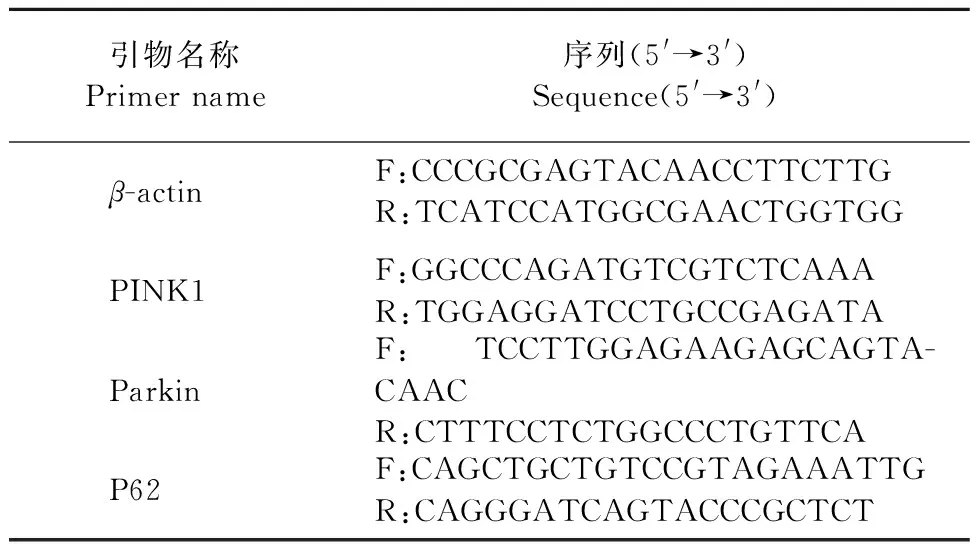
表1 引物序列Table 1 Primer sequence
1.4.7 Western blot法檢測PINK1、Parkin、p62、LC3蛋白表達水平
使用RIPA裂解緩沖液提取各組大鼠胃竇組織中總蛋白,并通過BCA蛋白定量法測定蛋白濃度。SDS-PAGE電泳分離蛋白,將蛋白轉至PVDF膜,用5%脫脂牛奶在0.1% TBST中封閉1 h,洗膜,加入一抗PINK1(1∶2 500)、Parkin(1∶1 000)、LC3B(1∶2 500)、p62(1∶2 500)、β-actin(1∶6 000),4 ℃孵育過夜,加入二抗(1∶50 000)室溫孵育1 h。采用ECL試劑盒檢測條帶,并用ImageJ分析目標條帶。
1.5 統計方法
2 結果
2.1 模型評價
空白組大鼠體格、活動、飲食與大便均正常;造模后各組大鼠體格消瘦,反應遲鈍,大便溏泄,被毛蓬起枯槁無光澤,弓背,神態萎靡,蜷縮聚堆等,造模后的大鼠行為狀態如圖1所示。參考中醫脾虛臨床癥狀及相關文獻對脾虛模型的評判標準,認為造模成功[12]。經麩炒多糖、麩炒正丁醇部位、生多糖、生正丁醇部位給藥干預后,造模大鼠癥狀逐漸正常。
2.2 線粒體超微結構的變化
空白組大鼠胃竇組織線粒體形態規則完整,自噬溶酶體個別存在。模型組大鼠線粒體腫脹,形狀不規則,嵴減少,未見典型自噬結構,提示脾虛導致胃竇組織線粒體損傷與自噬功能障礙。經麩炒蒼術多糖、麩炒蒼術正丁醇部位、生蒼術多糖給藥治療后,線粒體結構損傷分別呈不同程度改善,且自噬溶酶體數量明顯增加。生蒼術正丁醇部位給藥治療后線粒體結構損傷未見改善,線粒體腫脹明顯、膜內基質局部溶解,嵴減少、消失,自噬溶酶體少量存在(見圖2)。
2.3 線粒體基本功能的變化
與空白組比較,模型組大鼠胃竇組織ATP與MMP水平明顯下降(P<0.001),H2O2水平上升(P<0.001)。經麩炒蒼術多糖、麩炒蒼術正丁醇部位、生蒼術多糖、生蒼術正丁醇部位給藥后均能顯著逆轉脾虛模型所致的ATP、MMP、H2O2水平的異常變化。其中,麩炒蒼術多糖對ATP、MMP、H2O2的改善效果優于生蒼術多糖(P<0.05),麩炒蒼術正丁醇部位對H2O2的改善效果優于生蒼術正丁醇部位(P<0.05)(見圖3)。
2.4 線粒體自噬水平的變化
與空白組相比,模型組PINK1、Parkin、p62 mRNA表達顯著增加(P<0.001)。蛋白結果與mRNA基本一致,模型組PINK1、Parkin、p62蛋白增加,LC3I向LC3II的轉化減少,LC3II/I表達顯著降低(P<0.001,P<0.01,P<0.05)。與模型組比較,麩炒蒼術多糖、麩炒蒼術正丁醇部位、生蒼術多糖、生蒼術正丁醇部位給藥后上述變化明顯減輕,PINK1、Parkin、p62 mRNA與蛋白表達均下調,LC3II、LC3II/I蛋白表達升高(P<0.001,P<0.01,P<0.05),其中,麩炒后蒼術多糖與正丁醇部位對以上指標的調節作用優于生品(P<0.05)(見圖4)。
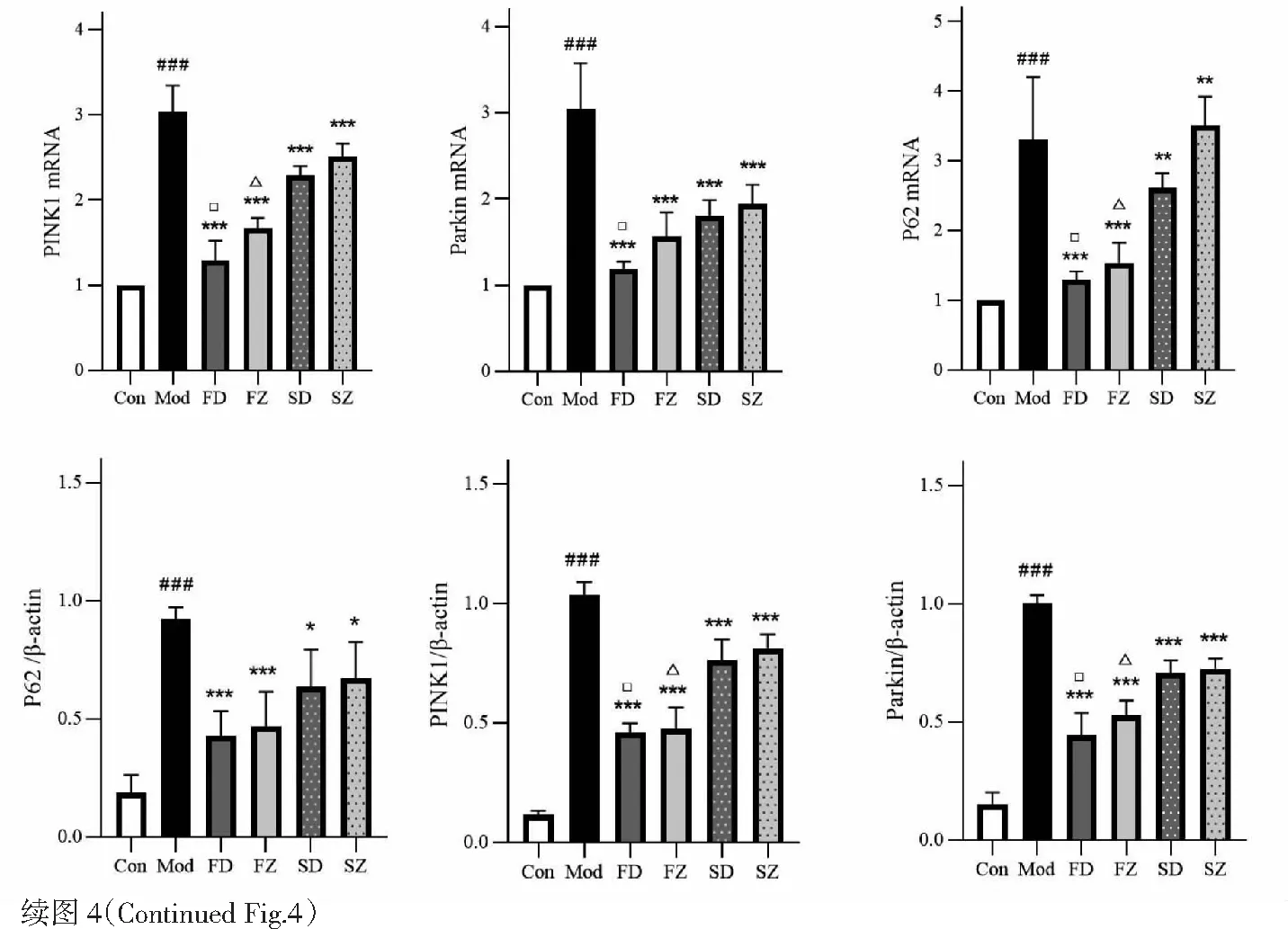
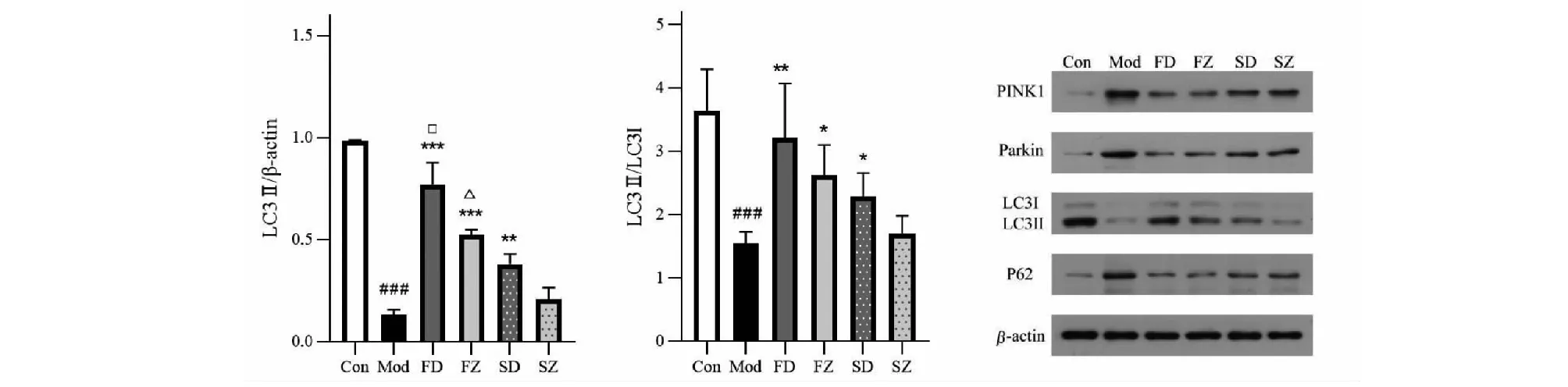
圖4 各組大鼠胃竇組織線粒體自噬水平的變化Fig.4 Changes of mitophagy level in gastric antrum of rats in each
3 討論與結論
脾虛的臨床診斷一般是依據癥狀,脾虛病人常會表現食欲減退,脘腹隱痛,倦怠乏力,畏寒肢冷等癥狀。食欲減退在脾虛動物中表現為體重下降;脘腹隱痛會表現為弓背;倦怠無力則表現為神態萎靡和易疲勞;畏寒則會表現為扎堆蜷縮。本實驗中,造模后大鼠消瘦,弓背,神態萎靡以及蜷縮聚堆,這些外觀行為變化證明了所建立的脾虛大鼠模型是成功的。
線粒體自噬調控機制復雜,多種信號通路可介導不同種類的自噬過程,PINK1/Parkin通路是線粒體最常見、研究最為成熟的自噬信號通路。PINK1在健康的線粒體中通常是檢測不到的,因為PINK1進入線粒體后被膜內水解酶(Parl)切割,隨后被清除[13]。如圖5所示,當線粒體受損時,由于內膜電位降低,PINK1進入線粒體路徑被阻斷,不斷聚集在線粒體外膜并將parkin募集至受損線粒體[14]。Parkin是一種E3泛素蛋白連接酶,被PINK1激活后能夠泛素化受損的線粒體膜蛋白,并被選擇性自噬接頭蛋白p62所識別[15],再與自噬體膜上的自噬相關蛋白微管相關蛋白1輕鏈3(LC3)連接,啟動自噬,最終降解受損的線粒體[16]。本研究發現,模型組PINK1和Parkin mRNA與蛋白顯著增加,表明存在受損的線粒體,PINK1/Parkin通路已經激活,但可能由于自噬功能障礙,受損的線粒體未能被自噬降解。生、麩蒼術多糖與正丁醇部位治療后各組大鼠PINK1和Parkin mRNA與蛋白水平降低,表明一些受損的線粒體已被自噬降解清除。
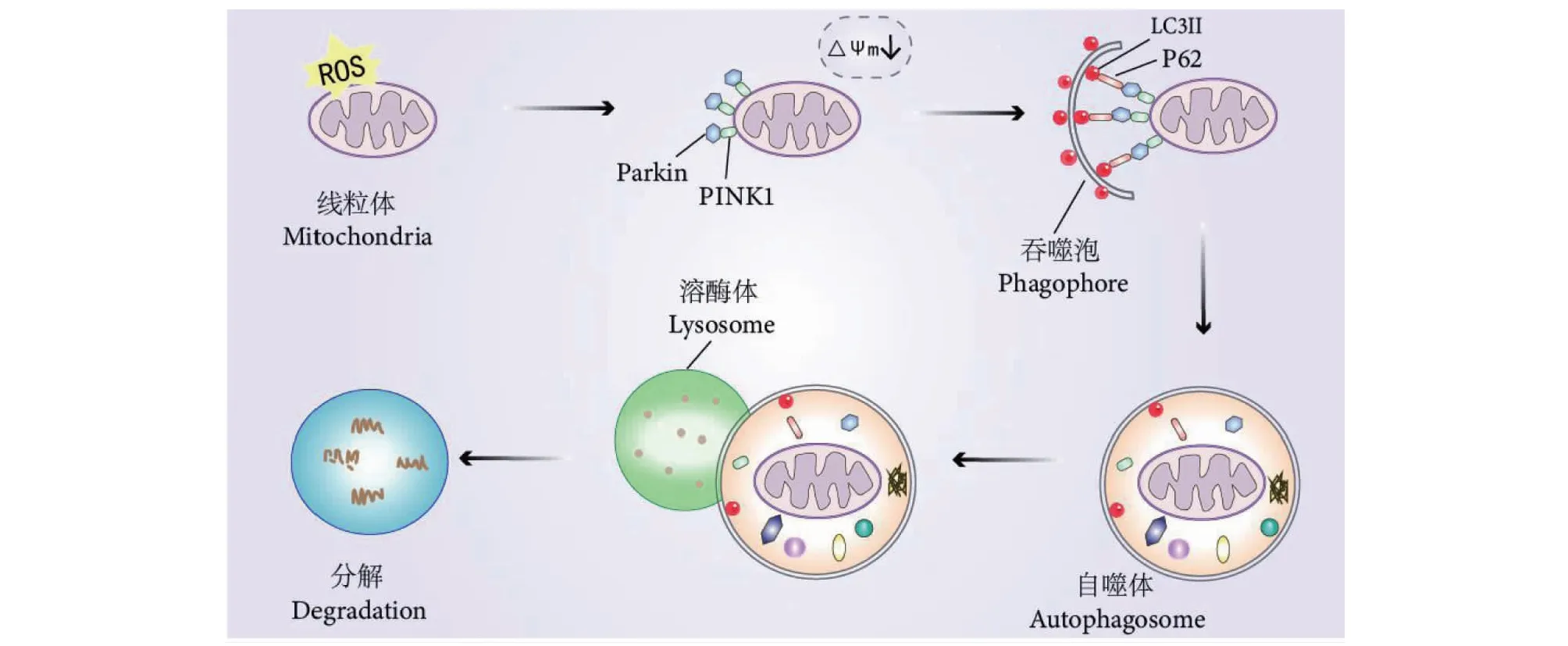
圖5 線粒體自噬機制圖Fig.5 The mechanism of PINK1/Parkin-mediated mitophagy
線粒體自噬受眾多自噬相關蛋白嚴密調控,因此某些關鍵蛋白的表達常用來判定自噬的強弱,其中較為關鍵的是LC3和p62等。未發生自噬時,大多數LC3以LC3I的形式存在于細胞質中,當自噬發生時,LC3Ⅰ會經泛素化修飾與自噬泡表面的磷脂酰乙醇胺結合形成位于自噬體膜表面的LC3Ⅱ[17],因此,LC3II的出現常作為自噬發生的重要標志[18]。作為一種關鍵的選擇性自噬適配蛋白,p62可與LC3II結合并作為選擇性自噬的底物[19]。當溶酶體與自噬體處于結合階段時,p62可作為溶酶體的供體,引導自噬體與之結合,形成自噬溶酶體,最后底物被溶酶體內的蛋白水解酶降解,p62隨即被一同降解[20],自噬的發生通常伴隨著p62的減少。本研究觀察到,模型組LC3II蛋白表達和LC3II/I比值均顯著低于空白組,表明脾虛時胃竇組織細胞內的自噬體形成受限。p62 mRNA與蛋白水平上升,提示自噬活性受到抑制。經生、麩蒼術多糖與正丁醇部位給藥后各組大鼠LC3Ⅰ向LC3Ⅱ的轉化增強,p62mRNA與蛋白水平下降,提示自噬水平上升。透射電鏡結果與之對應,模型組大鼠線粒體結構損傷較重,未見自噬結構,表明自噬功能受損可能導致了受損線粒體的積累。給藥后各組大鼠線粒體結構損傷減輕,自噬溶酶體數量增多。因此,我們認為脾虛導致大鼠胃竇組織線粒體自噬功能受損,而生、麩蒼術多糖與正丁醇部位給藥后促進了自噬的發生。
線粒體自噬受阻通常伴隨著活性氧(reactiveoxygenspecies,ROS)的產生,細胞內ROS水平升高將誘導氧化應激[21]。氧化應激攻擊線粒體膜,導致膜電位降低、線粒體損傷和功能障礙[22],進而引發能量生成缺陷、ROS增多,造成惡性循環。受損和功能失調的線粒體被線粒體自噬選擇性清除,有助于減少ROS的產生并防止正常細胞的氧化損傷[3]。H2O2是細胞內主要的內源性ROS,幾乎可以由所有的氧化應激源產生,并且能夠自由擴散進出細胞,造成氧化-抗氧化系統的失衡[23]。因此,本實驗通過檢測H2O2含量,間接評價ROS水平。研究結果表明,脾虛大鼠體內H2O2水平,膜電位和ATP降低,表明線粒體功能受損。而生、麩蒼術多糖與正丁醇部位的治療顯著改善了線粒體功能,這可能是通過促進線粒體自噬和增加受損線粒體的清除實現的。
綜上,我們推測,蒼術多糖與正丁醇部位可能是通過改善胃竇組織自噬障礙,恢復線粒體功能,從而調節脾虛,且麩炒后多糖與正丁醇部位效果明顯優于生品。

