鎂合金生物材料在動物體內的實驗研究進展
李晉香,喻正文,張 劍
遵義醫(yī)科大學口腔醫(yī)學院,貴州 遵義 563000
鎂(Magnesium,Mg)及鎂合金具有良好的力學性能和生物相容性。一方面,Mg 是人體必需元素之一,它參與多種蛋白質合成,多種酶的激活等。此外,Mg 是人體細胞內第二重要的陽離子,對于維持生物膜電位有著重要作用。另一方面,Mg 及鎂合金力學性能優(yōu)良,有著與人骨相似的楊氏模量(37.5~65 GPa),比強度與比剛度、抗拉強度較陶瓷材料和高分子生物材料高[1],見表1。這些特征使得其能夠很好緩解骨科植入物的應力遮擋效應[2-3]。然而,Mg及鎂合金在體內降解速度過快,這是阻礙鎂合金進入臨床應用的最大困難[4]。本文主要介紹了近年來相關重要鎂合金在各領域應用的動物體內研究進展。
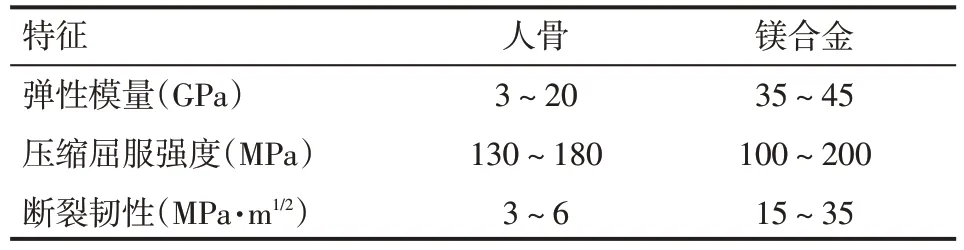
表1 鎂合金植入物與人骨的對比情況
1 鎂合金生物材料在醫(yī)學領域的臨床前期研究
1.1 骨科領域應用
現有證據表明,鎂離子可以促進骨再生,且對新血管和骨組織的形成起著有益的作用,加速骨疾病的愈合[5],此外,Mg 降解產生的堿性和高鎂微環(huán)境可以有效地抑制破骨細胞分化和骨吸收。骨科領域是目前鎂合金研究的主要且最多方向之一,在國內外研究且取得了一定的臨床進展有Mg-Y-RE-Zr(WE43)合金、Mg-5Ca-1Zn 合金和純鎂[6]。最近在我國,由Kai Xie 等[7]將(Ca-P 涂層)的Mg-Nd-Zn-Zr(JDBM)合金螺釘治療內踝骨折,觀察1至2 年。結果顯示,所有患者術后內踝骨折愈合,功能恢復。上述臨床試驗局部均只產生少量氣體且臨床效果良好,這可能是與植入部位均不負重且體積較小有關。考慮到未來鎂合金需要提供強大支撐力或扭轉力在長骨上,因此是否能夠提供足夠的機械強度仍然需探索。合金化是提高Mg的機械和物理性能及其耐腐蝕性的重要步驟。Mao G等[8]在 純Mg 中 加 入 微 量 的 鋅 和 鈣,軋 制 得 到Mg-2Zn-0.05Ca 合金。在體內和體外實驗中表明,該合金有效地平衡機械強度和耐腐蝕性,具有潛在的骨植入應用前景。Holweg P 等[9]也制備了微量Mg-0.45Zn-0.45Ca 合金,應用于具有截骨(模擬骨折)的生長綿羊模型上,與非骨折的組相比,在骨折愈合過程中,合金體積未變化,表明其降解率得到控制。保護性涂層和表面處理則可以用來改善鎂合金的耐蝕性,并潛在地增強鎂合金的生物相容性和活性。Lin Z 等[10]采用等離子體離子浸沒注入(PIII)技術在WE43 鎂植入體表面構建了功能化的TiO2/Mg2TiO4納米層。納米層的應用顯著提高了鎂基體的耐腐蝕性,而且由于鎂離子的控制釋放,也提高了成骨細胞在體外的分化能力。Rendenbach C 等[11]則是將WE43 進行MAO處理,也與未處理對比,結果表明該處理有效地控制了WE43鎂植入物在體內的降解行為,同時有適度的骨刺激作用,對骨膜下區(qū)域新骨形成增加。現在Mg 及鎂合金表面防護處理技術繁多,但是其成本較高,而且也仍未得知最具有突出性能的表面防護處理技術。
1.2 心血管領域應用
現心血管領域鎂合金主要產品為血管支架、血管縫合線及血管夾。心血管支架是研究最廣的,而鎂合金支架的耐腐蝕性差、血管內皮化不足導致血栓、炎癥和再狹窄的發(fā)生,限制了其預期的臨床應用。
合金化策略通常是為了解決鎂合金的退化問題。比如,在止血夾的設計上,Ding P 等[12]采用制備了Mg-3Zn-0.2Ca 合金止血夾,均能成功結扎頸動脈,術后無一例發(fā)生血漏。且沒有觀察到周圍炎癥和少量的氫氣形成,各項生化指標均正常。Yu X等[13]在此基礎上添加釔元素不僅提高了合金的耐蝕性,還得到一樣的良好結果,而且在長期的應用中(8個月),該夾子完全降解。但從臨床應用的角度來看,合金的綜合力學性能,特別是彈性模量和延展性還有待進一步提高。Bian 等[14]最近研究了一種高延展性Mg-8.5Li (wt.%)合金,在豬體內未產生血栓,對周圍組織具有耐受性。在體外表明總體降解率的控制較好,但在豬體內降解率升高,顯示搭建時間不足,即使如此該合金在1個月內內皮細胞也能覆蓋。然而,合金元素的需求量大,成本也更高。此外,相關的體內降解機制還需要進一步研究和澄清。表面改性作為另一種候選策略,是改善鎂合金支架性能的有效策略。最近兩年的研究來看,Li JA等[15]在氫氧化鈉鈍化的Mg-Zn-Y-Nd合金表面制備了不同分子量的聚多巴胺(PDA)/透明質酸(HA)涂層,體內外實驗表明,適量分子量涂層的合金具有良好的血液相容性、促內皮化、抗增生和抗炎功能。Wang P 等[16]開發(fā)了一種用于Mg-Zn-Y-Nd 合金單寧酸(TA)涂層的多功能表面,結果表明該涂層后的合金具有優(yōu)異的抗氧化和抗血小板能力。此外,鉭(Tantalum,Ta)涂層支持內皮細胞的生長和增殖。在大鼠皮下植入試驗中,TA涂層未觀察到明顯的炎癥反應。Mao等[17]在JD?BM合金表面制備片層寬度約為1~5 um的Mg3(PO4)2涂層體外證實,該涂層對人臍靜脈內皮細胞的保護作用使合金的耐蝕性提高了約25%,此外溶血率也較低和良好的抗血小板黏附性能。
1.3 口腔領域應用
在口腔領域的應用中,可降解鎂合金除了在頜骨內固定系統、骨缺損充填等骨科方面的應用外,在口腔種植體系統、頜面外科傷口的縫合裝置以及在抗菌方面也是可降解鎂合金臨床應用方向。Zhao X 等[18]研究團隊在之前的研究中已表明銅含量最低的Mg-0.03Cu可以提高細胞存活率、堿性磷酸酶活性以及成骨相關蛋白的表達。在最近研究中,該團隊還表明了Mg-Cu合金作為潛在的植骨材料可以有效地預防牙周炎中常見的厭氧菌牙齦卟啉單胞菌和伴放線聚集桿菌手術中的感染。在目前正畸中,常用于支抗的是微型螺釘種植體(MSI)和用于外科正畸治療的骨固定 板(BFP)。Kawamura N 等[19]比 較 了 鎂 鋁 鋅 合 金(AZ31)與鈦合金(TIA),試驗表明,AZ31可獲得明顯高于TIA 的骨-種植體界面強度。此外,AZ31 在成骨方面優(yōu)于TIA。動物實驗未見嚴重炎癥反應,對活體無損傷。所以AZ31適用于MSI和BFP。然而,該AZ31合金未在12周的實驗期后降解,因此,需要更長期的研究。口腔縫線的要求很高,因為在口腔窄而深,操作不便而且口腔免疫系統強大,愈合能力及黏膜再生能力強。Li W 等[20]開發(fā)了Mg-2Zn 合金作為一種潛在的口腔縫合材料,并表明0.5 mm 的尺寸的縫合材料最適合,但在接下來研究目的中,降解率的控制還需要進一步提高。
1.4 其他領域應用
在肝膽外科中,Mg 及鎂合金支架的研究主要在于對膽道狹窄及肝膽癌的干預。Guo L等[21]研究表明JDBM支架比TIA 支架更適合應用于膽管,且若用MgF2–PDLLA涂層的JDBM支架在體內的降解率下降,雖然涂層的JDBM支架尚不能滿足良性膽管狹窄的支持時間,但表明了鎂合金的在肝膽外科中潛在臨床應用及提供了未來研究方向提供了思路,即降低鎂合金的降解率。Li T 等[22]和Peng H等[23]都用高純Mg與鈦(Ti)支架對比,在體內及體外研究表明Mg 的降解產物能顯著抑制肝膽區(qū)癌細胞的生長并促進其凋亡,這些結果進一步為鎂在膽道外科領域的應用提供了理論支持。
在泌尿系統的應用中,Zhang S 等[24-25]將Mg-Zn(6wt.%)合金和ZK60 合金(Mg5.6wt%Zn0.5wt%Zr)與純鎂對比研究表明,三者均有良好的生物相容性,在體外(SBF溶液、人工尿液中)、體內(大鼠膀胱)中前兩者的降解速率均比純鎂快,但與輸尿管支架的平均臨床留置時間為8~12 周相比,這項實驗時間較短,也未提出更佳的鎂合金植入材料。為此在最近的研究中,Tian Q 等[26]在體外研究人尿路上皮細胞與抗菌性能較好的Mg-4Zn-1Sr(ZJ41)合金生物相容性最好,但應進一步降低鎂合金的降解率。當然,此合金尚需體內實驗進一步研究。因此該團隊,Di Tie等[27]首次在大型動物(廣西巴馬小型豬)中對該合金輸尿管支架植入物進行體內研究,表明與目前廣泛使用的不銹鋼支架相比,該合金具有相似的生物相容性,但抗菌活性明顯增強。
2 結論與展望
綜合以上論述,鎂及鎂合金作為植入物材料的最大限制是其快速的降解速率,嚴重損害了鎂植入物保持其結構的能力。眾多研究者通過合金化,表面改性等途徑合成的新型鎂合金在性能上都得到了不斷提高,證明了鎂及合金作為未來生物植入物的理想候選者的潛力,但是這些技術雖然有效改善了鎂合金的機械性能及降解速率,但要想完全滿足鎂合金臨床植入期望,仍需要不斷改進,而且現今對于哪種元素是鎂合金最佳的合金元素,哪種鎂合金在臨床上綜合性能最好都無定論。今后的工作重點還是應放在提高鎂合金生物相容性、機械性能及腐蝕性能上,通過對找到最合適的合金化元素、添加量以及在表面改性的技術上更加優(yōu)化,相信在不久的將來鎂合金的應用及適用性更加廣泛。

