NF-κB在ACC-2和CAL-27細(xì)胞中的表達(dá)及對(duì)125I粒子放射敏感性的影響
吳亞?wèn)| 梁倍銘 趙科 尹鑫海 王亞?wèn)| 程顯林 李永頔
(1 貴州醫(yī)科大學(xué)附屬口腔醫(yī)院口腔頜面外科,貴州 貴陽(yáng) 550002;2貴州省人民醫(yī)院口腔頜面外科)
頭頸癌在全球最常見(jiàn)的腫瘤中居第六位,2012年有60多萬(wàn)新發(fā)病例和40多萬(wàn)的死亡病例,男性和女性的發(fā)病率分別約21.1/10萬(wàn)和12.4/10萬(wàn)〔1〕。對(duì)于口腔頜面部來(lái)說(shuō),最常見(jiàn)的惡性腫瘤是鱗狀細(xì)胞癌和涎腺癌,它們具有較強(qiáng)的局部侵襲性,其治療原則是以手術(shù)為主,輔以放療和化療等的綜合治療。大劑量的外照射理論上可以使腫瘤根治,但同時(shí)又與正常組織的耐受是矛盾的,會(huì)產(chǎn)生放療并發(fā)癥。放療后出現(xiàn)黏膜炎、皮炎、吞咽困難、張口受限、放射性骨壞死等,針對(duì)這些并發(fā)癥的治療也頗為棘手。由于放射性125I粒子植入具有高度適形、靶區(qū)劑量高、靶區(qū)外低劑量的優(yōu)點(diǎn),因此既可以治療頭頸腫瘤,又可以大限度地避免或減輕上述并發(fā)癥的發(fā)生。國(guó)內(nèi)外使用這一技術(shù)治療頭頸癌,尤其是涎腺癌,取得了良好的效果。本課題組從2006年開(kāi)始利用放射性125I粒子植入近距離治療以涎腺癌為主的頭頸部惡性腫瘤,到目前為止,取得了令人滿意的療效〔2,3〕。但是在臨床應(yīng)用中發(fā)現(xiàn)放射性125I粒子對(duì)涎腺癌的療效好,局部復(fù)發(fā)率低,而治療口腔鱗癌的療效卻不令人滿意,很多患者在1年內(nèi)出現(xiàn)了局部復(fù)發(fā)或轉(zhuǎn)移。因此針對(duì)頭頸鱗癌患者,放射性125I粒子常被用來(lái)與外放療聯(lián)合照射治療因全身疾病或局部晚期而不能手術(shù)的患者〔4,5〕。核轉(zhuǎn)錄因子(NF)-κB可以調(diào)控400多種基因,NF-κB信號(hào)通路在炎癥反應(yīng)、免疫應(yīng)答及腫瘤的發(fā)生發(fā)展中具有重要作用〔6〕。電離輻射對(duì)DNA造成損傷時(shí),細(xì)胞會(huì)激活相應(yīng)的信號(hào)反應(yīng),啟動(dòng)DNA損傷修復(fù)反應(yīng)途徑,觸發(fā)細(xì)胞周期阻滯、細(xì)胞衰老、細(xì)胞凋亡等。如果觸發(fā)了NF-κB信號(hào)通路,通常會(huì)阻止細(xì)胞凋亡的發(fā)生,從而導(dǎo)致細(xì)胞放射耐受〔7〕。本研究探討NF-κB信號(hào)通路在腺樣囊性癌ACC-2細(xì)胞和舌癌CAL-27細(xì)胞中的表達(dá)及對(duì)125I粒放射敏感性的影響。
1 材料和方法
1.1主要儀器和試劑 流式細(xì)胞儀(BD公司);多功能酶標(biāo)儀(BioTek公司);倒置顯微鏡(Olympus);多光譜成像系統(tǒng)(Nuance公司);實(shí)時(shí)熒光定量-聚合酶鏈反應(yīng)(RT-qPCR)儀(ABI公司)。放射性125I粒子源(江蘇華益科技有限公司);細(xì)胞周期與細(xì)胞凋亡檢測(cè)試劑盒、膜聯(lián)蛋白(Annexin)Ⅴ凋亡檢測(cè)試劑盒和噻唑藍(lán)(MTT)細(xì)胞活力及細(xì)胞毒性檢測(cè)試劑盒(碧云天公司);NF-κB抗體(Cell Signal公司);各種培養(yǎng)基和胰蛋白酶(凱基生物公司);胎牛血清(四季青公司)。
1.2細(xì)胞培養(yǎng) 取對(duì)數(shù)生長(zhǎng)期人腺樣囊性癌ACC-2細(xì)胞和人舌癌CAL-27細(xì)胞系(ATCC,美國(guó)),用胰酶消化,離心5 min后重懸,用血細(xì)胞計(jì)數(shù)板和臺(tái)盼藍(lán)染色計(jì)數(shù)活細(xì)胞濃度,梯度稀釋。然后將適量的細(xì)胞接種于含有10%胎牛血清、青霉素100 U/ml的RPMI1640培養(yǎng)基細(xì)胞培養(yǎng)皿中,在37 ℃,5% CO2的培養(yǎng)箱中培養(yǎng)。
1.3離體照射模型的建立及分組 照射模型參照英國(guó)GARY實(shí)驗(yàn)室設(shè)計(jì)的放射性粒子離體照射細(xì)胞研究系統(tǒng)〔8〕。2 mm厚聚甲丙烯酸甲酯板支架,分為上下2層,上層為細(xì)胞培養(yǎng)板,下層為粒子盤(pán)。將8枚7611型125I粒子按等距離分布直徑3 cm的圓周上,圓心放置1枚粒子。125I粒子的活度為37 MBq(1 mCi),根據(jù)蒙特卡洛建模模擬方法推算出在該離體照射模型下細(xì)胞分別受到4 Gy125I持續(xù)低劑量率照射,照射時(shí)間為43.56 h。實(shí)驗(yàn)分為NC組(空白對(duì)照)、125I組(細(xì)胞接受4 Gy放射性125I粒子低劑量率持續(xù)照射)、PDTC 組(選擇性NF-κB抑制劑)、PDTC+125I組,(同時(shí)加入PDTC和接受125I粒子照射)。
1.4MTT實(shí)驗(yàn) 根據(jù)MTT試劑盒說(shuō)明書(shū),將各干預(yù)前后的細(xì)胞繼續(xù)培養(yǎng)24 h,消化后制成單細(xì)胞懸液,調(diào)整細(xì)胞密度為每孔4 000~5 000個(gè),接種至96孔細(xì)胞培養(yǎng)板中,繼續(xù)放入37 ℃細(xì)胞培養(yǎng)箱中培養(yǎng)72 h。將20 μl MTT溶液加入每細(xì)胞孔內(nèi),繼續(xù)孵育4 h。然后將200 μl二甲基亞砜(DMSO)加入培養(yǎng)板中各細(xì)胞培養(yǎng)孔中,放置于脫色搖床上振蕩10 min,用酶聯(lián)免疫檢測(cè)儀測(cè)定各細(xì)胞培養(yǎng)孔在570 nm波長(zhǎng)處的吸光光度值(OD值),將這些光度值記錄后繪制以O(shè)D值為縱坐標(biāo)的細(xì)胞生長(zhǎng)柱狀圖。
1.5RT-qPCR實(shí)驗(yàn) 根據(jù)引物設(shè)計(jì)原則,通過(guò)NCBI數(shù)據(jù)庫(kù)進(jìn)行引物設(shè)計(jì)。引物序列為p65上游5′-CCTTCCAAGAAGAGCAGCGTG-3′,下游5′-ATGA-GAAAGGACAGGCGGCA-3′;GAPDH上游5′-ACAA-CTTTGGTATCGTGGAAGG-3′,下游5′-TGGCGTGGGATGATCCTAGA-3′。將實(shí)驗(yàn)的各組細(xì)胞勻漿后轉(zhuǎn)移至1.5 ml的Ep管中,加入0.2 ml氯仿/ml,Trizol溶液和vortex 15 s,靜置10 min,低溫離心機(jī)離心,吸取含有RNA的上層水相并轉(zhuǎn)移至EP管中,加入0.5 ml Trizol液,混勻,靜置后離心,棄上清,洗滌RNA沉淀2次,混勻,低溫離心,棄上清液,空干后加入適量焦碳酸二乙酯(DEPC)溶液,溶解RNA沉淀,備用。制膠,電泳,檢測(cè)總RNA完整性。根據(jù)PCR SYBR Green試劑盒說(shuō)明書(shū)在PCR管中依次加入如下試劑:25 μl FastStart Universal SYBR Green Master (ROX),0.5 μl正向引物 (30 μmol/L),0.5 μl反向引物(30 mol/L),然后用加入不含核糖核酸酶的雙蒸餾水。將cDNA樣品50 ng加入PCR管中,混勻。PCR擴(kuò)增條件為95 ℃ 10 min、95 ℃ 10 s、60 ℃ 20 s、72 ℃ 10 s,共40個(gè)循環(huán)。PCR結(jié)束后,利用軟件分析各個(gè)cDNA樣品的擴(kuò)增曲線和溶解曲線,同時(shí)用瓊脂糖凝膠電泳檢測(cè)這些擴(kuò)增產(chǎn)物的特異性;由公式Folds=2-△△Ct計(jì)算各樣本中的NF-κB p65 mRNA含量及同樣本中的GAPDH相對(duì)表達(dá)量。
1.6Western印跡 本實(shí)驗(yàn)制膠濃度為10%。然后取實(shí)驗(yàn)細(xì)胞進(jìn)行消化,收集,超聲裂解后低溫離心,收集上清液。配制不同濃度的牛血清白蛋白(BSA)溶液,用紫外線分光光度儀分別測(cè)定在595 nm波長(zhǎng)時(shí)各種濃度BSA溶液的光密度值,記錄并繪制標(biāo)準(zhǔn)曲線,再測(cè)定并記錄各組蛋白樣品的OD值,按照繪制標(biāo)準(zhǔn)曲線推算的公式計(jì)算出每個(gè)樣品的濃度,給予分裝和定量。計(jì)算樣品體積后對(duì)蛋白進(jìn)行高溫變性。向電泳槽內(nèi)加入緩沖液,然后上樣,每孔總蛋白30~50 μg,調(diào)節(jié)電壓100 V、功率50 W、電流300 mA進(jìn)行蛋白電泳。然后按照陰極碳板+海綿+三濾+膠+膜+三濾+海綿+陽(yáng)極碳板的順序進(jìn)行轉(zhuǎn)膜。麗春紅染色剪膜。用5%的牛奶封閉,按說(shuō)明書(shū)稀釋Ⅰ抗,孵育后回收 I 抗。洗膜,加入稀釋好的Ⅱ抗,搖床孵育,再次洗膜后曝光。本實(shí)驗(yàn)以H2A為內(nèi)參。用ImageJ軟件對(duì)電泳條帶進(jìn)行灰度測(cè)定及統(tǒng)計(jì)分析。
1.7流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡 將各組細(xì)胞制成單細(xì)胞懸液,按一定濃度接種培養(yǎng),將消化后用磷酸鹽緩沖液(PBS)清洗,重新懸浮后加入至離心管內(nèi),加入70%乙醇溶液,置于4 ℃環(huán)境下過(guò)夜,然后離心,棄上清,用冷PBS重懸細(xì)胞,再次離心,棄上清。加入500 μl含有100 μg /ml RNase的PBS,37 ℃孵育30 min至1 h離心,棄上清,再加入500 μl含有50 μg /ml的碘化丙啶(PI)和異硫氰酸熒光素(FITC)的PBS,在4 ℃并避光的條件下孵育20~30 min。再次用離心機(jī)離心并棄掉上清液,隨后向離心管中加入300~400 μl PBS,將細(xì)胞重新懸浮后用流式細(xì)胞儀進(jìn)行讀數(shù)。
1.8統(tǒng)計(jì)學(xué)處理 采用SPSS19.0軟件進(jìn)行獨(dú)立樣本t檢驗(yàn)、one-way ANOVA方差分析,并用Bonferroni校正的t檢驗(yàn)對(duì)各組均數(shù)間進(jìn)行兩兩比較,用GraphPad Prism6.0進(jìn)行統(tǒng)計(jì)繪圖。
2 結(jié) 果
2.1MTT實(shí)驗(yàn)檢測(cè)ACC-2和CAL-27細(xì)胞照射后的生長(zhǎng)活力 照射后,ACC-2和CAL-27細(xì)胞的生長(zhǎng)較NC組均受到明顯抑制(P<0.05),且ACC-2細(xì)胞活力明顯低于CAL-27細(xì)胞(t=3.282,P=0.034)。見(jiàn)表1。
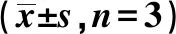
表1 兩組ACC-2、CAL-27細(xì)胞OD值、NF-κB p65 mRNA及NF-κB p-p65蛋白表達(dá)比較
2.2RT-qPCR實(shí)驗(yàn)檢測(cè)ACC-2和CAL-27細(xì)胞在照射前后NF-κB p65 mRNA表達(dá) 與ACC-2和CAL-27細(xì)胞NC組相比,125I粒子照射后NF-κB p65 mRNA表達(dá)明顯降低(P<0.05);且照射后CAL-27細(xì)胞中p65 mRNA表達(dá)下降程度明顯少于ACC-2細(xì)胞(t=2.902,P=0.044)。見(jiàn)表1。
2.3Western印跡檢測(cè)ACC-2和CAL-27細(xì)胞在照射前后NF-κB中磷酸化(p)-p65蛋白表達(dá) 照射后,ACC-2和CAL-27細(xì)胞中p-p65蛋白表達(dá)均較NC組明顯升高(P<0.05)。見(jiàn)表1、圖1。說(shuō)明受到125I粒子照射后,兩種細(xì)胞內(nèi)的NF-κB均明顯活化。

1~4:ACC-2 NC組、ACC-2 125I組、CAL-2 NC組、CAL-27 125I組
2.4流式細(xì)胞術(shù)檢測(cè)加入NF-κB抑制劑PDTC前后及ACC-2和CAL-27細(xì)胞受照射前后細(xì)胞凋亡變化 ACC-2和CAL-27細(xì)胞受照射后,PDTC+125I組凋亡率較其余3組明顯增加(P<0.05)。見(jiàn)圖2、表2。說(shuō)明PDTC可以通過(guò)抑制NF-κB增加ACC-2細(xì)胞和CAL-27細(xì)胞受到125I照射后的細(xì)胞凋亡。

圖2 流式細(xì)胞術(shù)檢測(cè)各組ACC-2和CAL-27細(xì)胞凋亡
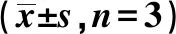
表2 各組ACC-2和CAL-27細(xì)胞受4 Gy 125I照射、添加100 μmol/L PDTC前后的OD值及細(xì)胞凋亡率比較
2.5加入NF-κB抑制劑PDTC檢測(cè)ACC-2和CAL-27細(xì)胞受照射前后細(xì)胞活力變化 加入PDTC后,ACC-2和CAL-27細(xì)胞受照射后細(xì)胞活力較NC組細(xì)胞生長(zhǎng)明顯受到抑制(P<0.05)。PDTC+125I組OD值明顯小于其他3組(P<0.05)。說(shuō)明PDTC可以通過(guò)抑制NF-κB來(lái)影響ACC-2和CAL-27細(xì)胞受到125I照射后的細(xì)胞活力。見(jiàn)表2。
3 討 論
人體組織器官對(duì)放射線的敏感性具有差異,總體來(lái)說(shuō),與其組成細(xì)胞的繁殖能力呈正比,與細(xì)胞分化程度成反比,即細(xì)胞繁殖能力越強(qiáng)的組織器官越敏感。腫瘤細(xì)胞的細(xì)胞分化程度越低的腫瘤對(duì)放射線越敏感。按腫瘤細(xì)胞的繁殖和分化能力,可以將腫瘤劃分為敏感性高、敏感性較高、中度敏感、敏感性較低和敏感性低五類〔9〕。在影響腫瘤的放射敏感性的各種因素中,腫瘤組織的細(xì)胞起源和分化是主要的因素。起源于放射敏感組織的腫瘤對(duì)放射線的敏感性較高,分化程度越差的腫瘤其放射線敏感性也越高。鱗狀細(xì)胞癌和腺癌都屬于對(duì)放射線中度到低度敏感的惡性腫瘤。但即便如此,手術(shù)結(jié)合放療仍是目前公認(rèn)的治療頭頸鱗癌和涎腺癌最有效的手段。屠規(guī)益等〔10〕對(duì)229例口腔癌患者分析發(fā)現(xiàn),針對(duì)T3、T4病變術(shù)前放療40~50 Gy后,術(shù)前放療組和單純手術(shù)組5年生存率為60.0% vs 29.4%。同時(shí),中國(guó)醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院頭頸外科對(duì)1 215例頭頸鱗癌患者5年生存率總結(jié)發(fā)現(xiàn)手術(shù)加放療的療效是最好的〔11〕。對(duì)于涎腺癌,Lewis等〔12〕認(rèn)為放療可以明顯降低涎腺癌的局部復(fù)發(fā)率,而化療對(duì)其愈合并無(wú)多大益處。Hosni等〔13〕對(duì)304例大唾液腺癌進(jìn)行術(shù)后放療3D適形放療或調(diào)強(qiáng)放療,平均隨訪82個(gè)月,局部控制率達(dá)96%,預(yù)期10年生存率為75%。Yu等〔14〕對(duì)405例涎腺癌的生存率進(jìn)行分析,腺樣囊性癌患者接受單純手術(shù)者5年和10年生存率分別為56.6%和34.5%,而手術(shù)+放療組其5年和10年生存率分別為93.3%及68%,差異具有統(tǒng)計(jì)學(xué)意義。放射性125I半衰期59.4 d,其衰變過(guò)程主要通過(guò)內(nèi)部轉(zhuǎn)化產(chǎn)生27、31 KeV的X射線和35 KeV的γ射線。由于其特殊的低劑量率輻射和適當(dāng)?shù)陌胨テ?放射性125I已成為目前臨床應(yīng)用最廣泛的放射性核素之一。1968年Hilaris等〔15〕率先進(jìn)行了125I粒子組織間植入治療鼻咽癌。隨后,這種放射性粒子被廣泛應(yīng)用于前列腺癌等多種類型實(shí)體惡性腫瘤的治療,并逐漸成為國(guó)內(nèi)外近距離放射治療中經(jīng)常應(yīng)用的標(biāo)準(zhǔn)核素之一。國(guó)內(nèi)外部分學(xué)者及醫(yī)生使用這一技術(shù)治療涎腺癌,取得了良好效果。Stannard等〔16〕對(duì)9例腭部小涎腺癌術(shù)后陽(yáng)性切緣的患者進(jìn)行35~62 Gy的125I粒子近距離照射治療,隨訪32~158個(gè)月,沒(méi)有出現(xiàn)局部復(fù)發(fā)。有研究用放射性125I粒子組織間植入近距離治療涎腺癌,取得了良好的效果〔17,18〕。本課題組從2006年底開(kāi)始應(yīng)用125I粒子以涎腺癌為主的口腔頜面-頭頸癌,取得了令人滿意的局部控制率和復(fù)發(fā)率。我們?cè)谂R床中發(fā)現(xiàn)也放射性125I粒子治療口腔鱗癌的局部控制率和復(fù)發(fā)率不如治療涎腺癌效果好。本實(shí)驗(yàn)結(jié)果說(shuō)明,ACC-2細(xì)胞比CAL-27細(xì)胞對(duì)于125I粒子照射更加敏感,驗(yàn)證了臨床上放射性125I粒子治療涎腺癌的療效比口腔鱗癌的療效好。1986年,Sen等〔19〕從B淋巴細(xì)胞提取物中檢測(cè)到一種可與免疫球蛋白的kappa鏈基因增強(qiáng)子序列特異結(jié)合的核因子及其抑制因子,即NF-κB及其抑制因子IκBα。最常見(jiàn)的NF-κB二聚體是p65與 p50組成的異二聚體。NF-κB 的抑制單位IκB通過(guò)其C末端特定的錨蛋白重復(fù)序列與NF-κB結(jié)合,并阻止NF-κB向細(xì)胞核內(nèi)轉(zhuǎn)移。在靜息的細(xì)胞中,NF-κB 和IκB形成復(fù)合體,以無(wú)活性形式存在于胞質(zhì)中。當(dāng)細(xì)胞受細(xì)胞外信號(hào)刺激后,IκB激酶復(fù)合體(IKK)活化將IκB磷酸化,使NF-κB暴露核定位位點(diǎn)。游離的NF-κB迅速移位到細(xì)胞核,與特異性κB 序列結(jié)合,誘導(dǎo)相關(guān)基因轉(zhuǎn)錄。研究發(fā)現(xiàn),NF-κB信號(hào)通路在炎癥反應(yīng)、免疫應(yīng)答及腫瘤的發(fā)生發(fā)展中具有重要作用〔20〕。當(dāng)外界信號(hào)作用于細(xì)胞后,會(huì)啟動(dòng)細(xì)胞質(zhì)中NF-κB信號(hào)通路,使NF-κB失去IκBs因子的抑制,促進(jìn)NF-κB從細(xì)胞質(zhì)轉(zhuǎn)移到細(xì)胞核,行使其轉(zhuǎn)錄因子的功能,調(diào)控靶基因的表達(dá)。包括炎性因子、藥物、放射線等都會(huì)激活NF-κB信號(hào)通路,而NF-κB在包括免疫、炎癥、細(xì)胞凋亡及細(xì)胞增殖等多種生物過(guò)程中發(fā)揮重要的調(diào)控作用〔21〕。電離輻射既可以直接將能量傳遞給DNA從而導(dǎo)致DNA損傷,又可通過(guò)產(chǎn)生大量的自由基及活性氧簇(ROS)對(duì)DNA造成間接損傷。當(dāng)DNA損傷時(shí),細(xì)胞會(huì)激活相應(yīng)的信號(hào)反應(yīng),啟動(dòng)DNA損傷修復(fù)反應(yīng)途徑,觸發(fā)細(xì)胞周期阻滯、細(xì)胞衰老、細(xì)胞凋亡等。對(duì)于嚴(yán)重的DNA損傷,細(xì)胞會(huì)通過(guò)毛細(xì)血管擴(kuò)張共濟(jì)失調(diào)突變基因(ATM)和Rad3相關(guān)激酶(ATR)來(lái)識(shí)別并傳導(dǎo)損傷信號(hào)。當(dāng)細(xì)胞出現(xiàn)雙鏈斷裂,染色質(zhì)構(gòu)造改變產(chǎn)生的信號(hào)會(huì)誘導(dǎo)ATM發(fā)生磷酸化,ATM磷酸化后一方面會(huì)將一些DNA修復(fù)相關(guān)蛋白募集到DNA損傷處,啟動(dòng)DNA損傷修復(fù);另一方面,磷酸化ATM將介導(dǎo)周期監(jiān)測(cè)點(diǎn)蛋白磷酸化,促進(jìn)G1/S、G2/M期阻滯,為DNA修復(fù)提供時(shí)間〔22〕。另外,DNA損傷還可以形成ATM/色素失禁癥相關(guān)基因蛋白(NEMO)二聚體,ATM/NEMO二聚體可以與IKKα/IKKβ結(jié)合形成四聚體,然后磷酸化IKBα激活NF-κB。NF-κB的持續(xù)活化會(huì)阻止細(xì)胞凋亡的發(fā)生,從而導(dǎo)致細(xì)胞的放射耐受。具體來(lái)說(shuō),NF-κB會(huì)與其中的一些下游的靶基因結(jié)合,激活這些基因介導(dǎo)的放射抵抗效應(yīng)〔23〕。另外,NF-κB會(huì)通過(guò)復(fù)雜的信號(hào)通路網(wǎng)絡(luò)將信號(hào)交叉?zhèn)鬟f給蛋白激酶A、磷酯酰激醇-3激酶(PI3)K/蛋白激酶B(AKT)、表皮細(xì)胞生長(zhǎng)因子受體(EGFR)、信號(hào)轉(zhuǎn)錄轉(zhuǎn)錄激活蛋白(JAK-STATs)等信號(hào)通路,從而產(chǎn)生一系列復(fù)雜的生物效應(yīng)影響細(xì)胞凋亡〔24〕。通過(guò)影響這些信號(hào)通路,也可以間接影響NF-κB信號(hào)通路介導(dǎo)的細(xì)胞放射耐受。本實(shí)驗(yàn)結(jié)果提示,CAL-27細(xì)胞中活化的NF-κB表達(dá)較ACC-2細(xì)胞中的高,NF-κB高表達(dá)和持續(xù)活化可能是導(dǎo)致CAL-27細(xì)胞較ACC-2細(xì)胞對(duì)125I粒子更加耐受的原因。本研究結(jié)果發(fā)現(xiàn),當(dāng)NF-κB受到抑制后,兩種細(xì)胞的放射敏感性都大大增強(qiáng),進(jìn)一步說(shuō)明NF-κB差異表達(dá)和活化與ACC-2細(xì)胞和CAL-27細(xì)胞對(duì)放射性125I粒子持續(xù)低劑量率照射不同敏感性具有相關(guān)性。
綜上,在4 Gy的放射性125I持續(xù)低劑量率照射下,ACC-2細(xì)胞輻射敏感性較CAL-27高,ACC-2和CAL-27細(xì)胞的放射敏感性與NF-κB表達(dá)和活性有關(guān),且NF-κB在ACC-2細(xì)胞和CAL-27細(xì)胞中的差異表達(dá)和活化可能是二者對(duì)放射性125I照射不同敏感性的重要因素,其深入的分子機(jī)制需要進(jìn)一步探討。

