靶向EGFR嵌合抗原受體T細胞對胃癌的殺傷作用
丹珠永吉 劉芝蘭 逯艷艷 蔣漢梅
(1青海省人民醫院消化內科,青海 西寧 810000;2青海大學附屬醫院消化內科)
胃癌是我國最常見的消化道惡性腫瘤之一〔1,2〕,發病率及病死率較高,晚期胃癌5年生存率不足20%〔3〕。腫瘤細胞免疫治療是目前腫瘤治療研究領域的熱點〔4〕,嵌合抗原受體T細胞(CAR-T)治療在血液系統腫瘤治療方面取得了振奮人心的療效〔5〕,也有學者研究其在實體腫瘤中的治療效果〔6〕。現已證實表皮生長因子受體(EGFR)與胃癌患者預后生存密切相關,EGFR靶向藥物在臨床工作中已廣泛應用〔7〕。靶向EGFR的CAR-T將抗原抗體結合的特異性與T細胞毒性相結合,有望成為晚期胃癌治療的新方向。本研究通過構建靶向EGFR的CAR-T質粒,探討對胃癌細胞的殺傷作用,以期為胃癌分子靶向治療提供基礎。
1 材料與方法
1.1材料 RPMI1640、胎牛血清(FBS,GIBCO公司,美國)、限制性內切酶BamHI、NcoI(Axygen公司,美國),人淋巴細胞分離液(GE公司,美國)、DNA鏈接酶(TaKaRa公司,日本)、乳酸脫氫酶細胞毒性檢測試劑盒、PL-CD-19-28TM-28BBζ質粒(上海生工生物公司)、胃癌SGC-7901細胞系購自中國科學院上海細胞生物學研究所細胞庫。
1.2抗EGFR嵌合抗原受體逆轉錄病毒載體的構建 外周血單個核細胞(PBMC)的制備:抽取胃癌患者外周血2 ml,肝素抗凝,生理鹽水稀釋,加入淋巴細胞分離液Ficoll,2 000 r/min,室溫離心30 min,收集離心后上層與中層之間的單個核細胞層,制備單個核細胞懸液。全基因合成EGFR單克隆抗體單鏈抗體(ScFv)序列,并加上BamHI、NcoI酶切位點。將合成的ScFv片段及PL-CD-19-28TM-28BBζ質粒用限制性內切酶酶切后,分別切膠回收合成片段和載體片段,16 ℃連接反應3 h(包含酶切產物2 μl,T4DNA連接酶1 μl),挑選陽性克隆的質粒。將逆轉錄病毒包裝載體Peqpam3和質粒混勻,加入外周血單個核細胞(PBMC),加入10%FBS的RPMI1640完全培養基,繼續培養12 d左右,收集T細胞備后續實驗。
1.3流式細胞儀檢測靶向EGFR的CAR-T對胃癌SGC-7901細胞的殺傷作用 將生長狀態良好的胃癌SGC-7901細胞胰酶消化,離心收集,加入EGFR抗體,室溫孵育30 min后,流式細胞儀檢測胃癌SGC-7901細胞EGFR的陽性表達情況,收集培養狀態良好的EGFR(+)的胃癌SGC-7901細胞,將CAR-T與胃癌SGC-7901細胞混合培養4 h,效靶比分別為10∶1、5∶1、1∶1,分別記為10∶1組、5∶1組、1∶1組,加入CellTraceTMCFSE、FarRed示蹤新型染料,使其分別在異硫氰酸熒光素(FITC)、腫瘤抑制基因(APC)通道激發出熒光,檢測FITC、APC通道中激發出熒光細胞的比例,以未轉染T細胞為對照(control組)。
1.4乳酸脫氫酶實驗檢測CAR-T對胃癌SGC-7901細胞的殺傷作用 將濃度1×104/孔的CAR-T和EGFR(+)或EGFR(-)胃癌SGC-7901細胞(效靶比5∶1)200 μl接種于96孔板中混合培養,培養箱中37 ℃、5%CO2共培養0、12、24 h(分別為0 h組、12 h組、24 h組),加入20 μl乳酸脫氫酶釋放試劑,培養箱孵育1 h后4 000 r/min離心5 min后,取上清液100 μl,加入50 μl乳酸脫氫酶檢測工作液,室溫孵育30 min,檢測490 nm處光密度值,殺傷率=1-(實驗組OD值-對照組OD值)/對照組OD值。
1.5酶聯免疫吸附試驗(ELISA)檢測IFN-γ、IL-2的表達 將濃度1×104/孔效能分別為10∶1、5∶1、1∶1的CAR-T與EGFR(+)胃癌SGC-7901細胞100 μl接種于96孔板中混合培養4 h,分別作為10∶1組、5∶1組、1∶1組,加入干擾素(IFN)-γ、白細胞介素(IL)-2抗體,4 ℃過夜,磷酸鹽緩沖液(PBS)洗滌后加入生物素標記的檢測抗體,酶標儀檢測450 nm處的吸光度值。
1.6統計學方法 采用SPSS12.0軟件進行t檢驗、單因素方差分析。
2 結 果
2.1流式細胞儀CAR-T對胃癌SGC-7901細胞的殺傷作用 與control組〔(0.00±0.00)%〕和1∶1組〔(0.42±0.05)%〕比較,5∶1組〔(3.29±1.26)%〕和10∶1組細胞凋亡率〔(3.84±1.17)%〕升高,差異有統計學意義(F=78.54,P<0.001);10∶1組細胞凋亡率高于5∶1組,差異有統計學意義(t=2.262,P<0.05)。見圖1。
2.2乳酸脫氫酶實驗檢測CAR-T對胃癌SGC-7901細胞的殺傷作用 CAR-T、EGFR(+)胃癌SGC-7901細胞共培養0、12、24 h后,CAR-T對胃癌SGC-7901細胞的殺傷作用,隨著時間的延長顯著增加,兩兩比較細胞凋亡率差異均有統計學意義(P<0.05)。CAR-T、EGFR(-)胃癌SGC-7901細胞共培養0、12、24 h后細胞凋亡率差異無統計學意義(P>0.05)。見表1。
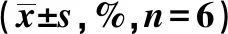
表1 胃癌SGC-7901細胞凋亡水平比較
2.3ELISA檢測IFN-γ、IL-2的表達 5∶1組、10∶1組IFN-γ、IL-2水平高于1∶1組,差異有統計學意義(P<0.05)。10∶1組IFN-γ、IL-2水平高于5∶1組,差異有統計學意義(P<0.05)。見表2。

表2 各組IFN-γ、IL-2水平比較
3 討 論
近年來我國胃癌的發病率呈逐年上升趨勢,但多數患者就診時已屬晚期,雖然隨著胃癌臨床綜合治療的進步,病死率逐年降低,但晚期胃癌患者預后仍不甚理想〔8,9〕。以EGFR/人表皮生長因子受體(HER)2等小分子為靶點的靶向藥物在胃癌治療中也取得了不錯的療效,但亦有研究顯示部分胃癌患者未能獲益〔10~13〕,表明EGFR在胃癌發生發展中的病理機制中仍有待于進一步研究。
腫瘤免疫治療就是通過重新啟動并維持腫瘤-免疫循環,恢復機體正常的抗腫瘤免疫反應,從而達到抗腫瘤作用,包括單克隆抗體類免疫檢查點抑制劑、治療性抗體、癌癥疫苗、細胞治療和小分子抑制劑等〔14,15〕。但由于腫瘤細胞免疫原性差、腫瘤患者免疫功能低下等原因,胃癌患者T細胞很難起到殺傷腫瘤細胞作用〔16〕。腫瘤過繼免疫治療是通過基因工程將表達靶向腫瘤特異性抗原的嵌合抗原受體T細胞輸至患者體內,以增強T細胞殺傷腫瘤細胞的作用〔17〕。目前CAR-T在血液系統腫瘤及胰腺癌、肺 癌等惡性實體瘤治療中已廣泛開展〔18,19〕。
EGFR是原癌基因C-erbB-1的表達產物,通過與配體表皮生長因子結合促進腫瘤細胞增殖、侵襲,研究報道EGFR在胃癌組織中過表達,與胃癌患者預后密切相關〔20,21〕。本研究結果顯示,EGFR(+)胃癌SGC-7901細胞能誘導CAR-T釋放IFN-γ、IL-2,且具有濃度依賴,與以前的研究〔20,21〕結果相似。
EGFRⅢ是EGFR基因產物之一,僅在惡性治療細胞中表達,而在正常組織中無表達〔22〕,因此,靶向EGFR的CAR-T對惡性實體瘤治療具有重要意義。有學者對11例難治性非小細胞肺癌患者進行靶向EGFR的CAR-T臨床研究,結果顯示2例部分緩解,5例病情穩定〔23〕,表明靶向EGFR的CAR-T在實體腫瘤的治療中具有重要價值。
綜上,本研究成功構建了靶向EGFR的嵌合抗原受體修飾T細胞,通過釋放IFN-γ、IL-2對EGFR陽性的胃癌SGC-7901細胞起到了殺傷作用,為胃癌的免疫治療奠定基礎。

