益氣活血清熱解毒方對ApoE-/-小鼠動脈粥樣硬化的保護作用
劉志勇 任德啟 郭健 趙彥青 楊明輝 李鋒森 成家宏
(1河南中醫藥大學第二臨床醫學院,河南 鄭州 450046;2河南省中醫院)
心血管系統疾病是世界范圍內死亡率極高的一大類疾病,動脈粥樣硬化是多種心血管系統疾病如心肌梗死、腦卒中等的病理基礎,動脈粥樣硬化受到基因、飲食習慣等的影響〔1,2〕。動脈粥樣硬化疾病是一種慢性多因性疾病,多與年老體虛有關,本課題認為,動脈粥樣硬化為本虛標實證,虛、痰、瘀、毒為基本致病因素,氣陰兩虛,痰瘀毒互結為其基本病機,益氣活血清熱解毒為其基本治法。益氣活血清熱解毒組中藥由制首烏、全蝎、水蛭、天麻、膽南星、蜈蚣、決明子、太子參、桃仁和紅花等組成。既往研究顯示,中風防治靈(由制首烏、全蝎、大黃、膽南星、決明子、水蛭、天麻、太子參組成)能夠改善血脂,擴張腦血管〔3,4〕。現階段尚未發現關于益氣活血清熱解毒方對動脈粥樣硬化小鼠的作用研究。本研究探討益氣活血清熱解毒方對動脈粥樣硬化的保護作用及可能機制。
1 材料與方法
1.1材料 SPF級別ApoE-/-小鼠,8周齡,體質量18~19 g,購自河南省中醫院實驗中心;Janus酪氨酸蛋白激酶(JAK)1抗體購自南京建成生物工程研究所;總膽固醇(TC)檢測試劑盒購自北京索萊寶科技有限公司;磷酸化(p)-信號轉導及轉錄激活因子(STAT)3抗體購自美國Santa Cruz;三酰甘油(TG)檢測試劑盒購自上海信帆生物科技有限公司;低密度脂蛋白膽固醇(LDL-C)檢測試劑盒購自上海信帆生物科研所;p-JAK1抗體購自美國Abcam;高密度脂蛋白膽固醇(HDL-C)檢測試劑盒購自通蔚試劑(上海)有限公司;STAT3抗體購自武漢艾美捷科技有限公司;益氣活血清熱解毒方、脂泰寧膠囊、黃連由河南中醫藥大學第二附屬醫院中藥房提供;辛伐他汀片購自杭州默沙東制藥有限公司。
1.2動脈粥樣硬化小鼠模型構建〔5〕和分組處理 SPF級別ApoE-/-小鼠分成:普通飼料組、模型組、黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組,普通飼料組給予正常飼料飼喂,其余幾組均給予高脂飼料(0.15%膽固醇、78.85%基礎飼料、21.00%脂肪)飼喂,飼喂12 w后,隨機選擇2只小鼠處死,蘇木素-伊紅(HE)染色觀察易損斑形成,視為造模成功。普通飼料組、模型組、黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組小鼠各10只。從第13周開始,黃連組用黃連藥液(黃連6 g溶于70 ml蒸餾水)按照9 ml/(kg·d)劑量灌胃,脂泰寧組用脂泰寧藥液(脂泰寧膠囊,相當于制首烏20 g,山楂25 g,澤瀉15 g,決明子12 g,絞股藍15 g,溶于70 ml蒸餾水中)按照9 ml/(kg·d)劑量灌胃,辛伐他汀組用辛伐他汀藥液(20 mg辛伐他汀溶于70 ml蒸餾水)按照9 ml/(kg·d)劑量灌胃,益氣活血清熱解毒組小鼠用益氣活血清熱解毒藥液(顆粒劑,太子參15 g,制首烏20 g,水蛭8 g,天麻15 g,膽南星8 g,全蝎8 g,決明子20 g,蜈蚣6 g,桃仁10 g,紅花10 g,黃連6 g,溶解在70 ml的蒸餾水中)按照9 ml/(kg·d)劑量灌胃,普通飼料組、模型組以等量的生理鹽水代替。連續灌胃8 w。
1.3各組小鼠體質量測定 從第12周開始,每間隔2 w檢測小鼠體質量,繪制生長曲線。
1.4血脂指標TC、TG、LDL-C、HDL-C檢測 最后一次給藥結束后12 h,眼眶靜脈叢采血,3 453 r/min離心10 min,分離血清,分別檢測TC、TG、LDL-C、HDL-C水平,步驟完全按照TC、TG、LDL-C、HDL-C檢測試劑盒的說明書進行。
1.5動脈粥樣硬化斑塊面積檢測 采血結束后,斷椎法將小鼠處死,分離小鼠主動脈組織,在光學顯微鏡下觀察主動脈情況,以計算機圖像處理軟件計算斑塊面積和主動脈管腔的面積百分比例。
1.6白細胞介素(IL)-6、IL-1β、細胞間黏附分子(ICAM)-1、血管細胞黏附分子(VCAM)-1 mRNA表達檢測 采血結束后,斷椎法將小鼠處死,分離小鼠主動脈組織,以實時聚合酶鏈反應(Realtime PCR)方法檢測 IL-6、IL-1β、ICAM-1、VCAM-1 mRNA表達差異。在小鼠主動脈組織中添加Trizol試劑,反復吹打混合,在冰上反應20 min,常規方法提取組織中的總RNA,添加50 μl的焦碳酸二乙酯(DEPC)水將RNA溶解,經過紫外分光光度計檢測濃度。反轉錄合成cDNA,在1.5 μg的RNA中添加1 μl的Random Hexamers、1 μl的dNTPs,最后添加DEPC水至12.5 μl,在65 ℃孵育5 min,置于冰上孵育5 min,繼續添加4 μl的5×緩沖液、2 μl的二硫蘇糖醇(DTT)、0.5 μl的反轉錄酶(M-MLV)、1 μl的RNaseOUT,置于37 ℃孵育52 min,70 ℃孵育15 min,將合成的cDNA放在-20 ℃保存。以cDNA作為模板,按照SYBR Realtime PCR master mix進行PCR,條件如下:0.5 μl的cDNA、10 μl的qPCR master mix、1 μl的上游及下游引物,添加ddH2O至20 μl,PCR程序為:95 ℃預變性15 min,95 ℃變性10 s,60 ℃退火20 s,72 ℃延伸30 s,設置40個循環。β-actin作為內參,根據得到的Ct值,按照2-△△Ct方法分析目的基因的表達變化。β-actin上游引物:5′-GGGAAATTCAACGGCACAGT-3',下游:5′-AGATGGTGATGGGCTTCCC-3′,IL-6上游引物:5′-TGAACT-CCTTCTCCACAAGC-3',下游:5'-ATCCAGATTGGAAGCATCCA-3',IL-1β上游引物:5'-CCAAGGAG-ACGGAATACAGG-3′,下游:5′-GTGTTGGTTGTAG-AGGGCAAG-3′,ICAM-1上游引物:5′-TCAGGTATCCATCCATCCCA-3′,下游:5′-CGGTGCCACAGTTCTCAAAG-3′,VCAM-1上游引物:5′-GATAGACAGCCCACTAAACG-3′,下游:5′-TGGAGCCAAACACTTGAC-3′。
1.7p-JAK1、JAK1、p-STAT3、STAT3蛋白表達檢測 采血結束后,斷椎法將小鼠處死,分離小鼠主動脈組織,Western印跡檢測p-JAK1、JAK1、p-STAT3、STAT3蛋白表達。在小鼠主動脈組織中添加RIPA裂解試劑,充分裂解以后,在4 ℃,8 459 r/min離心10 min,吸取上清溶液,按照二喹啉甲酸(BCA)方法檢測蛋白濃度。在蛋白樣品中添加2×上樣緩沖液,混合后,放在100 ℃煮沸5 min。按照常規方法配制十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)(10%分離膠,5%濃縮膠),用移液槍分別在每個上樣孔內添加30 μg的蛋白樣品,在濃縮膠內以80 V的電壓進行電泳,在分離膠中以120 V的電壓進行電泳。電泳結束以后,將凝膠取出,浸泡在轉移緩沖液中備用。把NC膜置于甲醇中浸泡10 s,然后置于轉移緩沖液中備用。根據常規方法進行轉膜,轉膜操作需要在冰上進行。設置轉膜電壓為100 V,轉膜時間為2 h。將NC膜放在含有5%牛血清白蛋白的TBST中,轉移到室溫孵育2 h。將NC膜放在含有一抗溶液的平皿內(p-JAK1抗體、p-STAT3抗體按照1∶800稀釋,STAT3抗體、JAK1抗體按照1∶1 200稀釋),放在4 ℃結合過夜。最后將NC膜放在二抗溶液內(二抗按照1∶4 000稀釋),在室溫反應2 h。按照ECL顯色試劑盒顯色。以β-actin作為內參,根據灰度值分析目的蛋白的表達變化。灰度值分析用ImageJ進行。
1.8統計學分析 采用SPSS21.0軟件進行t檢驗、方差分析。
2 結 果
2.1益氣活血清熱解毒方對動脈粥樣硬化小鼠體質量影響 普通飼料組16、18、20 w體質量明顯低于模型組,黃連組、脂泰寧組18、20 w體質量明顯低于模型組,益氣活血清熱解毒組、辛伐他汀組16、18、20 w體質量均明顯低于模型組,并且黃連組、脂泰寧組18、20 w體質量明顯高于益氣活血清熱解毒組、辛伐他汀組(均P<0.05)。見表1。

表1 各組體質量變化比較
2.2益氣活血清熱解毒方對動脈粥樣硬化小鼠血脂影響 與普通飼料組比較,模型組TC、TG和LDL-C水平明顯升高,HDL-C水平明顯降低(P<0.05);與模型組比較,黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組TC、TG和LDL-C水平明顯降低,HDL-C水平明顯升高(P<0.05);并且與黃連組、脂泰寧組比較,益氣活血清熱解毒組TC、TG和LDL-C水平明顯降低,HDL-C水平明顯升高(P<0.05)。見表2。
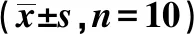
表2 各組血脂指標、斑塊面積比較
2.3益氣活血清熱解毒方對動脈粥樣硬化小鼠斑塊面積影響 與普通飼料組比較,模型組動脈粥樣硬化斑塊面積明顯增加(P<0.05);與模型組比較,黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組動脈粥樣硬化斑塊面積明顯減小(P<0.05);與黃連組、脂泰寧組比較,益氣活血清熱解毒組動脈粥樣硬化斑塊面積明顯減小(P<0.05)。見表2。
2.4益氣活血清熱解毒方對動脈粥樣硬化小鼠炎癥介質影響 與普通飼料組比較,模型組IL-6、IL-1β、ICAM-1、VCAM-1 mRNA水平明顯增加(P<0.05);與模型組比較,黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組IL-6、IL-1β、ICAM-1、VCAM-1 mRNA水平明顯降低(P<0.05);與黃連組、脂泰寧組比較,益氣活血清熱解毒組IL-6、IL-1β、ICAM-1、VCAM-1 mRNA水平明顯降低(P<0.05)。見表3。
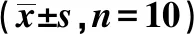
表3 各組主動脈炎癥因子IL-6、IL-1β、ICAM-1、VCAM-1 mRNA、p-JAK1/JAK1、p-STAT3/STAT3蛋白表達水平比較
2.5益氣活血清熱解毒方對動脈粥樣硬化小鼠JAK/STAT3信號通路的影響 與普通飼料組比較,模型組p-JAK1/JAK1、p-STAT3/STAT3蛋白水平明顯增加(P<0.05);與模型組比較,黃連組、脂泰寧組、益氣活血清熱解毒組、辛伐他汀組p-JAK1/JAK1、p-STAT3/STAT3蛋白水平明顯降低(P<0.05);與黃連組、脂泰寧組比較,益氣活血清熱解毒組小鼠p-JAK1/JAK1、p-STAT3/STAT3蛋白水平明顯降低(P<0.05)。見表3。
3 討 論
動脈粥樣硬化最初的表現為大、中動脈出現脂質條紋,含有大量的脂蛋白殘粒、LDL,血液中大量的LDL沉積在動脈分支,導致內皮細胞被激活,引起炎癥反應〔6~8〕。LDL還可以刺激內皮細胞釋放更多的趨化因子,誘導ICAM-1、VCAM-1等表達,加強單核細胞的黏附,最終形成動脈粥樣硬化斑塊〔9,10〕。IL-6、IL-1β是在動脈粥樣硬化中表達上調的炎癥因子,二者表達增加后誘導機體炎癥反應,加重組織損傷〔11~14〕。
益氣活血清熱解毒方是由太子參、制首烏、水蛭、天麻、膽南星、全蝎、決明子、蜈蚣、桃仁和紅花等組成的,臨床上已經證明其具有改善脂代謝等作用〔3,4〕。本實驗結果表明,益氣活血清熱解毒方改善動脈粥樣硬化血脂、炎癥,減少動脈粥樣硬化斑塊形成,益氣活血清熱解毒方有動脈粥樣硬化保護作用。黃連具有清熱解毒的功效,脂泰寧有益氣活血的作用〔15,16〕。本實驗還比較了益氣活血清熱解毒方與單純黃連或脂泰寧的治療效果,發現益氣活血清熱解毒方對動脈粥樣硬化血脂、炎癥和斑塊形成的改善作用均優于單純黃連或脂泰寧的治療效果。
中藥發揮藥理學作用的機制十分復雜,很多研究已經證明中藥能夠通過影響信號通路的轉導發揮作用〔17~19〕。JAK是非受體型酪氨酸激酶,在胚胎發育過程中具有重要作用,STAT3是STAT蛋白家族成員,其可以被IL-6等相關細胞因子激活〔20,21〕。JAK/STAT3信號通路傳導途徑大致可以表述為:細胞因子與受體相互結合后,誘導受體分子發生二聚化,導致和受體耦聯的JAK發生磷酸化,磷酸化的JAK能夠催化受體酪氨酸發生磷酸化,形成STAT3停靠位點,導致STAT3發生磷酸化,STAT3形成二聚體進入細胞核,進而調控下游基因的表達〔22〕。JAK/STAT3參與調控炎癥、細胞生長、氧化應激等多個過程,并且與疾病進展有關〔23〕。研究顯示,JAK/STAT3在動脈粥樣硬化中過度激活,JAK/STAT3信號加重疾病進程〔24,25〕。本研究結果顯示,益氣活血清熱解毒方明顯降低了ApoE-/-小鼠動脈粥樣硬化模型中p-JAK1/JAK1、p-STAT3/STAT3蛋白水平,益氣活血清熱解毒方抑制JAK/STAT3信號激活,益氣活血清熱解毒方可能通過JAK/STAT3信號發揮動脈粥樣硬化保護作用。
綜上,益氣活血清熱解毒方改善動脈粥樣硬化炎癥、血脂,減少斑塊形成,機制可能與JAK/STAT3信號有關,這為中西醫治療和預防動脈粥樣硬化相關疾病奠定了基礎。現階段尚不明確益氣活血清熱解毒方通過何種機制影響JAK/STAT3信號進而改善動脈粥樣硬化,在以后實驗中會進行深入探討。

