中美兒科Ⅰ期臨床試驗注冊現狀比較研究
陳卓如 劉雨菁 錢莉玲 朱海濤 施鵬
(復旦大學附屬兒科醫院臨床研究中心 上海 201102)
早期臨床試驗是臨床研究機構開展臨床試驗創新性的一個重要標志,許多重大的科學發現來源于首次應用于人體的Ⅰ期臨床試驗[1]。Ⅰ期臨床試驗是初步的臨床藥理學及人體安全性評價試驗,為進入Ⅱ期臨床試驗做準備,在創新藥物的研發中發揮首要作用[1]。美國國立衛生研究院(National Institutes of Health,NIH)臨床研究中心將“成為Ⅰ期臨床試驗的全球領導者”作為戰略規劃中的首要目標[2]。然而,Ⅰ期臨床試驗存在很大的不確定性,且在兒科領域開展風險更高、難度更大。目前,尚缺乏針對兒科領域Ⅰ期臨床試驗開展情況的調查數據[3-4]。本研究基于ClinicalTrials.gov 注冊平臺,比較中美兩國兒科Ⅰ期臨床試驗注冊現狀,為推進我國兒科早期臨床試驗提供依據。
1 資料與方法
1.1 數據來源
選擇ClinicalTrials.gov 為臨床試驗注冊平臺,檢索兒科臨床試驗注冊現狀。
1.2 數據采集與整理
檢索起止時間從建庫至2022 年8 月16 日,檢索年齡范圍為兒童(出生~17 歲)。同一注冊項目涉及不同地區、試驗分期、研究類型時,分別記入不同地區、試驗分期、研究類型。招募患兒年齡分期為:≤28 d 為新生兒期;>28 d,<1 周歲為嬰兒期;≥1 周歲,<3周歲為幼兒期;≥3 周歲,<7 周歲為學齡前期;≥7周歲,<10 周歲為學齡期;≥10 周歲,<18 周歲為青春期。
發起者特征根據資金來源分為企業發起的臨床試驗(industry-sponsored trial,IST)和研究者發起的臨床試驗(investigator-initiated trial,IIT)。臨床試驗治療領域按照《疾病和有關健康問題的國際統計分類》[5](簡稱ICD-10)分類標準進行分類。
1.3 統計學分析
分類資料采用n(%)進行統計描述,其中不同國家兒科Ⅰ期臨床試驗占比為某國Ⅰ期臨床試驗注冊數占該國臨床試驗注冊總數的比例。分析中美兩國臨床試驗數量和試驗分期分布,比較中美兒科Ⅰ期臨床試驗注冊的時間趨勢、受試者年齡分布、研究狀態、發起者特征、治療領域分布等。構成比組間比較采用χ2檢驗。采用R統計學軟件進行統計分析,P<0.05 提示差異有統計學意義。
2 結果
2.1 中美兒科臨床試驗注冊數量和試驗分期比較
截至2022 年8 月16 日,全球在ClinicalTrials.gov 平臺上已注冊兒科臨床試驗84 112 項,其中Ⅰ期臨床試驗6 170 項(占7.3%)。兒科臨床試驗注冊數量居前十的國家依次為美國、中國、加拿大、法國、英國、德國、意大利、西班牙、埃及、土耳其和比利時。Ⅰ期臨床試驗占比中國(8.7%)及其他國家均低于美國(12.0%)(表1)。
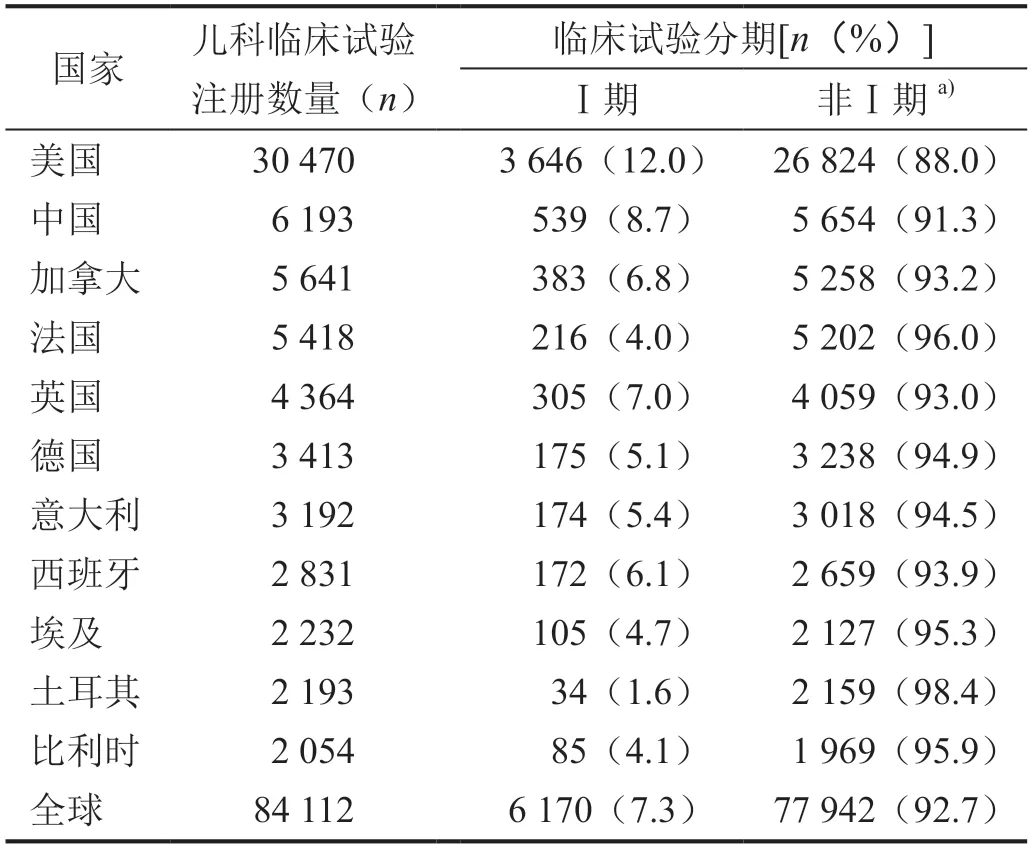
表1 兒科臨床試驗注冊數量前10位國家不同分期臨床試驗構成
2.2 中美兒科Ⅰ期臨床試驗注冊時間趨勢比較
近10 年,美國Ⅰ期兒科臨床試驗注冊數量基本保持穩定,Ⅰ期臨床試驗占比維持在10%左右。中國Ⅰ期兒科臨床試驗注冊數增長迅速,注冊數從2012 年12 項增長到2021 年69 項,占比從5.6%增長到9.0%(圖1)。
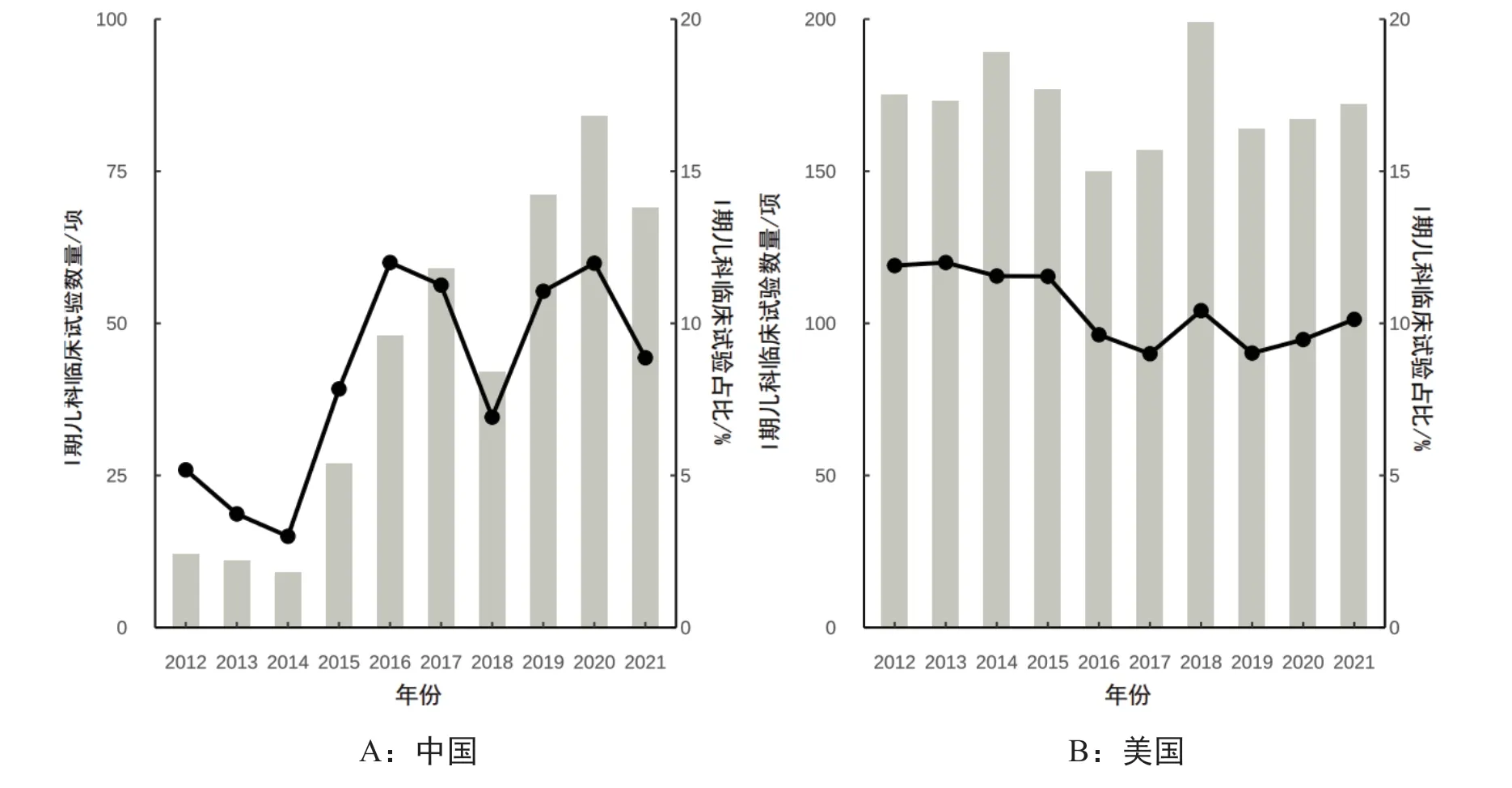
圖1 2012—2021年中美Ⅰ期兒科臨床試驗注冊時間趨勢
2.3 中美兒科Ⅰ期臨床試驗招募人數構成比較
中國招募已結束的Ⅰ期臨床試驗數為102 項(18.9%),遠低于美國2 142 項(58.7%)。而中國臨床試驗處于未知狀態的比例為34.0%,高于美國的2.8%;處于招募中的試驗比例為33.0%,高于美國的15.1%(表2,P<0.001)。

表2 中美兒科Ⅰ期臨床試驗特征比較[n(%)]
在招募已結束的臨床試驗中,中國招募人數在1~50 人的Ⅰ期臨床試驗比例為53.9%,低于美國的69.6%;而招募人數>400 人的Ⅰ期臨床試驗占比為3.9%,高于美國的2.2%(表2,P<0.001)。
2.4 中美兒科Ⅰ期臨床試驗招募人群起始年齡分布比較
在兒科Ⅰ期臨床試驗招募人群起始年齡分布方面,中國在新生兒期、學齡期的比例低于美國,但嬰兒期、幼兒期、學齡前期、青春期的比例高于美國(表2,P<0.001)。
2.5 中美兒科Ⅰ期臨床試驗研究狀態及發起方特征
中國Ⅰ期注冊臨床試驗中IIT 占比為56.6%,低于美國的67.9%(表2,P<0.001)。
2.6 中美兒科Ⅰ期臨床試驗治療領域比較
美國Ⅰ期兒科藥物臨床試驗居于前5 位治療領域分別為腫瘤(26.8%)、傳染病和寄生蟲病(5.5%)、內分泌、營養和代謝疾病(4.4%)、神經系統疾病(3.1%)、血液系統(2.7%),中國相對應用領域占比分別為17.6%、1.2%、1.2%、0.7%、2.2%,傳染病、內分泌、營養和代謝疾病、神經系統疾病遠低于美國(表3,P<0.05)。在基因治療、器械和行為方面,兩國治療領域分布差異無統計學意義(P>0.05)。基因治療臨床試驗中美兩國治療領域居首位的均為腫瘤領域;器械方面的Ⅰ期臨床試驗,美國腫瘤領域有15 項(0.4%),而中國無相關臨床試驗;行為方面的Ⅰ期臨床試驗,美國精神和行為障礙領域有101 項(2.7%),中國有3 項(0.5%)。
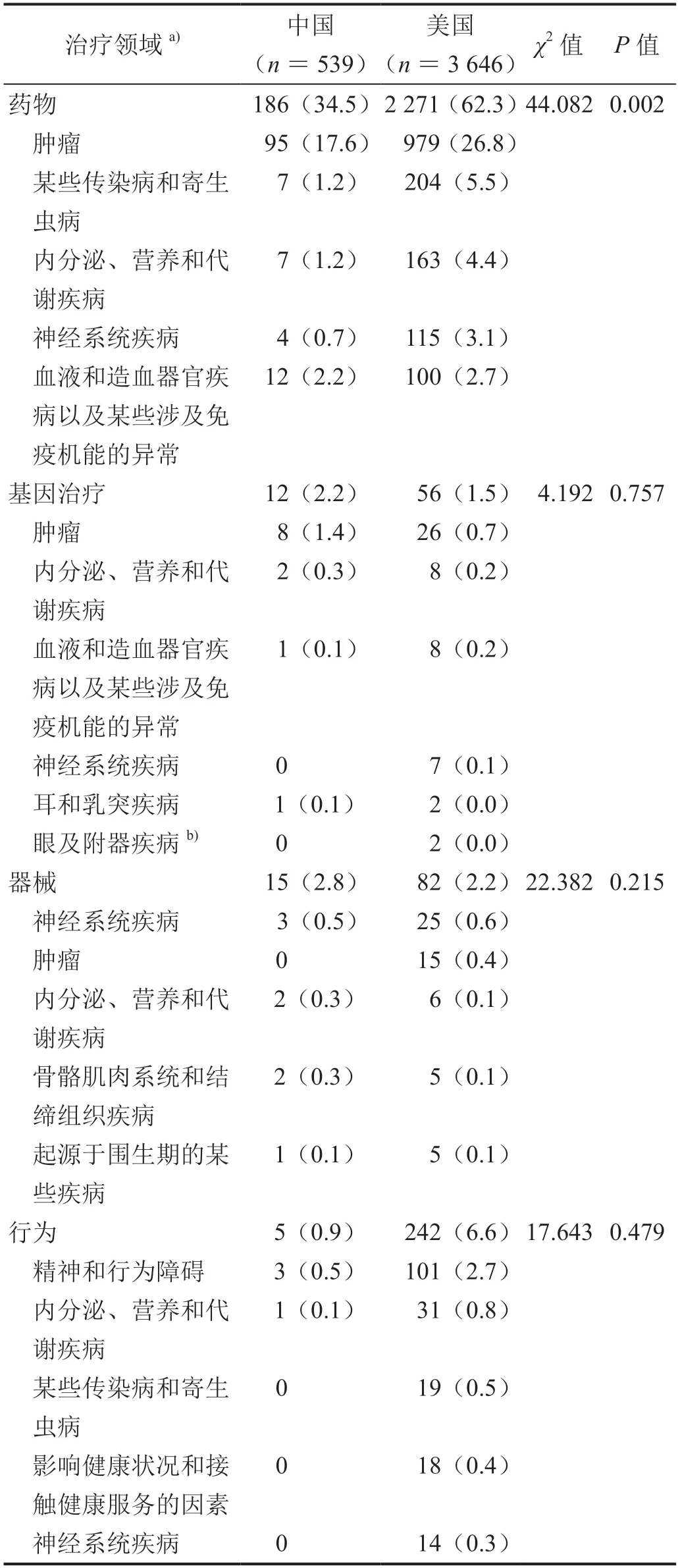
表3 中美兒科Ⅰ期臨床試驗治療領域分布[n(%)]
3 討論
目前,兒童用藥短缺、實際處方中超說明書用藥情況嚴重,對臨床治療效果和患者安全帶來巨大的隱患。2016 年,李逸云等[6]對我國78 家醫院兒童用藥的調查分析顯示,高達68.96%的藥品為非兒童用藥,而兒童專用藥品僅占0.70%。2017 年,梅枚等[7]對我國436 家醫院的兒童超說明書用藥情況進行調查,結果顯示,63.8%的醫生曾開具超說明書用藥處方。超說明書用藥可能導致不良反應發生率顯著增加[8]。臨床試驗是藥品上市前必不可少的環節。兒童的生理、行為、代謝、激素等與成人不同,且處于生長發育階段,成人臨床試驗的結果無法簡單地應用于兒童,大多兒童藥物缺乏臨床試驗數據。然而,因成本高、利潤低、倫理問題、招募困難、試驗的復雜程度和風險遠高于成人等,兒科臨床試驗的開展面臨巨大的挑戰,尤其是作為首次人體試驗的Ⅰ期臨床試驗。
中國兒科Ⅰ期臨床試驗雖然在近十年發展較快,但注冊項目數量和臨床試驗占比與美國仍存在較大差距。我們研究發現超30%的兒科臨床試驗在美國開展,且美國Ⅰ期臨床試驗比例遠高于我國。美國早在1997 年就意識到新藥研究公開試驗信息的必要性,并于2004 年明確提出只有在征集首位患者之前就進行注冊,才會考慮發表對應的研究結果[4]。此外,美國對Ⅰ期臨床試驗關注度較高,NIH 臨床研究中心在成立65 周年時的戰略報告中指出,其許多重大的科學發現是在Ⅰ期臨床試驗中探索而得,并將繼續引領全球的首次人體試驗作為今后目標之一[9]。而我國兒科臨床試驗起步較晚。2003 年國家藥品監督管理局頒布的《藥物臨床試驗質量管理規范》正式將兒童納入藥物臨床試驗對象[10]。自2011 年開始,我國采取一系列措施鼓勵兒童專用藥品研發和生產[11-12]。與本研究結果相似,Wu 等[13]的研究顯示2009—2019 年,在中國內地開展的兒科藥物臨床試驗數量急速上升,尤其是自2016 年開始,數量顯著上升。然而我國內地臨床試驗開展的地理分布并不均衡。Wu 等[13]的研究顯示臨床試驗的牽頭單位主要分布在華東、華北、華中。Song等[14]根據中國臨床實驗注冊中心數據庫,發現應用于上市和審批的藥物臨床試驗,其主要研究人員在北京的數量遠遠高于其他省級行政區。這種地理分布的不均衡很大一部分來源于臨床醫療資源分布的不均,尤其是獲批開展兒科臨床試驗的臨床機構的分布。
Ⅰ期兒科臨床試驗適用對象和領域有待進一步提高。本研究發現,美國Ⅰ期兒科臨床試驗納入人群的年齡起始于新生兒期的比例遠高于中國。兒童在不同生長發育期具有不同的生理特征,對藥物的反應也大相徑庭。器官不成熟、屏障未建立等因素讓新生兒期成為更特殊的一個時期。然而新生兒中超說明書用藥情況卻非常嚴峻,高達90%[15]。對藥物的迫切需求與不同生長發育階段的臨床試驗數據的短缺之間的矛盾是目前Ⅰ期兒科臨床試驗面臨的一大問題。無論中國還是美國,兒科小樣本量(1~50 人)的Ⅰ期臨床試驗的比例較高。兒科早期臨床試驗,其風險較高,實施的難度較大,所需的成本遠高于成人,故往往納入的患者數量較少。雖然小樣本量的研究可行性更高,但可能會導致結果的穩健性較差。此外,中國研究狀態處于不明的Ⅰ期臨床試驗比例遠遠高于美國。考慮到研究者發起的IIT 的比例較高,而IIT 研究雖然緊貼臨床需求,但欠缺規范化的指導、充足的經費、優化的試驗方案和企業所擁有的標準操作規程及監查稽查,在設計和管理上相對不足。
我國Ⅰ期兒科臨床試驗在腫瘤等領域發展較好,但在其他疾病和器械及行為方面的臨床試驗有所短缺,并且市場成熟的生物藥占據了很大比例。以精神和行為障礙疾病為例,相比起美國,我國對此類疾病的臨床試驗較少,并且關注度不足。而Li 等[16]對5 個省73 992 名6~16 歲學齡兒童進行精神障礙患病調查,結果顯示精神疾病的加權患病率高達17.5%。此外,相比起美國,我國行為方面的臨床試驗近乎空白。
此外,本研究存在一些局限。第一,本研究基于ClinicalTrials.gov 注冊平臺比較中美臨床試驗注冊情況,未納入中國臨床試驗注冊中心(Chinese Clinical Trial Registry,ChiCTR)等其他臨床試驗注冊平臺數據,可能低估了中國的兒科臨床試驗數據。第二,本研究中美治療領域比較,僅根據注冊疾病的ICD-10 編碼進行治療領域劃分,未進一步分析注冊項目的藥物及產品,無法對治療領域的具體研究方向做出提示。
4 結論
近十年來,中國政府一直致力于生物產業的發展,鼓勵開展兒科臨床試驗、推動兒童藥物的研發生產,以期促進兒童健康。與美國相比,還應鼓勵研究者發起的Ⅰ期兒科臨床試驗,在新生兒臨床試驗,以及藥物、器械和行為等相關治療領域研究獲得進一步發展。

