中性粒細(xì)胞與淋巴細(xì)胞比值對(duì)晚期胃癌患者療效及預(yù)后的預(yù)測(cè)價(jià)值研究
王冬慧,荀玉芳,高曉鵬,郭 瑋,王振華,賈 莉
(山西省運(yùn)城市中心醫(yī)院腫瘤科,山西 運(yùn)城 044000)
胃癌是目前發(fā)病率較高的惡性腫瘤之一,該病早期無(wú)典型癥狀,易被忽視,大部分患者確診時(shí)腫瘤已發(fā)展到了晚期,導(dǎo)致患者療效不佳、預(yù)后較差[1]。早期胃癌患者經(jīng)內(nèi)鏡或手術(shù)治療可獲得理想的預(yù)后,但我國(guó)內(nèi)鏡的普及率較晚,且一些基層醫(yī)院的醫(yī)生對(duì)內(nèi)鏡操作技術(shù)不是特別擅長(zhǎng),因此導(dǎo)致患者治療方案缺乏、治療效果差、生存期短[2]。對(duì)胃癌患者進(jìn)行全面科學(xué)且準(zhǔn)確的診斷評(píng)估,對(duì)于患者的治療及預(yù)后均有較高的價(jià)值。目前,臨床上對(duì)于胃癌患者治療效果及預(yù)后的評(píng)估多采用腫瘤TNM 分期,但臨床常出現(xiàn)患者評(píng)估為相同TNM 分期而預(yù)后效果差異較大的問(wèn)題[3-4]。中性粒細(xì)胞與淋巴細(xì)胞比值(NLR)是近年來(lái)備受關(guān)注的反映惡性腫瘤患者預(yù)后的指標(biāo)之一,已應(yīng)用于多種惡性腫瘤患者的預(yù)后評(píng)估中[5]。本研究以晚期胃癌患者為對(duì)象,探討NLR 對(duì)晚期胃癌患者治療效果及預(yù)后的預(yù)測(cè)價(jià)值,現(xiàn)報(bào)道如下。
1 資料與方法
1.1 臨床資料
選 擇2021 年1 月 至2021 年10 月 在 我 院 經(jīng) 組織學(xué)或細(xì)胞學(xué)檢查確診為不可切除的晚期胃癌患者60 例為研究對(duì)象。其中,男38 例,女22 例,年齡36 ~82 歲,平均(60.19±6.43)歲;體質(zhì)指數(shù)(BMI)18.6 ~30.2 kg/m2,平 均(21.69±3.23)kg/m2;腫瘤分期:Ⅲ期39 例,Ⅳ期21 例;手術(shù)史:有23 例,無(wú)37 例;化療方案:XELOX 方案28 例,DCF 方案32 例;腫瘤分化類(lèi)型:低分化37 例,高分化15 例,中分化8 例。
1.2 納入及排除標(biāo)準(zhǔn)
納入標(biāo)準(zhǔn):(1)經(jīng)組織學(xué)或細(xì)胞學(xué)檢查確診為胃腺癌;(2)不具備手術(shù)指征,開(kāi)展晚期一線化療;(3)之前未接受過(guò)抗腫瘤治療;(4)肝腎功能無(wú)異常,病情尚穩(wěn)定,(5)家屬已簽署參與研究的知情同意書(shū)。排除標(biāo)準(zhǔn):(1)合并血液系統(tǒng)疾病、免疫系統(tǒng)疾病或代謝性疾病;(2)骨髓造血功能異常;(3)伴有嚴(yán)重感染。
1.3 方法
1.3.1 治療方法 所有患者均行化療(化療方案以XELOX 方案和DCF 方案為主),具體方法如下:(1)XELOX 方案。第1 d,取奧沙利鉑(生產(chǎn)廠家:四川美大康佳樂(lè)藥業(yè)有限公司;批準(zhǔn)文號(hào):國(guó)藥準(zhǔn)字H20050141;規(guī)格:每100 mL 含奧沙利鉑0.1 g 與甘露醇5.1 g)靜脈滴注,劑量130 mg/m2;第1 ~14 d,取卡培他濱片(生產(chǎn)廠家:正大天晴藥業(yè)集團(tuán)股份有限公司;批準(zhǔn)文號(hào):國(guó)藥準(zhǔn)字H20143044;規(guī)格:0.5 g)口服,每次1000 mg/m2,每天2 次。(2)DCF 方案。第1 d,取多西他賽(生產(chǎn)廠家:湘北威爾曼制藥股份有限公司;批準(zhǔn)文號(hào):國(guó)藥準(zhǔn)字H20093967;規(guī)格:2 mL:80 mg)靜脈滴注,劑量75 mg/m2,1 h 內(nèi)滴注完畢;第1 ~5 d,取氟尿嘧啶(生產(chǎn)廠家:遠(yuǎn)大醫(yī)藥黃石飛云制藥有限公司;批準(zhǔn)文號(hào):國(guó)藥準(zhǔn)字H20051137 ;規(guī)格:按氟尿嘧啶算0.25 g)靜脈滴注,劑量750 mg/m2,持續(xù)滴注24 h,之后通過(guò)化療泵持續(xù)靜脈泵注120 h ;第1 d,取順鉑(生產(chǎn)廠家:錦州九泰藥業(yè)有限責(zé)任公司;批準(zhǔn)文號(hào):國(guó)藥準(zhǔn)字H21020212,規(guī)格;20 mg)靜脈滴注,劑量75 mg/m2。入組患者化療前均給予護(hù)肝、保胃、止吐等對(duì)癥支持治療,每3 周為1 個(gè)周期,連續(xù)治療6 周(2 個(gè)周期)。
1.3.2 NLR 對(duì)晚期胃癌患者治療效果及預(yù)后的預(yù)測(cè)價(jià)值 (1)血液標(biāo)本采集。分別于治療前、化療結(jié)束后次日采集患者的外周空腹靜脈血5 mL,離心30 min,轉(zhuǎn)速3000 rpm,離心半徑10 cm,分離出血清并置于冰箱中冷藏備用。(2)檢測(cè)方法。采用全自動(dòng)生化分析儀檢測(cè)血清中中性粒細(xì)胞、淋巴細(xì)胞水平,并計(jì)算NLR ;化療前采用ROC 曲線確定NLR 的最佳截點(diǎn),并據(jù)此將患者分為高NLR 組和低NLR 組。查閱兩組的病歷資料,分析兩組不同病理水平的差異,并完成多因素Logistic 回歸分析。(3)治療效果及預(yù)后預(yù)測(cè)。化療完畢后,以NLR2.0 為截?cái)嘀担容^兩組的療效:參考實(shí)體瘤新的療效評(píng)價(jià)標(biāo)準(zhǔn)對(duì)療效進(jìn)行評(píng)價(jià)[6],分別從完全緩解(CR)、部分緩解(PR)、穩(wěn)定(SD)和疾病進(jìn)展(PD)四個(gè)方面進(jìn)行評(píng)估,總有效率=CR率+PR 率;預(yù)后:觀察并記錄兩組的無(wú)進(jìn)展生存期(PFS)(表示從治療開(kāi)始至檢測(cè)到腫瘤進(jìn)展的日期)及總生存時(shí)間(OS)。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS 26.0 軟件處理數(shù)據(jù),計(jì)數(shù)資料采用%表示,行χ2檢驗(yàn),計(jì)量資料采用±s表示,行t檢驗(yàn),P<0.05 為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 晚期胃癌患者基于NLR 不同分組下臨床病理特征的比較
化療前對(duì)患者進(jìn)行中性粒細(xì)胞、淋巴細(xì)胞檢測(cè),計(jì)算NLR,采用ROC 曲線確定NLR 的最佳截點(diǎn)為2.43(見(jiàn)圖1),據(jù)此將患者分為高NLR 組(n=27,>2.43)和低NLR 組(n=33,≤2.43)。高NLR 組和低NLR組的性別、年齡、化療方案、手術(shù)史、體重減輕情況、血小板計(jì)數(shù)及白蛋白相比無(wú)統(tǒng)計(jì)差異(P>0.05);兩組的腫瘤分化類(lèi)型、分期、遠(yuǎn)處轉(zhuǎn)移、浸潤(rùn)度相比差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。詳見(jiàn)表1。
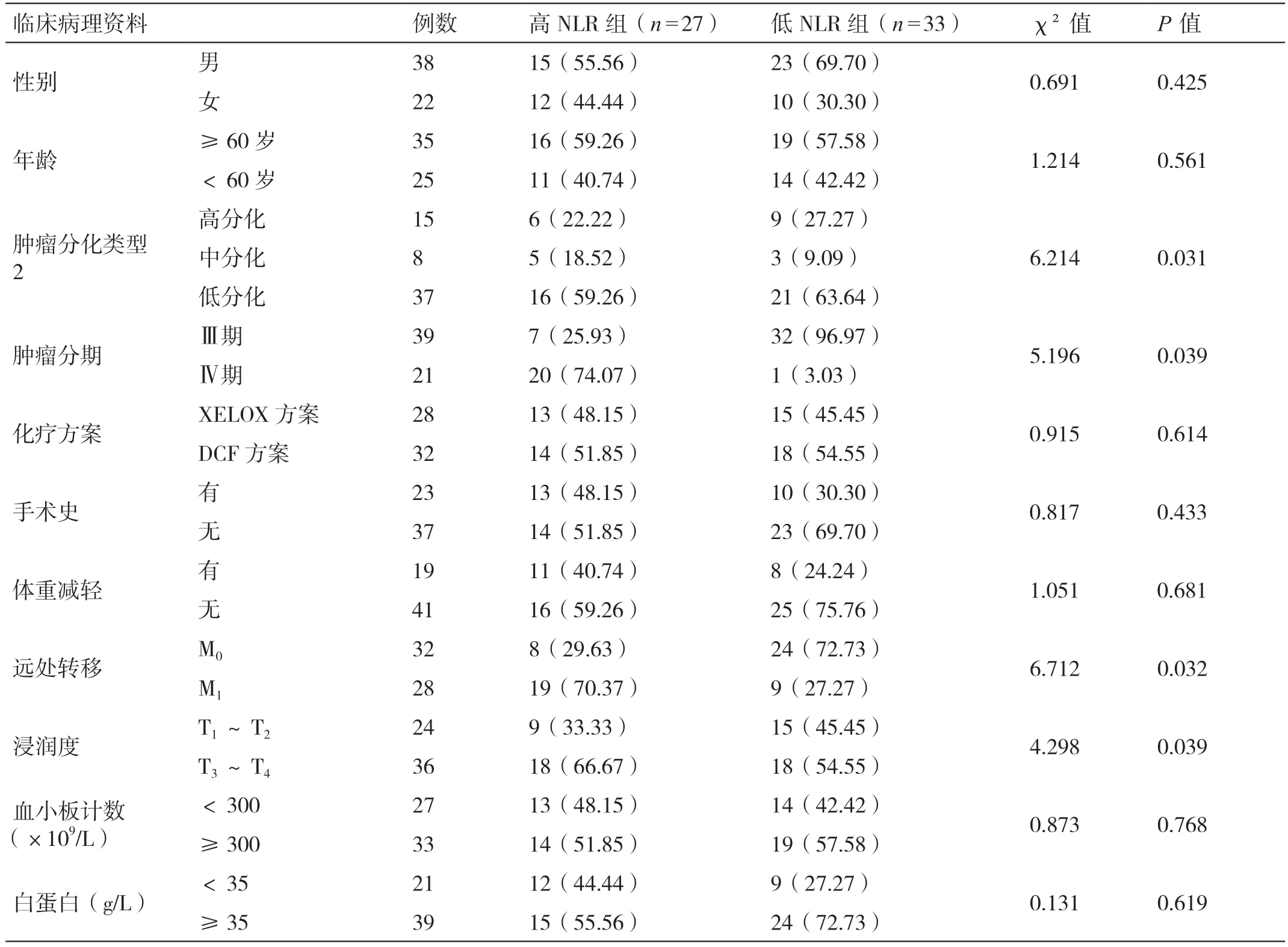
表1 晚期胃癌患者基于NLR 不同分組下臨床病理特征的比較
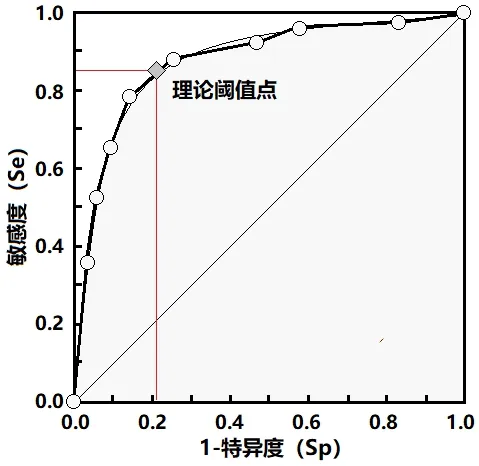
圖1 ROC 曲線確定NLR 的最佳截點(diǎn)
2.2 晚期胃癌患者NLR 影響因素的多因素Logistic回歸分析
多因素Logistic 回歸分析表明,腫瘤分化類(lèi)型(β=1.213,OR=3.582,95%CI=2.482 ~6.313)、分 期(β=1.563,OR=6.413,95%CI=5.682 ~8.452)、遠(yuǎn) 處 轉(zhuǎn)移(β=1.456,OR=4.083,95%CI=3.235 ~4.572)、浸潤(rùn)度(β=2.934,OR=1.034,95%CI=0.283 ~4.394)是晚期胃癌患者NLR 的影響因素(P<0.05)。詳見(jiàn)表2。
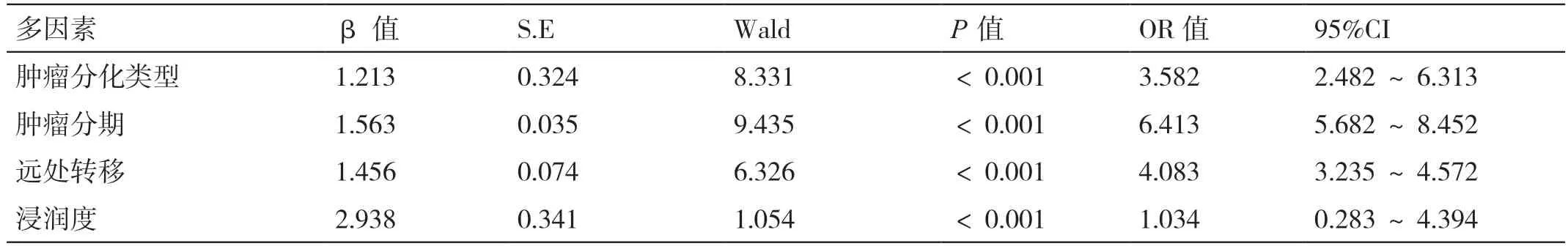
表2 晚期胃癌患者NLR 影響因素的多因素Logistic 回歸分析
2.3 高NLR 組、低NLR 組療效的比較
化療完畢后,以NLR2.0 為截?cái)嘀担^察兩組的療效,結(jié)果顯示高NLR 組的治療有效率為37.04%,顯著低于低NLR 組的81.82%(P<0.05)。詳見(jiàn)表3。
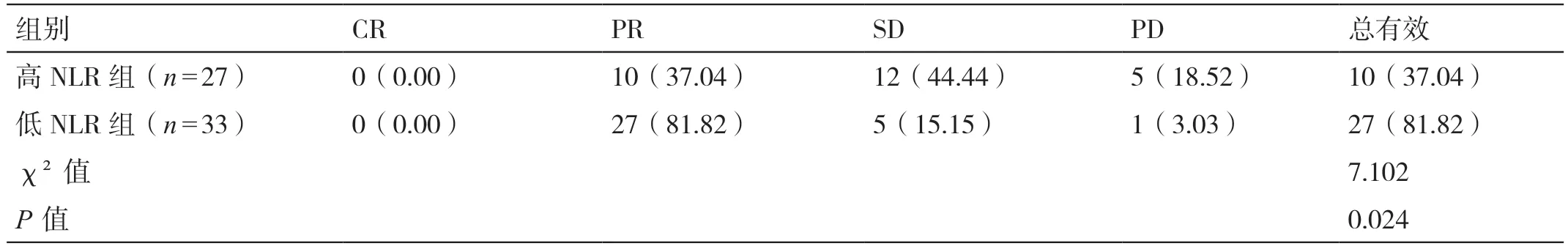
表3 高NLR 組、低NLR 組療效的比較[例(%)]
2.4 NLR 在晚期胃癌預(yù)后預(yù)測(cè)中的價(jià)值
化療完畢后,以NLR2.0 為截?cái)嘀担治鯪LR 在晚期胃癌患者預(yù)后預(yù)測(cè)中的價(jià)值,結(jié)果表明,低NLR組的PFS 和OS 均長(zhǎng)于高NLR 組(P<0.05)。詳見(jiàn)圖2。
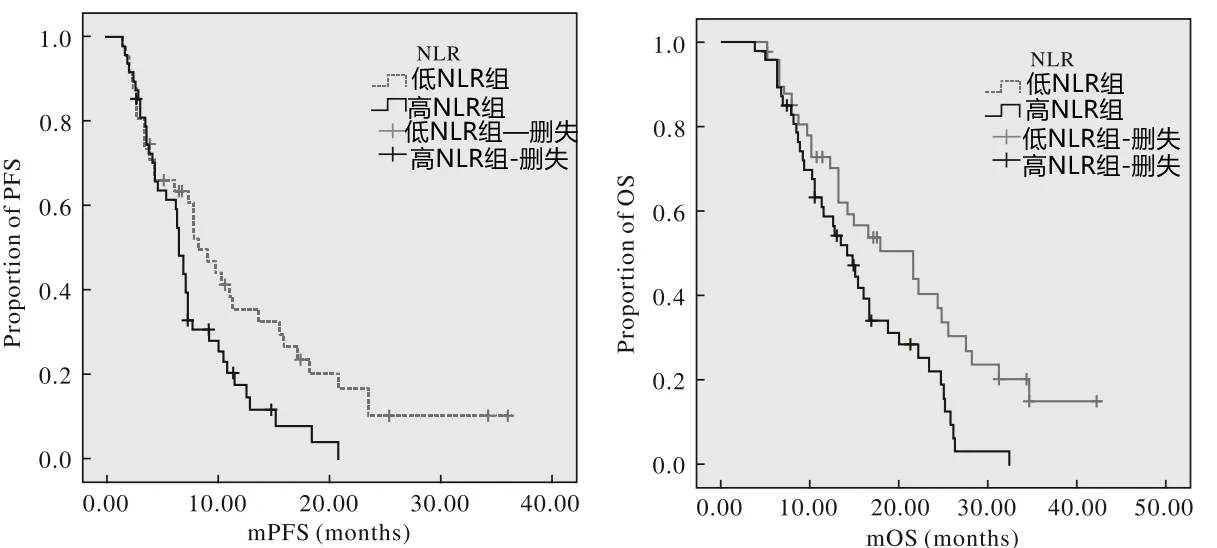
圖2 NLR 在晚期胃癌預(yù)后預(yù)測(cè)中的價(jià)值
3 討論
臨床研究證實(shí),炎癥反應(yīng)在肺癌、乳腺癌、胃癌、淋巴瘤等實(shí)體瘤的發(fā)生發(fā)展中發(fā)揮了重要作用。炎癥反應(yīng)釋放的炎性因子能導(dǎo)致細(xì)胞增殖及炎性細(xì)胞持續(xù)活化,從而引起正常細(xì)胞DNA 的氧化損傷,最終誘導(dǎo)腫瘤的發(fā)生[7]。同時(shí),炎性細(xì)胞、腫瘤細(xì)胞和細(xì)胞外基質(zhì)構(gòu)成了腫瘤發(fā)生的微環(huán)境,炎癥反應(yīng)能與微環(huán)境共同作用,促進(jìn)腫瘤細(xì)胞的增殖、侵襲和轉(zhuǎn)移[8]。NLR 是目前臨床研究相對(duì)較多、較為常用的反映機(jī)體炎性反應(yīng)的指標(biāo)[9]。本研究中,化療前對(duì)患者進(jìn)行中性粒細(xì)胞、淋巴細(xì)胞檢測(cè),計(jì)算NLR,并采用ROC 曲線確定NLR 的最佳截點(diǎn)為2.43。本研究進(jìn)行多因素Logistic 回歸分析表明,分腫瘤化類(lèi)型、分期、遠(yuǎn)處轉(zhuǎn)移、浸潤(rùn)度是晚期胃癌患者NLR 的影響因素(P<0.05)。從本研究結(jié)果來(lái)看,化療前胃癌患者的NLR 表達(dá)異常,其表達(dá)水平與晚期胃癌患者的病理特點(diǎn)存在相關(guān)性,可反映患者疾病的嚴(yán)重程度。對(duì)于晚期胃癌患者,腫瘤細(xì)胞與炎性細(xì)胞存在相互作用,導(dǎo)致腫瘤組織內(nèi)部血管快速生成、細(xì)胞外基質(zhì)重塑以及腫瘤轉(zhuǎn)移,加快了腫瘤的發(fā)展和惡化[10]。此外,持續(xù)的炎癥反應(yīng)會(huì)導(dǎo)致中性粒細(xì)胞增多,抑制淋巴細(xì)胞的增殖,導(dǎo)致淋巴細(xì)胞數(shù)量減少,減弱了淋巴細(xì)胞對(duì)腫瘤的抑制作用,降低了抗腫瘤免疫反應(yīng),造成患者的預(yù)后不佳[11]。中性粒細(xì)胞可促進(jìn)腫瘤的生長(zhǎng)、侵襲和轉(zhuǎn)移,同時(shí)可產(chǎn)生各種促腫瘤生長(zhǎng)因子,抑制免疫反應(yīng)對(duì)腫瘤細(xì)胞的殺滅,促進(jìn)腫瘤的進(jìn)一步發(fā)展。同時(shí),中性粒細(xì)胞計(jì)數(shù)本身在多種惡性腫瘤中能獨(dú)立地評(píng)估患者的治療效果及預(yù)后[12]。因此,基于上述分析,NLR 可能成為更有預(yù)測(cè)價(jià)值的因子。本研究中,高NLR 組的治療有效率為37.04%。顯著低于低NLR 組的81.82%(P<0.05);低NLR 組的PFS 和OS 均長(zhǎng)于高NLR 組(P<0.05)。
綜上所述,NLR 在晚期胃癌患者治療效果及預(yù)后的預(yù)測(cè)中具有較高的價(jià)值,其表達(dá)水平與患者的病理特點(diǎn)存在緊密聯(lián)系,可用于指導(dǎo)臨床診療。

