菌劑PA9 降解農田土壤殘留氧化樂果研究
陳 銳,瞿 佳,孫曉宇,門 欣,鄧 媛,趙玲俠
(1.陜西省微生物研究所,陜西 西安 710043;2.陜西省科學院秦嶺天然產物工程中心,陜西 西安 710043)
【研究意義】商品化的有機磷殺蟲劑(Organophosphorus pesticide,OPs)有150 余種,常見的有敵敵畏、敵百蟲、樂果、氧化樂果和殺螟硫磷等[1]。該類農藥主要通過抑制乙酰膽堿酯酶(AChE)發揮毒性作用[2]。過量使用有機磷農藥會導致農藥大部分殘留于土壤或水體中[3-4],給生態帶來一定威脅[5]。殘留于環境的農藥可通過一定途徑進入生物體,有報道認為,有機磷農藥具有神經毒性,慢性攝入也會導致心血管和肺功能受損以及其他神經系統疾病[6],具有生殖毒性,導致生育能力下降[7],與精神抑郁相關[8],增加癌癥發生風險[9]。因此科學的使用有機磷農藥并及時去除殘留于土壤中的農藥對生態環境及人類健康都有一定的必要性。【前人研究進展】噴灑的農藥除少數被農作物吸收和作用于靶向生物外,80%~90%通過土壤吸附、大氣揮發、降水淋溶以及生物富集等途徑積累在土壤環境中[10]。減少土壤中殘留的化學物質可采用物理、化學及生物學方法[11]。利用磷酸水解酶、木霉屬、假單胞菌屬、芽孢桿菌屬等微生物對有機磷進行水解、共代謝的生物修復技術,應用生物刺激、化學氧化、光催化等化學修復技術,以及聯合修復方法為當前有機磷污染土壤的主要修復方法[12]。生物學方法具有處理成本低、施工簡單、無二次污染、對環境影響小等優點。已有研究表明,微生物菌株可有效降解有機磷農藥[13],目前已分離出可有效降解馬拉硫磷的陰溝腸桿菌(Enterobacter cloacae)和產氣腸桿菌(Enterobacter amnigenus)[14]、降解毒死婢和二嗪農的土壤鏈霉菌(Streptomycessp.)[15]、降解對硫磷的白腐真菌(Phanerochaete chrysosporium)[16]、降解氧化樂果及三唑磷的千葉假單胞菌(Pseudomonas kilonensis)[17-18]等微生物菌株。【本研究切入點】我們前期自周至棗園土壤中 分離篩選獲得1株可降解氧化樂果的 嗜松香假單胞(Pseudomonas abietaniphila)菌株ZZY-C13-1-9,在含氧化樂果400 mg/L 發酵培養基中,經30 ℃、180 r/min搖瓶培養240 h,對氧化樂果的降解率達92.3 %[19]。經搖瓶、無菌土壤及室內盆栽實驗驗證該菌可有效降解氧化樂果。【擬解決的關鍵問題】為驗證該菌株在土壤修復中的實際效果,將該菌制備成菌劑PA9,進行棚室田間土壤試驗,評價其對氧化樂果的降解效果,對作物、土壤理化性質、微生物多樣性產生的影響做評估。
1 材料與方法
1.1 試驗材料
嗜松香假單胞菌ZZY-C13-1-9 制備的微生物菌劑PA9,其16S rDNA序列Genebank登錄號為:MN709129。
1.2 試驗方法
1.2.1田間試驗 試驗在陜西省西安植物園實驗棚內進行(34°12'53"N、109°2'16"E),試驗期限2022 年9 月10 日至10 月30 日,共計50 d。實驗地面積80 m2,等分為4 組(每組長5 m、寬4 m),每組再分成3 塊,為平行試驗。4 組分別設置如下:PA9(菌劑PA9 用量為150 g/m2)、氧化樂果加菌劑處理:PA9-OM(菌劑PA9 用量為150 g/m2,40%氧化樂果乳油2 250 mL,終濃度約100 mg/kg)、氧化樂果對照(OM,40%氧化樂果乳油,氧化樂果農藥終濃度約100 mg/kg)及空白對照(CK,圖1)。農藥及菌劑同時施用,翻耕深度約25 cm。
1.2.2菌劑制備 嗜松香假單胞ZZY-C13-1-9斜面菌株(酵母粉1%,蛋白胨1%,甘油1%,NaCl 0.5%,瓊 脂1.8%,pH 自 然,121 ℃,20 min)平板劃線活化3 次,選取單菌落,接入液體種子搖瓶,180 r/min,28℃,振蕩培養24 h。再將種子液以1%接種量接種至發酵液體搖瓶,28℃、180 r/min 振蕩培養60 h,使菌體生物量達峰值。然后4 000 r/min,離心脫水15 min 獲得濕菌體。濕菌泥∶甘油∶活性炭∶高嶺土按2∶1∶3∶3比例復配成粉狀菌劑PA9,其 菌劑中有效微生物達1×109CFU/g,4 ℃保存。
1.2.3土樣采集 菌劑施用當天開始土壤監測,每隔10 d 取土樣1 次,共取樣6 次。利用5 點采樣法每組采樣1.5 kg,取土深度5~20 cm,3 次重復,共獲得土壤樣本72 個。每組取樣后混合均勻,取1 kg 用于測定土壤理化指標;取2 g 用于測定土壤微生物多樣性。余下土樣用于測定土壤中農藥含量。
1.3 測定指標及方法
1.3.1土壤中氧化樂果殘留量測定 稱取土壤20 g,加無水硫酸鈉研磨至干粉狀,移至300 mL具塞錐形瓶中,添加50 mL 二氯甲烷浸泡4 h,過濾取上清,萃取3 次,合并濾液,50 ℃真空旋轉蒸發至干,用乙酸乙酯溶解定容至20 mL。殘留氧化樂果含量測定采用HPLC uv 檢測器,檢測波長220 nm,C18 柱,水∶甲醇=4∶1,柱溫40℃,流速1.0 mL/min,進樣量10 μL[20]。取平均值±標準差,統計學分析采用配對T 檢驗的方法。
1.3.2功能菌株在土壤中的定殖監測 為驗證功能微生物在土壤中穩定存活及增殖能力,分別稱取0~50 d 的PA9-OM、PA9 及OM 土壤樣本5 g加入45 mL 無菌生理鹽水中梯度稀釋,將10-4、10-5、10-6的稀釋液涂布于含200 mg/L 氧化樂果的營養瓊脂固體平板,28℃培養48 h,觀察平板上菌落生長情況。各平板隨機選取5 個菌落擴培,取菌體進行基因組提取和16S rDNA 序列擴增測序。
1.3.3土壤細菌多樣性監測 將處理0~40 d 的各土壤樣本干冰寄送至聯川生物進行土壤細菌高通量16S V3-4 區測序,分析土壤細菌多樣性變化。測序注釋后獲得OUT 指數;
Shannon 指數=-ΣPilnPi;
聚類分析采用UPGMA(Unweighted Pair Group Method with Arithmetic Mean)方法。
1.3.4土壤理化指標測定 取各土壤樣本委托中科院水土保持研究所進行土壤含水量(烘干法)、pH(玻璃電極法)、NPOC(重鉻酸鉀容量法-外加熱法)、微生物碳(氯仿熏蒸浸提法)、全氮(凱式定氮法)、硝態氮(流動分析法)、銨態氮(流動分析法)、微生物氮(氯仿熏蒸浸提法)、全磷(鉬銻抗比色法)、速效磷(NaHCO3浸提鉬銻抗比色法)、速效鉀(NH4OAc 浸提,火焰光度法)含量測定。5 次重復,取平均值±標準差。統計學分析采用配對T 檢驗方法。
1.3.5番茄生長指標測定 施用菌劑6 d 后按每組實驗田6 行、每行14 株移苗栽種番茄苗(金鵬1 號)。移栽后第2 天記錄番茄苗株高及葉片大小。每10 d 測定1 次,50 d 后測量結束。隨機選取每組5 株測量株高,葉片中段分支5 個,測量第1葉片大小,同時記錄葉片上是否有病變。5 次重復,取平均值±標準差,統計學分析采用配對T檢驗的方法。
2 結果與分析
2.1 土壤中氧化樂果殘留量
如圖2 所示,修復0、10 d 時,PA9-OM 處理與OM 土壤中的氧化樂果殘留量差異不顯著。修復30 d 時,PA9-OM 處理的氧化樂果殘留量開始顯著下降,修復40 d 時氧化樂果降至5.3 mg/kg,降解率達96%,OM 中氧化樂果殘留量為48.79 mg/kg,降解率為59%,具有極顯著差異。表明菌劑的加入使土壤中的氧化樂果含量顯著降低,證實菌劑PA9 在棚室土壤中可加速氧化樂果的降解。

圖2 不同修復處理及時間對土壤氧化樂果殘留的影響Fig.2 Effects of different remediation treatments and days on omethoate residues in soil
2.2 功能菌株在土壤中的定殖監測
如圖3 所示,PA9-OM 處理及PA9 處理土壤樣本經稀釋涂布后,在選擇性平板上有菌落生長,而OM 僅在修復20 d 的土壤樣本上有數個菌落生長。在有菌落生長的平板上任意選取5 個菌落擴培,16S rDNA 測序結果如表1 所示,PA9-OM 及PA9 均可檢出嗜松香假單胞菌,OM 在修復20 d土壤樣本平板上所生長的菌落經鑒定不是嗜松香假單胞,表明菌劑PA9 功能菌株嗜松香假單胞菌可在土壤中定殖。

表1 培養平板上5 個菌落測序鑒定為嗜松香假單胞菌的數量Table 1 Identified number of P.abietaniphila by sequencing from 5 colonies in culture plate
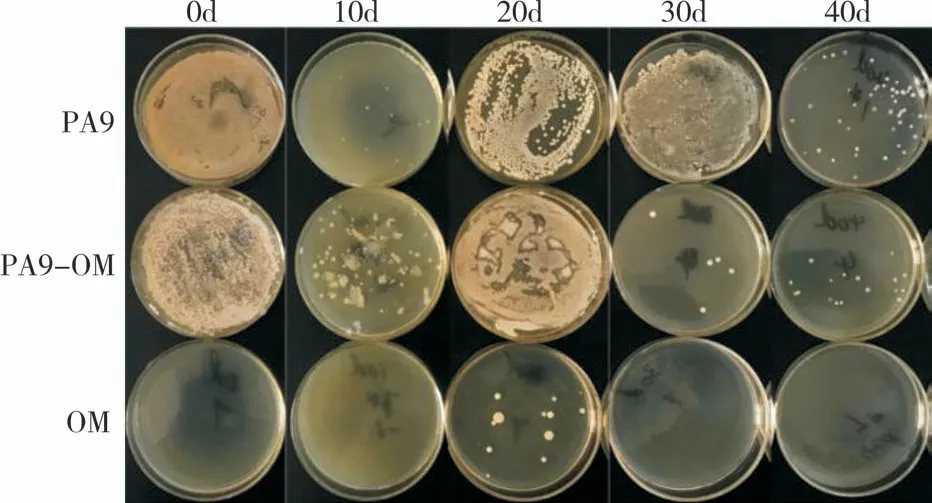
圖3 不同修復處理及時間對土壤中嗜松香假單胞菌分離的影響Fig.3 Effects of different remediation treatments and days on isolation of P.abietaniphila from soil sample
2.3 菌劑PA9 對土壤細菌多樣性影響
2.3.1假單胞菌屬在土壤中變化 如圖4 所示,在屬水平上,PA9-OM 處理與PA9 的假單胞菌屬于優勢菌群,PA9-OM 處理的假單胞菌屬出現先增長后逐漸下降的趨勢,PA9 逐漸下降,OM 的假單胞菌屬在較低水平上先增長后降低。空白對照的假單胞菌屬則一直處于較低狀態。土壤中有殘留氧化樂果時,可利用氧化樂果作為碳源的假單孢菌屬具生存優勢,在土壤微生物菌群中的比例有所增加,當土壤氧化樂果的含量降低時,假單胞菌屬失去生存優勢,在土壤微生物菌群中的比例降低。

圖4 假單孢菌屬在不同修復處理及時間中的相對豐度Fig.4 Relative abundance of Pseudomonas in different remediation treatments and days
2.3.2土壤細菌α 多樣性變化 細菌微生物組的α 多樣性通過Chao1、Shannon、Simpson、Goods coverage 及Otus 等反映。如圖5 所示,修復0 d 時,PA9-OM、PA9、OM 與CK 在Chao1、Shannon、Simpson 及Otus 指數上差異顯著,PA9-OM 處理的土壤細菌微生物多樣性無論從豐富度到均一度均顯著低于空白對照,隨著修復天數的增加其微生物多樣性逐漸恢復。

圖5 不同修復處理及時間對土壤細菌α-多樣性指數的影響Fig.5 Effects of different remediation treatments and days on α-diversity index of soil bacterial
2.3.3土壤細菌群落β 多樣性的變化 對細菌菌群進行屬水平的群落聚類分析,結果如圖6 所示,所有樣本可聚為3 組,修復0、10、20 d 的PA9-OM 與PA9 聚為一簇(A),修復30、40 d 的PA9-OM 與PA9 聚為一簇(C),OM 與CK 聚為一簇(B)。菌劑施用對土壤微生物多樣性的影響顯著,氧化樂果對微生物菌群影響較低,菌劑對土壤微生物的影響隨著修復天數的增長逐漸減弱。將修復0 d 與40 d 的土壤樣本進行微生物多樣性的主成分分析(PCA)發現,組間差異顯著(圖7)。在修復40 d 時PA9-OM 處理在微生物多樣性組成上比0 d 時更接近CK。說明隨著修復時間延長,引入的菌劑對土壤多樣性帶來的影響逐漸降低。如圖8 所示,在門水平上,微生物菌群受菌劑引入的影響顯著降低的是綠彎菌門、己科河菌門、浮霉菌門、硝化螺旋菌門、疣微菌門、匿桿菌門、裝甲菌門、酸桿菌門、芽單胞菌門的微生物,顯著增加的是變形菌門、藍細菌、厚壁菌門。

圖6 屬水平土壤細菌群落聚類Fig.6 Soil bacterial community clustering at genus level

圖7 修復0 d 與修復40 d 土壤微生物多樣性的主成分分析Fig.7 Principal component analysis(PCA) of soil microbial diversity at 0 d and 40 d after remediation

圖8 修復0 d 時土壤微生物多樣性門水平上的差異Fig.8 Differences in soil microbial diversity at phylum level at 0 d after remediation
2.4 土壤理化指標
從表2 可以看出,PA9-OM 處理的土壤有機質增幅沒有空白對照顯著,但有機碳及土壤微生物碳含量顯著增長。PA9-OM 處理的土壤 全氮、微生物氮、速效磷及土壤團聚體GMD 較空白對照顯著增長。微生物碳是活性有機碳,微生物氮是可被作物吸收利用的有效組分,其對于土壤環境的變化比有機碳、有機氮更加敏感。微生物碳、微生物氮的增加說明菌劑組分對土壤微生物碳、氮有所促進。

2.5 番茄生長指標
從圖9 可以看出,PA9 處理僅在土壤修復50 d 時與CK 的番茄株高及葉片大小略有差異,PA9-OM 處理與CK 在葉片大小略有差異,葉面未觀察到病變。后期掛果及產果觀察也證明PA9-OM、PA9、OM 及CK 沒有顯著差異。可認為PA9菌劑中功能微生物不會造成細菌性病害,菌劑其他組分不會對番茄生長產生不良影響。

圖9 不同修復處理及時間對番茄生長的影響Fig9 Effects of different remediation treatments and days on tomato growth
3 討論
有機磷化合物被公認為是使用最廣泛的農藥,這些高毒性化學物質的殘留物通過滲入地下對生物層構成威脅[21]。調查表明,溫室中農藥的大量使用和特殊的栽培方式造成土壤嚴重污染和土壤質量下降。溫室土壤中有機氯農藥類和鄰苯二甲酸酯類的平均濃度均比露地土壤高約100%[22]。殘留有機磷對土壤微生物產生不利影響,影響土壤肥力[23],降低土壤酶活及土壤蚯蚓的數量[24],誘導害蟲產生抗性[25]。有機磷的慢性中毒亦會導致神經毒性損害,誘導氧化應激,干擾線粒體的功能和微粒體代謝紊亂,導致多種神經性發育障礙[26-28]。
利用微生物學方法可將有機磷農藥礦化為完全無害的無機物,且處理成本低、無二次污染,不會影響正常的農業生產,被認為是最具前景的有機物污染修復方式[29]。研究初期,我們已在實驗室中證實嗜松香假單胞菌株ZZY-C13-1-9對氧化樂果的降解率達92.3%[19]。以往報道中,許多微生物菌株在有機質降解過程中的表現不佳[30-31],一方面歸因于降解微生物無法在土壤環境定殖[32],另一方面復雜的微生物菌群環境可能抑制其功能發揮[33]。因此本研究將ZZY-C13-1-9 制備成菌劑PA9,進行棚室田間土壤試驗,驗證其在土壤中對氧化樂果的降解效果。一種外源微生物的引入是否會對土壤性質、土壤理化及土壤微生物多樣性產生影響[34-36],同時是否導致棚室作物發生微生物病害,引發農藥對應病害產生抗性[37],這些問題在本研究中也得到部分解答。目前有觀點認為,有機質污染的生物修復效果受限于微生物降解相關酶類。能夠降解農藥的微生物,主要來自伯克霍爾德菌、假單胞菌和紅球菌屬的細菌菌株[31],土壤微生物代謝有機磷的可能途徑及其相關基因目前也已闡明[38]。通過基因組學、生物信息學、基因編輯等方法對有機磷降解基因和酶進行基因工程改造,強化有機質降解基因及其相關通路,增強其降解效率[39],或直接使用酶類將這些有機污染物水解為無害化學物質進行生物修復是未來污染物處置的新策略[40-42]。這也為我們未來的有機磷污染物降解研究提出新的思路。
下一步我們將對嗜松香假單胞菌株ZZYC13-1-9 降解氧化樂果機制展開研究,前期研究結果表明,PA9 菌株不僅對氧化樂果具有較好的降解效果,對敵百蟲及敵敵畏也有較強的耐受性,這一菌株是否對其他類型的有機磷農藥也有較好的降解能力有待進一步研究。
4 結論
本研究結果表明,人工添加氧化樂果使土壤中氧化樂果初始含量約為100 mg/kg,再施用0.1%菌劑PA9 進行修復,40 d 后,土壤的氧化樂果含量下降至5.3 mg/kg,對照中則為48.79 mg/kg,差異極顯著。微生物菌株ZZY-C13-1-9 可在含有氧化樂果的土壤中有效定殖。土壤細菌菌群多樣性得到恢復,土壤全氮、微生物氮、速效磷及土壤團聚體GMD 較對照有顯著增長。菌劑PA9 對土壤性質及理化無不良影響,對番茄的葉片大小、株高未產生影響,未產生病害。嗜松香假單胞菌ZZY-C13-1-9 可在土壤中定殖并發揮加速降解氧化樂果的作用,且對土壤及作物無危害。

