搭起脊髓再生的希望之橋
李佳音 戴建武
人的中樞神經系統(tǒng)包括腦和脊髓兩部分,是神經系統(tǒng)的最主體結構,它就像一根電纜,通過接收軀干、臟器和四肢的信息,傳達指令,調控身體的各項感覺和運動功能。成人脊髓兩側連有31對脊神經,每對脊神經連接一段脊髓,共分為31個節(jié)段,包括8個頸節(jié),12個胸節(jié),5個腰節(jié)、5個骶節(jié)和1個尾節(jié)。
脊髓在受到創(chuàng)傷或由疾病導致的嚴重損傷后,“電纜”的通路中斷,致使損傷節(jié)段以下的感覺和運動功能部分或完全喪失。而壓瘡、痙攣、疼痛及泌尿系統(tǒng)、呼吸系統(tǒng)等的并發(fā)癥則嚴重影響了患者的康復治療及生活質量。據(jù)統(tǒng)計,全世界每年新發(fā)脊髓損傷病例13.3萬~22.6萬例,美國脊髓損傷患者一生的治療康復費用平均達75萬美元以上, 每年脊髓損傷患者的花費總計超過60億美元[1]。隨著康復醫(yī)學的發(fā)展,目前脊髓損傷已不會顯著影響患者壽命,但其導致的生理及心理問題,以及高昂的治療和康復費用,給家庭和社會帶來了沉重負擔。
脊髓損傷后難以再生的原因
動物體內細胞間質(細胞之間的空間和物質)及其中體液的各種成分,組成了細胞生存及組織器官正常運行的“微環(huán)境”。其中,細胞外基質及結構蛋白可以支撐細胞的位置,而再生因子及信號分子支持細胞的生長、增殖和分化。
人體的一些組織器官,如皮膚、骨等在損傷后會形成有利于再生的微環(huán)境,促使組織自發(fā)修復,并在一定程度上恢復其功能。但是,脊髓損傷后局部神經組織缺失、形成瘢痕或空洞,同時產生一些神經再生抑制因子,使得局部形成不利于神經再生的微環(huán)境,導致神經再生非常困難。

首先,脊髓中的細胞包括神經元和神經膠質。神經元通過其長長的軸突來傳遞信號,而神經膠質細胞(包括星形膠質細胞、小膠質細胞、少突膠質細胞等)負責維持神經元穩(wěn)態(tài)、清除病原體、循環(huán)腦脊液等,保護神經元發(fā)揮其功能。脊髓損傷后,局部的創(chuàng)傷會引發(fā)一系列病理反應,導致?lián)p傷部位神經細胞死亡及局部促進再生的營養(yǎng)因子缺乏。
其次,脊髓損傷后,膠質細胞被激活,在損傷部位周圍形成膠質瘢痕,并在中心形成纖維化瘢痕。筆者團隊發(fā)現(xiàn),瘢痕組織的組分在急性期(損傷后7天內)到陳舊期(損傷14天后)的過程中是動態(tài)變化的。急性期的膠質瘢痕可能具有一定的引導感覺神經纖維再生的作用,而陳舊期的瘢痕組織及其分泌的分子則主要發(fā)揮抑制神經再生的作用[2]。此外,這些參與瘢痕形成的膠質細胞還會產生一種叫做硫酸軟骨素聚糖的物質,激活神經元中抑制軸突生長的信號通路,進而抑制神經再生。
再次,損傷部位還存在一類髓鞘相關蛋白,可抑制神經元軸突的生長以及神經干細胞向神經元的定向分化。髓鞘是包裹在神經細胞軸突外面的一層膜,在中樞神經系統(tǒng)由少突膠質細胞產生。在髓鞘中,至今已發(fā)現(xiàn)至少3種典型的髓鞘相關蛋白,它們被認為是髓鞘再生抑制因子,與細胞中的配體結合后,會引起細胞骨架重排,最終抑制軸突的生長。
最后,與胚胎或新生兒不同,成年人的脊髓神經元內許多與再生相關的基因處于沉默狀態(tài),再生信號無法激活,導致中樞神經無法自主再生。
在以上因素的共同作用下,脊髓損傷后神經再生非常困難。因此,如何改善這種抑制微環(huán)境并促進神經再生是脊髓損傷再生修復研究中的關鍵問題。
再生醫(yī)學助力脊髓損傷再生修復
再生醫(yī)學研究的發(fā)展,為攻破脊髓損傷這一世界醫(yī)學難題提供了新的方向。作為一個前沿交叉學科,再生醫(yī)學應用生命科學、材料科學、臨床醫(yī)學、工程學等學科的原理和方法,研究和開發(fā)用于替代、修復、重建或再生人體各種組織器官的理論和技術,其三個重要組成部分為生物材料、生長因子及干細胞。
神經營養(yǎng)因子是引導神經元生長發(fā)育以及損傷后重建的關鍵。脊髓損傷后內源性再生因子的不足嚴重影響神經再生,因此,外源性再生因子的補充尤為重要。目前已發(fā)現(xiàn)神經營養(yǎng)因子—3、腦源性神經營養(yǎng)因子、神經生長因子、堿性成纖維細胞生長因子、膠質細胞源性神經營養(yǎng)因子等可促進細胞存活,刺激軸突生長,促進實驗動物的脊髓損傷修復[3]。
干細胞是再生醫(yī)學研究的重要組成部分,具有自我更新,并可分化為特定組織中功能細胞的能力,可以作為種子細胞,應用于多種組織器官的再生修復。在中樞神經系統(tǒng)的再生修復中,間充質干細胞和神經干細胞是最為常用的兩種干細胞,在動物實驗中顯示了一定的脊髓修復效果。
但是,干細胞移植目前仍存在許多問題,限制其進一步發(fā)揮作用。首先,由于脊髓中腦脊液不斷流動, 移植的干細胞很難定植于損傷部位,這樣不僅會降低細胞治療效果,還會帶來細胞異位擴散的風險。其次,無論是移植的干細胞還是內源動員的干細胞,在到達成年動物的脊髓損傷處后,都很難分化為神經元,而更多地會分化為膠質細胞,難以起到神經再生的作用。
神經再生膠原支架
在神經再生的基礎及臨床研究中,已有的支架材料主要包括合成材料和天然材料。其中,天然材料,如天然高分子蛋白質、膠原、纖維蛋白等細胞外基質及透明質酸、殼聚糖等天然高分子,由于其來源方便、免疫源性低而更受青睞。如能以生物材料作為支架,改善微環(huán)境,促進內源或移植干細胞的定植和分化,就有望為脊髓損傷提供可能的治療策略。

筆者團隊經過多年的探索,創(chuàng)新研發(fā)出了具有自主知識產權的神經再生膠原支架。其基于膠原的力學特性及有序的結構可以為神經軸突的生長提供支撐,并引導神經纖維有序再生。此外,還研制了能與膠原特異結合的再生因子,使用這些再生因子對支架進行功能化改進,在減少用量、降低副作用的同時,既可以改善損傷的微環(huán)境,在損傷局部聚集促進內源或移植的干細胞,使其定向分化為神經元,又可以誘導干細胞向損傷部位遷移,在支架材料上定植與富集,使得神經膠原支架具有雙重功能性,有效地引導脊髓損傷的再生與修復。
脊髓損傷研究中的動物模型
新的治療方案、醫(yī)療器械產品或藥品在獲批應用到臨床之前,必須要進行大量的動物實驗和臨床試驗,以確保其安全性及有效性。脊髓損傷動物模型是研究脊髓損傷的病理、治療效果及機制的重要工具。其中,小鼠和大鼠因性情溫順,易于飼養(yǎng)、操作和觀察而被廣泛應用于機理或毒性研究;而比格犬、恒河猴等大動物則更多應用于臨床前研究。目前研究中常見的脊髓損傷模型包括挫傷、壓迫傷、半橫斷和完全橫斷脊髓損傷動物模型。其中,完全性橫斷損傷切斷了上下行的神經纖維束,排除了殘存組織的干擾,雖然給手術及護理帶來了更大的挑戰(zhàn),但更適合于作為研究脊髓損傷再生和運動功能恢復機制的動物模型。
嚙齒動物全橫斷脊髓損傷模型
自2009年起,筆者團隊先后建立了胸段脊髓缺損3~10毫米不等的大鼠全橫斷脊髓損傷模型,并利用該模型完成了多批次再生因子或干細胞結合神經再生膠原支架移植修復脊髓損傷的研究。利用這些急性或陳舊性全橫斷脊髓損傷大鼠模型,證實了手術清除瘢痕組織的安全性,以及功能神經膠原支架對神經再生及運動功能恢復的有效性,并提出和驗證了脊髓再生修復的主要機制是形成新的神經橋接。
比格犬全橫斷脊髓損傷模型
比格犬是國際上公認的最理想的實驗動物之一,已被廣泛應用于醫(yī)學、生物學、病理學、腫瘤學、藥理學、生物化學等生命科學領域。筆者團隊首次建立了胸段脊髓缺損5~40毫米不等的比格犬全橫斷脊髓損傷模型,并建立了一套行之有效的術后護理系統(tǒng),最大限度防止犬的尿路和皮膚感染,以及褥瘡、壓力潰瘍等的發(fā)生。通過多批次300余只犬的動物實驗,證實神經再生膠原支架可與神經營養(yǎng)因子、再生抑制因子的拮抗劑或間充質干細胞結合,有效促進損傷部位的神經再生和運動功能的恢復。
恒河猴全橫斷脊髓損傷模型
非人靈長類動物進化程度高,有許多與人類相似的生物學特征。其中,恒河猴(獼猴)與人類的遺傳物質有75%~98.5%的同源性,是人類疾病研究理想的動物模型,已被廣泛用于遺傳學疾病、行為學、神經生物學、生殖生理學、腫瘤學等領域的研究。筆者團隊率先建立了恒河猴全橫斷脊髓損傷模型,并評估了神經營養(yǎng)因子—3功能化神經再生膠原支架移植治療的效果。結果顯示,移植后恒河猴的脊髓損傷部位空腔形成顯著減少,具有更多的神經纖維再生、再髓鞘化和突觸形成[4]。
經過多年的探索,筆者團隊成功建立了不同類型的大鼠、犬和非人靈長類全橫斷脊髓損傷模型,并應用于脊髓損傷再生修復研究,助力我國在該領域的研究走在國際前列,為脊髓再生修復產品的臨床轉化提供了可靠的大動物評價體系。
脊髓損傷后功能恢復的主要機制
在脊髓中,下行神經傳導束主要由皮質脊髓束(corticospinal tract, CST)、中縫核脊髓束、網狀脊髓束和紅核脊髓束等長的神經軸突組成,負責將大腦的運動指令傳遞給肌肉。其中,CST因其在自主運動功能控制中的關鍵作用而備受關注,許多研究也致力于誘導CST的生長以恢復肢體的運動功能。

脊髓損傷根據(jù)其損傷程度的不同,分為不完全性損傷和完全性損傷。通過回顧近10年來脊髓損傷再生修復的研究可以發(fā)現(xiàn),利用人工構建神經支架或基質,同時結合藥物、蛋白因子、各種外源性細胞等進行移植修復,均可以促進某些截斷的軸突在損傷后繼續(xù)生長。但是,這些研究幾乎沒能發(fā)現(xiàn)在完全性截斷后的脊髓中有 CST 軸突延伸或穿過損傷區(qū)。而對于脊髓擠壓傷或半橫切損傷模型,通過殘存的完整神經纖維芽生則可以實現(xiàn)部分功能恢復,但其再生距離和數(shù)量非常有限,難以支持其再生穿過損傷區(qū)并恢復運動功能,因此CST軸突再生的機制備受爭議。
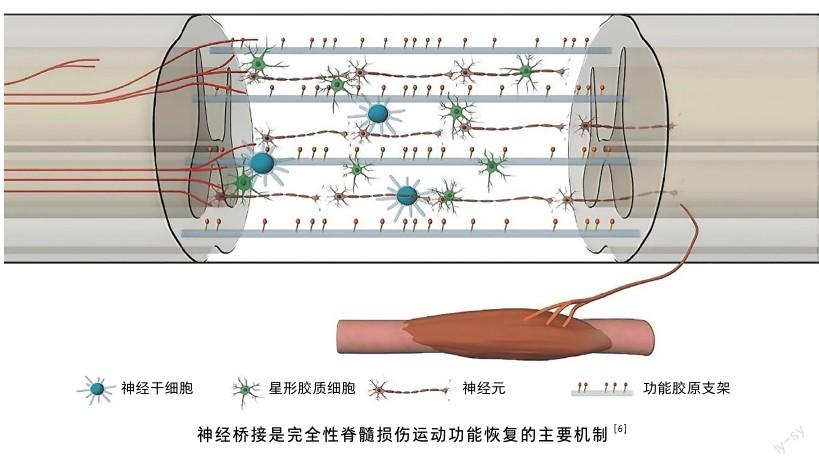
損傷區(qū)功能神經元形成神經橋接
對于完全性損傷后的功能恢復機制,目前研究認為可能有3種:神經長軸突再生通過損傷區(qū)域;損傷區(qū)新生的神經元將損傷的兩個斷端連接起來,形成橋接;前兩種機制同時存在。
筆者團隊在通過多種策略實現(xiàn)完全性脊髓損傷動物運動功能恢復的研究過程中,提出并證實神經橋接是完全性脊髓損傷后功能恢復的主要機制,即通過改善脊髓損傷后再生抑制的微環(huán)境,內源神經干細胞或移植的干細胞可在損傷部位形成新的功能神經元,連接兩個斷端形成新的神經橋接,促進完全性脊髓損傷后的功能恢復[5]。這種神經元橋接的一個重要特征是在損傷部位產生新的神經元,新生神經元與宿主神經元或宿主軸突形成新的突觸,并產生適當?shù)纳窠涍f質進行神經傳導。然而,由于脊髓組織中損傷后的抑制微環(huán)境以及腦脊液的流動性,僅通過干細胞或神經細胞移植很難使其在損傷部位定植、分化,并形成神經橋接。因此,筆者團隊另辟蹊徑,通過創(chuàng)新研發(fā)的功能性神經再生膠原支架來改善抑制微環(huán)境,結合外源及內源的神經干細胞,實現(xiàn)了完全性脊髓損傷動物運動功能恢復的突破。

神經再生膠原支架引導外源神經干細胞定向分化
髓鞘蛋白是一類抑制神經干細胞定向分化為神經元的再生抑制分子。研究發(fā)現(xiàn),脊髓損傷后,髓鞘相關蛋白會激活細胞表皮生長因子受體(EGFR),通過EGFR的信號通路來抑制軸突再生。為了拮抗這一信號傳導途徑,筆者團隊制備了可以與膠原特異結合的EGFR抗體,它可以復合在神經再生膠原支架上,并將外源神經干細胞與支架一起移植到完全性脊髓損傷大鼠的損傷部位。功能化的神經再生支架可與神經干細胞表面的EGFR受體特異結合,使細胞最大限度地保留在損傷區(qū)域,并定向分化為神經元,在損傷部位形成新的神經橋接,促進大鼠的神經傳導和運動功能恢復[7]。
脊髓損傷激活內源神經干細胞
位于成體動物脊髓中央管中的室管膜細胞,被認為是內源神經干細胞的潛在來源。這些細胞在正常組織中并不活動,但在損傷后的脊髓組織中會被激活并遷移至損傷部位。筆者團隊發(fā)現(xiàn),雖然室管膜細胞在損傷后會被激活,但在損傷部位更傾向于分化為星形膠質細胞,并形成密集的膠質瘢痕,阻礙神經再生。而神經膠原支架結合神經營養(yǎng)因子、間充質干細胞或神經再生抑制因子拮抗劑,都可以重建脊髓損傷后神經抑制微環(huán)境,促進損傷激活的內源性神經干細胞更多地自發(fā)分化為功能神經元并形成神經橋接,明顯改善實驗動物的運動功能,充分證實了神經橋接是完全性脊髓損傷后運動功能恢復的主要機制。今后,需進一步闡明這些新生神經元如何與脊髓組織整合并形成神經網絡,促進運動功能更好地恢復[8]。
神經再生膠原支架為脊髓損傷患者搭起“希望之橋”
在完成系列臨床前研究的基礎上,筆者團隊從2015年1月16日起,開展了首例神經再生膠原支架結合自體骨髓細胞修復陳舊性完全性脊髓損傷的臨床研究。通過一年的隨訪,證實了采用神經電生理方法進行瘢痕清理是安全可行的,神經再生膠原支架聯(lián)合細胞移植可改善完全性脊髓損傷患者的感覺平面或運動誘發(fā)電位, 自主神經功能也得到一定程度的恢復, 部分頸段損傷患者的運動功能也得到了改善[9]。
在急性脊髓損傷的臨床研究中,建立了綜合ASIA分級、影像學、神經電生理和術后運動功能恢復時間相結合的更嚴格判定完全性脊髓損傷的方法。隨訪一年后, 兩名患者的感覺和運動功能明顯改善, 一例胸段損傷患者可以借助支架行走,另一例頸部損傷患者可以移動腿和腳趾。感覺誘發(fā)電位和運動誘發(fā)電位可以跨損傷區(qū)傳導, 患者損傷狀態(tài)由A級完全損傷改善為C級不完全損傷, 顯示了良好的修復效果[10]。
到目前為止,筆者團隊已完成了15例急性完全性脊髓損傷患者和51例陳舊性完全性脊髓損傷患者2~5年長期的隨訪,結果表明,神經再生膠原支架移植治療急性和陳舊性完全性脊髓損傷是安全的,部分急性患者的大小便感覺和下肢活動能力恢復明顯。目前,神經再生膠原支架相關技術已實現(xiàn)企業(yè)轉化,正在進行以獲得產品注冊證為目的的臨床試驗,其最終形成產品將造福于更多的患者。
新的探索——脊髓移植與脊髓制造
神經再生支架的臨床轉化取得初步成果后,鑒于單一細胞移植很難完全替代脊髓損傷區(qū)的細胞功能,難以滿足功能完全重建的更高要求,因此,筆者團隊近年來還嘗試通過新的途徑和再生醫(yī)學技術來助力脊髓損傷的再生修復,并已在成體脊髓組織移植和脊髓組織體外制造方面取得了進展。
首次開展大鼠及犬的成體脊髓組織移植
組織器官移植是通過外科手段,將他人具有活力的器官移植給病人,以代替其病損的器官使其迅速恢復功能的手術。目前,皮膚、骨、心臟、肝、腎等組織器官都可以成功移植,但成人的脊髓組織異體移植仍未能實現(xiàn)。筆者團隊在2019年首次報道了利用成年大鼠脊髓的完整脊髓組織異體移植治療完全性脊髓損傷的研究成果,在移植時聯(lián)合再生因子“雞尾酒”,營造出有利于神經細胞存活的微環(huán)境,提高異體成體脊髓組織以及神經細胞移植后的存活率。該研究是國際上首次對成年脊髓組織移植的可行性進行探索,受到廣泛關注。
之后,團隊利用犬的全橫斷脊髓損傷模型進一步研究了成年完整脊髓組織移植的長期治療效果,在術后半年發(fā)現(xiàn)其同樣促進了犬的運動功能恢復,移植的成體脊髓組織和神經細胞術后半年在體內可以存活,表明成年脊髓組織移植具有可行性。像心臟、肝臟、腎等成功的器官移植一樣,該研究為未來的異體脊髓組織移植治療脊髓損傷這一不治之癥開啟了希望之門。
脊髓組織體外制造
近年來,隨著干細胞研究及3D生物打印、單細胞測序、譜系失蹤和組學等技術的迅速發(fā)展,人們對組織器官的發(fā)育、構造及損傷后不同類型細胞的變化有了深入了解,促使科幻小說中的體外器官組織制造日漸變?yōu)榭赡堋?/p>
一個可用于體內移植的組織單元至少要包括兩個重要的部分:與體內結構類似的細胞基質,以及一種或多種可以定植并發(fā)揮作用的組織特定功能細胞。根據(jù)脊髓組織制造的需求,筆者團隊通過單細胞測序等技術闡明了人胚胎脊髓神經細胞的發(fā)育過程,建立了人脊髓神經前體細胞及膠質細胞的培養(yǎng)體系和細胞及有序生物材料纖維的產品標準,實現(xiàn)了復合2種人脊髓功能細胞的脊髓功能單元的構建。在全橫斷脊髓損傷動物模型中,證實了這種體外制造的脊髓組織在損傷區(qū)能夠存活,并進一步分化為成熟的脊髓背腹側神經元,其可與移植物與宿主的運動或感覺軸突形成靶向連接,脊髓損傷動物的運動誘發(fā)電位和后肢功能也得到改善。該研究也即將開始向臨床轉化,為脊髓組織單元移植修復脊髓損傷研究提供了一種治療策略。
雄關漫道真如鐵,筆者團隊通過20年的辛勤耕耘,取得了突破性成果,使我國在脊髓損傷再生修復這一世界醫(yī)學難題的研究領域達到世界領先水平,并仍在不斷進取,力爭為數(shù)百萬脊髓損傷患者重燃自主站立和康復的希望。
[1]Lee B B, Cripps R A, Fitzharris M, et al. The global map for traumatic spinal cord injury epidemiology: update 2011, global incidence rate. Spinal Cord, 2014, 52(2): 110-116.
[2]Li X, Yang B, Xiao Z, et al. Comparison of subacute and chronic scar tissues after complete spinal cord transection. Experimental Neurology, 2018, 306: 132-137.
[3]Boyce V S, Mendell L M. Neurotrophic factors in spinal cord injury. Handbook of Experimental Pharmacology, 2014, 220: 443-460.
[4]Han S, Yin W, Li X, et al. Pre-clinical evaluation of CBD-NT3 modified collagen scaffolds in completely spinal cord transected non-human primates. Journal of Neurotrauma, 2019, 36(15): 2316-2324.
[5]Li X, Liu D, Xiao Z, et al. Scaffold-facilitated locomotor improvement post complete spinal cord injury: Motor axon regeneration versus endogenous neuronal relay formation. Biomaterials, 2019, 197: 20-31.
[6]肖志峰, 趙燕南, 李佳音, 等. 脊髓損傷再生研究進展——搭建脊髓損傷修復的希望之橋. 中國科學: 生命科學, 2019(49): 1395.
[7]Xu B, Zhao Y, Xiao Z, et al. A dual functional scaffold tethered with EGFR antibody promotes neural stem cell retention and neuronal differentiation for spinal cord injury repair. Advanced Healthcare Materials, 2017, 6(9).
[8]Li X, Zhao Y, Cheng S, et al. Cetuximab modified collagen scaffold directs neurogenesis of injury-activated endogenous neural stem cells for acute spinal cord injury repair. Biomaterials, 2017, 137: 73-86.
[9]Zhao Y, Tang F, Xiao Z, et al. Clinical study of NeuroRegen scaffold combined with human mesenchymal stem cells for the repair of chronic complete spinal cord injury. Cell Transplant, 2017, 26(5): 891-900.
[10]Xiao Z, Tang F, Zhao Y, et al. Significant improvement of acute complete spinal cord injury patients diagnosed by a combined criteria implanted with NeuroRegen scaffolds and mesenchymal stem cells. Cell Transplant, 2018, 27(6): 907-915.
關鍵詞:脊髓損傷 再生醫(yī)學 神經再生 膠原支架 ■

