基于指紋圖譜和網絡藥理學的秦皮質量標志物(Q-Marker)預測分析
徐蓓蕾,孫文斌,王 昊, 2, 3,王金宏, 2, 3,胡 揚, 2, 3,楊 波, 2, 3,劉晶晶,楊娜娜,周恩寶,韓曉宇,劉樹森,武文琪,李文蘭, 2, 3*
基于指紋圖譜和網絡藥理學的秦皮質量標志物(Q-Marker)預測分析
徐蓓蕾1, 2, 3, 4,孫文斌1,王 昊1, 2, 3,王金宏1, 2, 3,胡 揚1, 2, 3,楊 波1, 2, 3,劉晶晶5,楊娜娜1,周恩寶6,韓曉宇1,劉樹森1,武文琪1,李文蘭1, 2, 3*
1. 哈爾濱商業大學藥學院,黑龍江 哈爾濱 150076 2. 抗腫瘤天然藥物教育部工程研究中心,黑龍江 哈爾濱 150076 3. 黑龍江省預防與治療老年性疾病藥物研究重點實驗室,黑龍江 哈爾濱 150076 4.中藥制藥與新藥開發教育部工程研究中心,北京 102488 5.中國食品藥品檢定研究院,北京 100050 6. 魯南制藥集團股份有限公司醫學部,山東 臨沂 276000
在中藥質量標志物(quality marker,Q-Marker)“五原則”指導下,基于指紋圖譜和網絡藥理學方法,從可測性和有效性角度分析預測秦皮潛在的Q-Marker。建立15批秦皮飲片指紋圖譜,進行聚類分析(hierarchical cluster analysis,HCA)、主成分分析(principal component analysis,PCA)和偏最小二乘判別分析(partial least-squares discrimination analysis,PLS-DA),運用網絡藥理學方法構建“成分-靶點-通路”網絡圖,并預測秦皮飲片的Q-Marker,同時進行定量分析。建立了15批秦皮飲片指紋圖譜,在21個共有峰中指認出4號峰為秦皮苷、6號峰秦皮乙素、7號峰秦皮素、9號峰秦皮甲素,HCA、PCA和PLS-DA結果大體相符,網絡藥理學篩選出潛在的21個活性成分、129個核心靶點、159條關鍵通路,整合指紋圖譜、模式識別及網絡藥理學方法,共同辨識出可測性、有效性、特有性原則的潛在Q-Marker為秦皮苷、秦皮乙素、秦皮素、秦皮甲素,四者含量依次為0.93%~2.51%、0.98%~1.41%、0.71%~1.09%、0.66%~1.25%。整合指紋圖譜、模式識別和網絡藥理學分析預測了秦皮潛在的Q-Marker,為全面控制和評價秦皮飲片質量提供科學依據,為多基原中藥質量標準的研究提供理論參考。
秦皮飲片;質量標志物;指紋圖譜;網絡藥理學;多元統計分析;秦皮苷;秦皮乙素;秦皮素;秦皮甲素
秦皮始載于《神農本草經》,列為中品,為木犀科植物苦櫪白蠟樹Hance、白蠟樹Roxb.、尖葉白蠟樹Lingelsh.、宿柱白蠟樹Lingelsh.的干燥枝皮或干皮。其苦、澀,性寒,歸肝、膽、大腸經。具有清熱燥濕、收澀止痢、止帶、明目等功效,主要用于治療濕熱瀉痢、赤白帶下、目赤腫痛、目生翳膜、細菌性痢疾、慢性支氣管炎、牛皮癬等癥。秦皮主要分布在遼寧、吉林、河北、河南、內蒙古、陜西、山西、四川等地。其化學成分主要包括香豆素類、木脂素類、裂環環烯醚萜類、苯乙醇苷類、黃酮類、酚酸類、三萜類等,現代藥理學研究表明秦皮具有抗菌、抗炎鎮痛、抗腫瘤、止咳祛痰、降低血尿酸等作用[1-2]。
劉昌孝院士秉持著“傳承不泥古,創新不離宗,論證以求真”的理念,提出了中藥質量標志物(quality marker,Q-Marker)的概念,是中藥質量評價與質量控制領域的重大突破,其基于溯源與傳遞性、特有性、可測性、有效性以及處方配伍5條核心原則,將中藥有效性(藥性和藥效)-物質基礎-質量控制標志性成分相整合,與中藥的功能屬性密切相關,且能夠反映中藥安全性和有效性,為中藥質量控制提供科學依據,成為本領域的有利“抓手”[3-4]。中藥指紋圖譜是目前較為成熟的發現共有成分的方法,化學模式識別技術可較好地迎合指紋圖譜的整體性和模糊性要求,能夠客觀地反映中藥整體性和差異性[5]。網絡藥理學能夠從整體觀角度構建藥物靶點間互作關系的生物網絡,有效預測相關靶點和通路的分析手段,發現藥物作用機制,呈現系統性與整體性,對于有效挖掘Q-Marker具有重要意義[6]。本研究基于Q-Marker理論,整合高效液相色譜指紋圖譜結合化學模式識別技術及網絡藥理學方法,從生物信息學和化學角度分析預測多基原多產地中藥秦皮潛在的Q-Marker,建立秦皮飲片的質量控制研究方法,以期為秦皮整體質量控制研究提供參考依據。
1 儀器與試藥
1.1 儀器
Waters alliance acquity-e2695高效液相色譜儀,包括四元泵、柱溫箱、自動進樣器、PDA檢測器、Empower工作站(美國Waters公司);JM型電子分析天平(超澤公司);SK3310HP型超聲波清洗器(上海科導公司)。
1.2 試藥
對照品秦皮甲素(批號110740-201806)、秦皮乙素(批號110741-202109)、秦皮素(批號111731- 202103)均購自中國食品藥品檢定研究院,秦皮苷(批號wkq-00435)購買自四川維克奇有限公司,所有對照品質量分數均大于98%;甲醇(色譜級,默克公司);乙腈(色譜級,默克公司);娃哈哈純凈水(杭州娃哈哈集團有限公司);秦皮飲片(編號S1~S15)經哈爾濱商業大學藥學院金哲雄教授鑒定為白蠟樹Roxb.、苦櫪白蠟樹Hance.、尖葉白蠟樹Lingelsh.、宿柱白蠟樹Lingelsh. 的干燥枝皮,收集到的樣品具體信息見表1及圖1。
2 方法與結果
2.1 秦皮指紋圖譜定性分析
2.1.1 色譜條件 采用Welch Ultimate&Reg XB-C18色譜柱(250 mm×4.6 mm,5 μm);流動相為乙腈(A)-0.1%磷酸水溶液(B),梯度洗脫:0~10 min,10%~16% A;10~13 min,16% A;13~23 min,16%~22% A;23~28 min,22%~30% A;28~48 min,30%~55% A;48~53 min,55%~90% A。體積流量1.0 mL/min,檢測波長280 nm,柱溫25 ℃,進樣量10 μL。

圖1 15批秦皮飲片性狀鑒定(S1~S15)
2.1.2 對照品溶液的制備 分別取秦皮甲素、秦皮乙素和秦皮素、秦皮苷對照品適量,精密稱定,加入甲醇溶解制成質量濃度分別為3.0、2.0、2.0、2.7 mg/mL混合對照品溶液,備用。
2.1.3 供試品溶液的制備 取秦皮飲片5 g,加7倍體積水浸泡30 min,回流提取30 min,濾過,殘余藥渣再加6倍體積水,繼續提取20 min,濾過。合并濾液,加熱至剩余20 mL。取10 mL秦皮水提液濃縮至浸膏狀,將其以乙腈-水(1∶9)再次定容至10 mL,溶液過0.22 μm微孔濾膜,即得,其生藥量為0.25 g/mL。
2.1.4 方法學考察
(1)參照峰的選擇:《中國藥典》2020版將秦皮甲素、秦皮乙素作為評價秦皮質量的指標性成分,其中秦皮甲素在對照色譜圖中分離良好,峰形穩定,峰面積大,故確定秦皮甲素為參照峰(S),計算各共有峰的相對保留時間和相對峰面積。
(2)精密度試驗:取S7號供試品溶液,在“2.1.1”項條件下連續進樣6次,記錄色譜圖,結果表明S7各共有峰的相對保留時間RSD<2.31%,相對峰面積RSD<2.66%。
(3)重復性試驗:取同一批S7號樣品,按照“2.1.3”項下方法平行制備6份供試品溶液,按照“2.1.1”項下色譜條件進樣,記錄色譜圖,結果表明S7各共有峰的相對保留時間RSD<2.08%,相對峰面積RSD<2.41%。
(4)穩定性試驗:取S7號供試品溶液,分別0、2、4、6、8、10、12、24 h時按照“2.1.1”項下色譜條件進樣,記錄色譜圖。結果表明S7各共有峰相對保留時間RSD<2.53%,相對峰面積RSD<2.33%,表明供試品溶液24 h內穩定。
2.1.5 指紋圖譜的建立 將15批秦皮飲片的HPLC色譜圖導入《中藥指紋圖譜相似度評價系統》(2012.130723版),得到21個共有峰,以S7為參照譜圖,采用中位數法,進行多點校正和全譜峰匹配,生成對照指紋圖譜(R),見圖2。以對照指紋圖譜為參照,計算共有峰相似度。結果表明,秦皮飲片指紋圖譜相似度在0.991~0.998,分別為0.993、0.998、0.995、0.997、0.998、0.997、0.997、0.991、0.997、0.998、0.998、0.998、0.997、0.996、0.991,說明秦皮飲片質量穩定。將檢測到21個共有峰與混合對照品溶液圖譜比對,指認其中4個色譜峰,4號峰為秦皮苷、6號峰為秦皮乙素、7號峰為秦皮素、9號峰為秦皮甲素,見圖3。
2.2 化學模式識別分析
2.2.1 層次聚類分析(hierarchical cluster analysis,HCA) 利用SPSS 20.0軟件,聚類方法選擇組間連接法,聚類距離采用歐式平方距離。依照“2.1”項下方法對S1~S15號秦皮飲片HPLC指紋圖譜進行HCA,見圖4。可以看出,當聚類距離為20時,15批秦皮飲片可分為3類,其中S3為第1類,樣品為產自湖北的白蠟樹;S2、S4、S5、S8~S10、S15為第2類,樣品分別覆蓋陜西、黑龍江、甘肅、河北、湖北等多個產地,樣品基原以白蠟樹和宿柱白蠟樹為主;其他樣品為第3類,大部分樣品產于甘肅和陜西,但其基原均為苦櫪白蠟樹。當聚類距離為25時,15批秦皮飲片可分為2類,S2~S5、S8~S10、S15為第1類,多產于陜西、湖北和黑龍江,基原多為白蠟樹和宿柱白蠟樹;其他樣品第2類,多產于陜西和甘肅,基原均為苦櫪白蠟樹。HCA結果能夠直觀地表明樣品的基原和產地特征,其中基原一致的樣品往往更傾向于聚為一類,說明對于多基原中藥而言基原可以作為聚類的內在屬性將樣品進行較好地區分,但仍可能存在產地交叉的現象。

圖2 15批秦皮飲片HPLC指紋圖譜疊加圖(S1~S15)

P4-秦皮苷 P6-秦皮乙素 P7-秦皮素P9-秦皮甲素

圖4 15批秦皮飲片聚類分析樹狀圖
2.2.2 主成分分析(principal component analysis,PCA) PCA是無監督學習的降維算法,可解釋多個變量間的內部結構,即從原始變量中導出少數幾個主要變量,同時使它們盡可能多地保留原始變量信息的多元統計的分析方法。利用SPSS 20.0軟件,對15批秦皮飲片指紋圖譜共有峰進行PCA分析,計算主成分特征值和方差貢獻率,主成分1特征值9.441,主要反映第1、3、4(秦皮苷)、5、6(秦皮乙素)、9(秦皮甲素)、11、12、14~16、18~21號峰的信息,方差貢獻率44.958%;主成分2特征值3.231,主要反映第10、17號峰的信息,方差貢獻率15.386%;主成分3特征值2.199,主要反映第13號峰的信息,方差貢獻率10.471%。前6個主成分的特征值均>1,累積方差貢獻率>88.481%,能夠代表15批秦皮飲片中21個成分的大部分信息,具有較好的代表性。因此可用該6個主成分代替指紋圖譜21個共有峰來對秦皮進行評價,其中主成分1的特征值及貢獻率最高,且能夠反映15個峰值信息。
2.2.3 偏最小二乘法分析(partial least-squares discrimination analysis,PLS-DA) PLS-DA是有監督模式的數據分析方法,其包含了PCA、典型相關分析等多種思想,利用降維思想使提取后得到的特征變量不僅能很好地概括原始變量信息,也能對因變量有很強的解釋能力,具有計算量小,預測精準度高,易于定性解釋的特點,尤其是結合變量投影重要性分析(variable importance in the projection,VIP),能夠較好地解決變量間的多重共線性問題。將15批秦皮飲片指紋圖譜中各共有峰面積導入SIMPA-P 14.0軟件,以15批樣品中21個共有峰的峰面積為變量,組成1個15×21的新矩陣,采用SIMCA 14.1軟件對新組成的矩陣進行PLS-DA。已建立的PLS-DA模型2(cum)=0.755,2(cum)=0.914,2(cum)=0.534,均大于0.5,說明該模型具有良好的預測與解釋能力且未出現過擬合現象。根據VIP>1,篩選出峰1、4(秦皮苷)、5、6(秦皮乙素)、9(秦皮甲素)、11~13、15、18~21對組間差異影響較大的13個成分,與PCA主成分1所包含峰大體一致,結果見圖5。說明上述成分可能是引起不同產地及基原秦皮飲片間差異的主要成分,其中,通過HPLC指紋圖譜共有峰已指認的4(秦皮苷)、6(秦皮乙素)、9(秦皮甲素)號峰,能夠秦皮潛在的Q-Marker,用于秦皮飲片的質量控制。
根據PLS-DA中圖5-A的結果,表明15批秦皮飲片可分為4類,S3為單獨一類,S2、S4、S5、S8~S10、S15為一類,與聚類距離為20時HCA結果完全一致。另外2類,樣品基原均都來自苦櫪白蠟樹,但S7、S11~S13明顯為一類,除了S7產地為陜西外,其余樣品產地均為甘肅,S1、S6、S14為一類,其中樣品S1和S16來自于陜西,S14產地為黑龍江。與HCA相比,PLS-DA能夠將 HCA聚類距離為20的結果中,沒有分開的第3類進行了更細化的分類,能夠大致區分為甘肅和陜西2組。說明PLS-DA能夠更直觀顯示出各組間差異,結果更準確、客觀,能夠與HCA結果實現互補。
2.3 網絡藥理學對秦皮飲片的Q-Marker預測分析
2.3.1 秦皮活性成分的篩選 通過中藥系統藥理學數據庫與分析平臺(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)數據庫(https://old.tcmsp-e.com/ tcmsp.php)檢索秦皮所有的化學成分[7-8]。所得共21個化合物,分別為反-3,5-二甲氧基-4-羥基肉桂、芥子醇、3,4-二羥基肉桂酸、對羥基苯乙醇、丁香醛、刺五加苷、西托糖苷、β-谷甾醇、秦皮乙素、東莨菪內酯、秦皮甲素、秦皮素、2,6-二甲氧基-1,4-苯醌、熊果酸、三十烷酸、-苯基-2-萘胺、(2,3, 4,5,6)-2-[4-[(1,3a,4,6a)-6a-hydroxy-4-(4- hydroxy-3-methoxyphenyl)-3,3a,4,6-tetrahydro-1- furo[4,3-c]furan-1-yl]-2-methoxyphenoxy]-6-(hydroxy methyl)oxane-3,4,5-triol、8-羥基松脂醇、秦皮苷、osmanthuside H、芥子醛配糖物。以所得的化合物為數據基礎,對成分的潛在靶點進行整理分析,共得到129個潛在靶點。同時通過Uniprot數據庫(https://www.uniprot.org/)對已篩選的潛在靶點進行名稱校對并對基因名稱進行整理。

圖5 PLS-DA的得分圖(A)、3D圖(B) 和VIP值圖(C)
2.3.2 蛋白互作網絡(protein-protein interaction networks,PPI)的構建 將所獲得的129個潛在靶點信息,導入到STRING 11.5在線數據分析程序(https://cn.string-db.org/cgi/input.pl),設置物種為Homo sapines,蛋白交互分數高于0.4,其他參數不變,隱藏網絡中沒有連接的節點,獲得PPI圖,見圖6。將所得到的PPI網絡分析數據導入Cytoscape軟件,利用CytoNCA插件對數據結果進行分析,選取“度中心性”(degree)、“介數中心性”(betweenness)、“接近中心性”(closeness)3個參數作為分析標準[9],選取前10個共同高分的點作為核心靶點,共得到7個核心靶點。分別是腫瘤壞死因子(tumor necrosis factor,TNF,degree=65)、白細胞介素-6(interleukin 6,IL6,degree=64)、血管內皮生長因子(vascular endothelial growth factor A,VEGFA,degree=58)、半胱氨酸蛋白酶-3(Caspase-3,CASP3,degree=57)、環磷酸腺反應元件結合蛋白(cyclic AMP-responsive element-binding protein 1,CREB1,degree=55)、c-Fos蛋白(FOS,degree=50)、雌激素受體(estrogen receptor,ESR1,degree=50),結果表明,以上潛在靶點主要與秦皮素(fraxetin)、β-谷甾醇(β-sitosterol)、秦皮乙素(esculetin)、咖啡酸(caffeic acid)、熊果酸(ursolic acid)有關。
2.3.3 基因本體(gene ontology,GO)功能富集分析與京都基因和基因組百科全書(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
(1)GO功能富集分析:運用David分析程序對已整理的潛在靶點進行GO富集的生物過程(biological process,BP)、細胞組成(cellular component,CC)、分子功能(molecular function,MF)3個項目進行分析,共得到689條富集結果。其中MF 114條,主要富集在蛋白質結合、酶結合、大分子復合物結合、神經遞質受體活性等;CC 66條,主要富集到質膜、核質、神經元投影、細胞質等;BP 509條,主要富集到對信號轉導、藥物的反應、細胞增殖正調控、炎癥反應、RNA聚合酶II啟動子轉錄的正調控、凋亡過程的正調控等過程。本研究針對基因富集度高的前30個結果進行繪圖展示,見圖7。
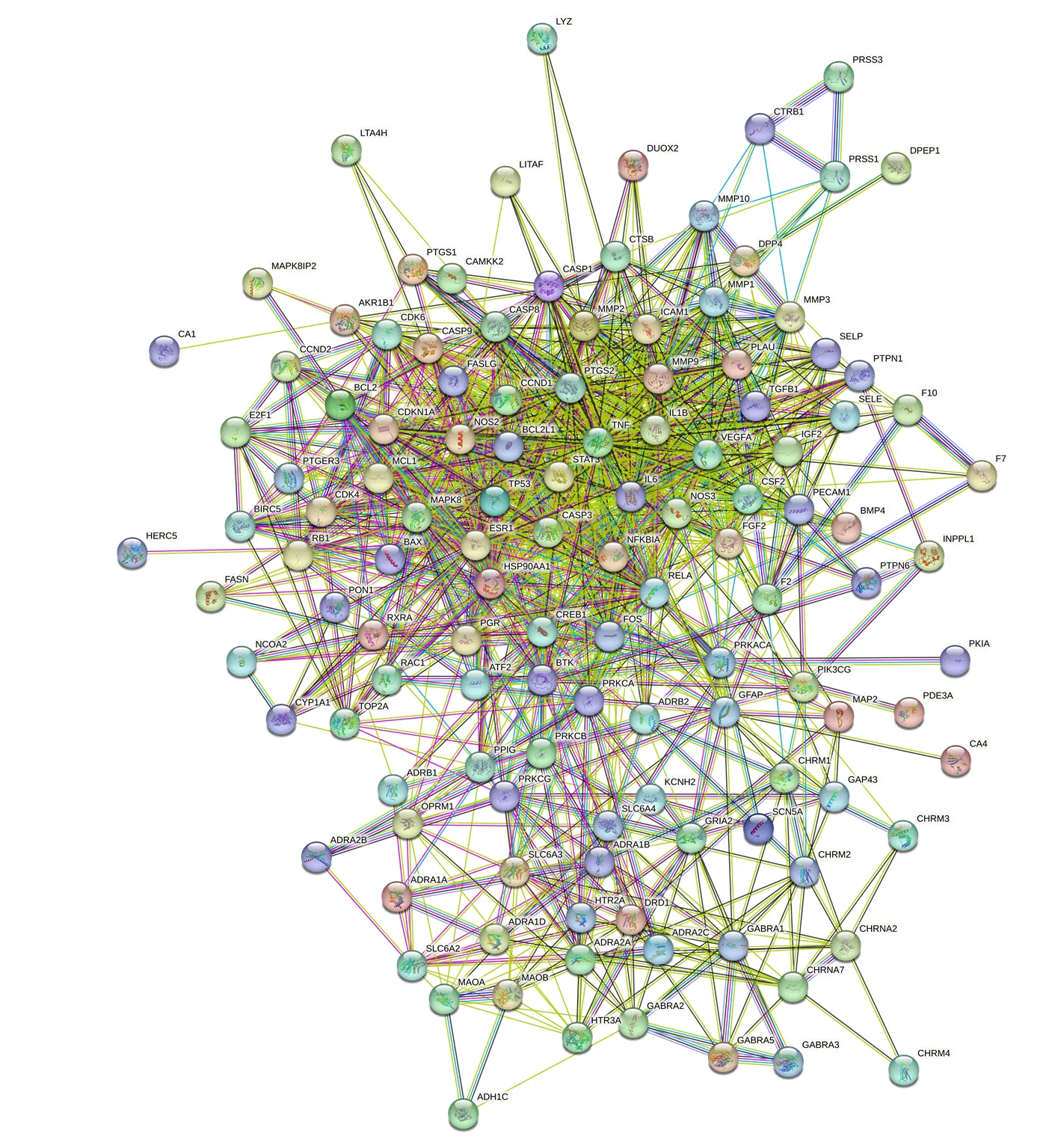
圖6 秦皮相關潛在靶點PPI網絡結構
(2)KEGG通路富集分析:通過David對潛在靶點進行KEGG通路富集分析,共得到159條富集通路數據結果,其中主要富集到的通路為癌癥通路(pathways in cancer)、脂質與動脈粥樣硬化(lipid and atherosclerosis)、人類巨噬細胞感染(human cytomegalovirus infection)、神經活性配體-受體相互作用(neuroactive ligand-receptor interaction)、乙型肝炎(hepatitis B)、皰疹病毒感染(Kaposi sarcoma- associated herpesvirus infection)、PI3K-Akt信號通路(PI3K-Akt signaling pathway)、化學致癌作用-受體激活(chemical carcinogenesis-receptor activation)、神經變性途徑-多種疾病(pathways of neurodegeneration- multiple diseases)等。本研究選取富集程度最高的30條KEGG通路展示,其中圓點大小表示通路所關聯的基因數,顏色為通路富集分析結果值的負對數(-lg),數值越大顏色越紅,反之越綠。其中癌癥通路的值較小顏色偏紅,且相比其他通路效果顯著,見圖8。
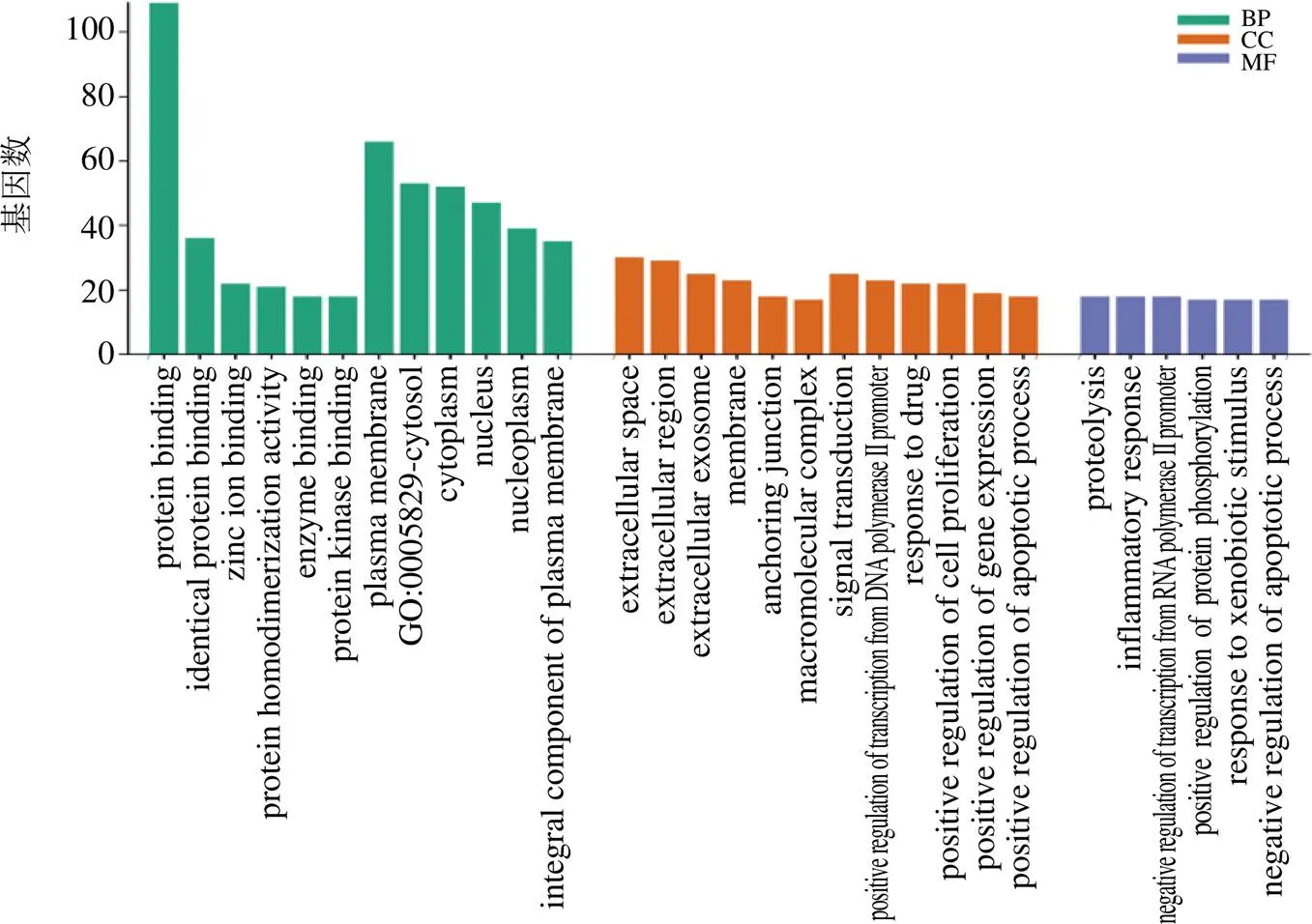
圖7 秦皮GO富集分析結果

圖8 秦皮KEGG通路富集分析結果
以上結果表明秦皮具有多成分、多靶點的作用特點,能夠通過調節多種通路從而達到治療疾病的目的。
2.3.4 有效成分相關網絡關系構建 通過Cytoscape軟件對整理的有效成分、潛在靶點、富集通路進行網絡關系構建并繪圖。用藍色長方形表示有效成分,紅色橢圓形表示潛在靶點,黃色菱形代表富集通路。利用邊將各節點相連接以表示各節點間的關聯性。其中,Pathways in cancer具有最高的富集相關基因數41個,degree最高的前10個潛在靶點分別為大鼠轉錄因子P65(transcription factor p65,RELA,degree=76)、蛋白激酶Cβ抗體(protein kinase Cβ type,PRKCB,degree=66)、蛋白激酶Cα抗體(protein kinase Cα type,PRKCA,degree=66)、絲裂原激活蛋白激酶8(mitogen-activated protein kinase 8,MAPK8,degree=65)、蛋白激酶Cγ抗體(protein kinase C γ type,PRKCG,degree=58)、人cAMP依賴性蛋白激酶α催化亞基(cAMP-dependent protein kinase catalytic subunit α,PRKACA,degree=57)、TNF(degree=57)、人細胞凋亡調節因子BAX(apoptosis regulator BAX,BAX,degree=50)、人核因子κB抑制蛋白α(NF-κB inhibitor alpha,NFKBIA,degree=49)、腫瘤抑制基因P53蛋白(cellular tumor antigen p53,TP53,degree=49)。以上靶點多與秦皮素(fraxetin)、β-谷甾醇(β-sitosterol)、秦皮乙素(esculetin)、咖啡酸(caffeic acid)、熊果酸(ursolic acid)有關。與PPI結果一致。見圖9。
2.3.5 成分-靶點-通路分析 通過數據庫篩選得出秦皮21個活性成分,包括秦皮苷、秦皮素、秦皮乙素、秦皮甲素、β-谷甾醇、8-羥基松脂醇等進行網絡藥理學分析,建立“成分-靶點-通路”的網絡圖,獲得129個核心靶點、159條關鍵通路。PPI以及活性成分相關網絡關系構建結果均顯示秦皮素、β-谷甾醇、秦皮乙素、咖啡酸及熊果酸與潛在靶點關系密切。但由于β-谷甾醇廣泛存在于富含脂質的植物中,具有多種生物活性[10],咖啡酸廣泛存在于多種植物種,如升麻、薄荷、杜仲、蒲公英等。熊果酸廣泛分布于女貞、熊果、枇杷等62種植物種。此3類成分不符合Q-Marker篩選的特有性原則,故以上三者不作為秦皮的Q-Marker。秦皮素和秦皮乙素作為秦皮具有一定專屬性的香豆素類成分。同時,秦皮素、秦皮乙素可通過調節如癌癥、脂質與動脈粥樣硬化、乙型肝炎病毒、神經配體-受體相互作用信號通路、巨細胞病毒感染、沙門氏菌感染等通路從而達到防治癌癥、心血管病、神經性疾病,抗炎、抗菌及抗病毒感染等,能夠作為秦皮與藥效相關聯的潛在Q-Marker,后期可通過分子對接技術對該化合物與核心靶點展開進一步分析。

圖9 有效成分-潛在靶點-富集通路網絡關系圖
2.4 秦皮飲片潛在的Q-Marker含量測定
通過指紋圖譜結合模式識別得出4號峰秦皮苷、6號峰秦皮乙素、9號峰秦皮甲素均為不同基原秦皮的共有峰,且具有良好的代表性和差異性,符合Q-Marker的可測性和溯源性原則;網絡藥理學結果顯示秦皮素和秦皮乙素與治療癌癥、抗炎、心血管病等疾病的治療相關,與秦皮的藥效相符合,具有良好的有效性;同時,秦皮中的秦皮素和秦皮乙素為具有一定專屬性的香豆素類成分,滿足Q-Marker中的特有性。故可作為秦皮與藥效相關聯的潛在Q-Marker。
綜合考慮到Q-Marker辨識的可測性、溯源性、有效性及特有性原則,以及秦皮現行質量標準,可最終確認秦皮苷、秦皮乙素、秦皮素、秦皮甲素作為秦皮潛在的Q-Marker,進行含量測定。
2.4.1 色譜條件 同“2.1.1”項下色譜條件。
2.4.2 對照品溶液的制備 按“2.1.2”項下對照品溶液的制備方法進行制備。
2.4.3 供試品溶液的制備 按“2.1.3”項下供試品溶液的制備方法進行制備。
2.4.4 方法學考察
(1)線性關系考察:精密吸取各對照品溶液。按“2.1.1”項色譜條件進樣并記錄結果。以其質量濃度為橫坐標(),相對應的峰面積為縱坐標(),計算標準曲線方程,見表2。
(2)精密度試驗:取秦皮S7批次供試品溶液,按“2.1.1”項色譜條件連續進樣6次,記錄色譜圖。秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面積RSD分別為1.78%、0.75%、1.88%、1.89%,表明儀器精密度良好。

表2 4個指標性成分的線性回歸方程
(3)重復性試驗:平行制備6份秦皮S7批次供試品溶液,按“2.1.1”項色譜條件進行測定,記錄色譜圖。秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面積RSD分別為1.43%、0.88%、2.22%、0.76%,表明該方法重復性良好。
(4)穩定性試驗:取秦皮S7批次供試品溶液,按“2.1.1”項色譜條件分別在0、2、4、8、12、24 h進行測定,秦皮苷、秦皮乙素、秦皮素、秦皮甲素的峰面積RSD分別為1.39%、0.66%、1.73%、2.77%,表明秦皮供試品溶液在24 h內穩定性良好。
(5)加樣回收率試驗:精密稱定6份已知含量的秦皮飲片樣品S7批次粉末2.5 g,加入4種成分對照品適量,按“2.1.3”項下方法制備供試品溶液,按“2.1.1”項色譜條件進樣分析,記錄各成分峰面積。計算秦皮苷、秦皮乙素、秦皮素、秦皮甲素平均加樣回收率分別為99.37%、101.34%、94.78%、100.96%,RSD分別為1.64%、2.13%、2.71%、2.27%,表明實驗結果準確。
2.4.5 秦皮樣品含量測定 分別精密稱取15批秦皮樣品,按照“2.1.3”項下的方法進行供試品溶液的制備,并按“2.1.1”項下的色譜條件進樣,測定峰面積,計算樣品中Q-Marker秦皮苷、秦皮乙素、秦皮素、秦皮甲素的含量,結果見表3。
3 Q-Marker預測分析
基于Q-Marker“五原則”,本研究采用指紋圖譜結合化學模式識別、網絡藥理學方法對秦皮Q-Marker進行辨識。
從生源途徑來看,秦皮苷、秦皮甲素、秦皮素和秦皮乙素屬于香豆素類化學成分[11],多由莽草酸途徑合成而來。由磷酸戊糖途徑中間產物4-磷酸赤蘚糖(erythrose 4-phosphate,E4P)和糖酵解中間產物磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP),化合后經幾步反應生成葬草酸,莽草酸經磷酸化形成5-磷酸莽草酸后,再與PEP反應,以后生成分支酸,分支酸可以合成色氨酸,也可以轉變為預苯酸,由預苯酸可生成苯丙氨酸和酪氨酸,二者是苯丙烷類化合物生物合成的起始分子,由苯丙氨酸解氨酶催化苯丙氨酸脫氨形成肉桂酸,進一步轉化為香豆素[12],具有一定特有性。

表3 15批秦皮飲片中Q-Marker的含量測定
從傳統功效來看,秦皮味苦、澀、寒,歸肝、膽經、大腸經,具有清熱燥濕,清肝明目,收澀止痢、止帶的功效。秦皮苷、秦皮甲素、秦皮乙素和秦皮素均具有抗菌、抗病毒、抗炎鎮痛,抗氧化、抗腫瘤、保肝和抗纖維化等作用[2]。同時,網絡藥理學結果表明多數靶點與秦皮素和秦皮乙素有關,二者所對應的信號通路能夠與秦皮療效相符,亦可作為秦皮潛在的Q-Marker,具有有效性。
從可測性來看,Wang等[13]采用UPLC-MS測定了秦皮素在血漿中的藥動學過程;Kim等[14]采用HPLC技術測定了秦皮乙素在大鼠血漿中的水平以及體內組織分布;葉皓等[15]通過HPLC方法測定了秦皮中的秦皮甲素及秦皮苷的含量。同時,本研究首先建立了不同基原及產地15批秦皮飲片的HPLC指紋圖譜,在21個共有峰中指認出4號峰(秦皮苷)、6號峰(秦皮乙素)、7號峰(秦皮素)、9號峰(秦皮甲素),通過PCA和PLS-DA得出秦皮苷、秦皮乙素、秦皮甲素具有較好的代表性及差異性,可作為秦皮潛在的Q-Marker,符合Q-Marker篩選的可測性及溯源性原則。
因此,本研究最終確定了將秦皮苷、秦皮甲素、秦皮素、秦皮乙素作為秦皮潛在的Q-Marker,進而進行Q-Marker的含量測定。
4 討論
中藥質量是中醫藥產業所面臨的瓶頸問題,也是中藥臨床安全有效的基礎。中藥Q-Marker的提出,針對中藥的中醫藥體系特點,能夠從根本上解決中藥質量評價的共性問題直接與中藥質量屬性的本質內涵及其有效性完整表達、特有性和專屬性要求以及質量傳遞與溯源角度統領中藥質量研究[4]。
本研究結果表明,依據Q-Marker可測性、有效性、特有性的篩選原則,整合HPLC指紋圖譜、模式識別及網絡藥理學方法對多基原多產地的秦皮進行Q-Marker的辨識及測定,篩選出秦皮苷、秦皮甲素、秦皮素、秦皮乙素作為秦皮潛在的Q-Marker。一方面,由于在數據庫中,秦皮苷與秦皮甲素所關聯的靶點較少,導致網絡藥理學結果并未得出,秦皮苷和秦皮甲素的有效性數據,推測其可能原因是數據庫內容更新不及時,因此網絡藥理學數據結果也具有一定的時效性,但大量研究已經證明二者與秦皮有效性密切相關。例如,秦皮苷能夠改善肺部組織炎癥,減輕脂多糖誘導的肺組織炎癥和氧化損傷[16],抑制炎癥因子,分解代謝基因表達,促進軟骨特異性基因上調,清除活性氧(reactive oxygen species,ROS),對外骨關節炎具有抗炎和抗氧化的作用[17]。秦皮苷能夠抑制脂多糖誘導的小鼠炎性細胞因子,并保護小鼠免受內毒素導致的休克[18],對大鼠缺血性再灌注急性腎損傷具有一定的預防作用[19]。秦皮甲素能夠抑制鼻咽癌細胞增殖、糖酵解以及遷移和侵襲[20]。能夠通過調節核因子κB(nuclear factor kappa-B,NF-κB)抑制心肌損傷[21],對蛋氨酸膽堿缺乏誘導的非酒精性脂肪肝炎具有保護作用[22]。通過下調原癌基因FBI-1(factor that binds to inducer of short transcripts-1,FBI-1)抑制乳腺癌細胞的增殖[23]。秦皮甲素還能夠改善實驗性糖尿病腎病的認知功能損傷,并通過調節絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路誘導抗氧化應激和抗炎作用[24]。上述研究能夠充分說明秦皮苷及秦皮甲素與有效性的關系,為二者能夠作為秦皮的Q-Marker提供有力依據。
另一方面,雖然HPLC結合模式識別技術僅篩選出秦皮苷、秦皮甲素、秦皮乙素作為秦皮Q-Marker,但網絡藥理學結果表明秦皮素能夠通過多途徑多靶點參與秦皮的藥理作用,考慮到Q-Marker篩選有效性原則,將其納入潛在Q-Marker的辨識范圍。研究表明,秦皮素可以通過抑制表皮生長因子受體(epidermal growth factor receptor,EGFR)及蛋白激酶B (protein kinase B,AKT)信號通路從而發揮抗癌作用[25]。秦皮素能夠通過磷脂酰肌醇-3-激酶(phosphatidylinositol kinase/protein kinase B,PI3K/Akt)通路下調氨酸蛋白激酶(polo-like kinase 4,PLK4)以抑制前列腺癌細胞的增殖、遷移和侵襲[26],通過蛋白質酪氨酸激酶2(janus kinase 2,JAK2)/轉錄激活因子3(transcription activation factor 3,TAF3)信號通路抑制結腸腺癌細胞的生長[27],還能通過阻止信號通路轉導因子和TAF3的激活來抑制非小細胞肺癌細胞的增殖[28],通過拮抗信號轉導和轉錄激活因子-3(signal transducer and activator of transcription 3,STAT3)激活增強吉西他濱抗腫瘤效果并抑制胰腺癌發展[29]。秦皮素在較低濃度下可以阻止低密度脂蛋白氧化,濃度較高時通過核因子相關因子2(nuclear factor E2 related factor 2,Nrf2)/抗氧化響應元件(antioxidant response element,ARE)激活誘導抗氧化酶,從而達到抗動脈粥樣硬化的作用[30]。另外,秦皮素能夠通過PI3K/Akt通路抑制活性氧依賴的自噬,從而抑制海馬神經元細胞的神經毒性[31],還能減輕缺血性卒中后小膠質細胞介導的神經炎癥[32],同時對腦缺血再灌注具有保護作用,促進腦修復和血管生成[33]。抑制腫瘤壞死因子-α(tumor necrosis factor α,TNF-α)和白細胞介素-1β(interlenkin-1β,IL-1β)誘導的軟骨細胞凋亡并抑制炎癥介質釋放導致的半胱氨酸蛋白酶caspase-8和caspase-3活化降低,從而達到對軟骨的保護和對骨質疏松癥預防的作用[34-35]。研究顯示,秦皮乙素可抑制STAT3磷酸化而達到抗腫瘤的目的[36]。能夠將細胞周期阻滯在G0/G1和G2/M期,下調周期素D1(Cyclin D1)等的表達,誘導細胞凋亡,增加caspase 3表達,從而抑制腎透明細胞癌細胞(clear cell renal cell carcinoma,ccRCC)的增殖、遷移和侵襲[37]。秦皮乙素還能夠通過影響磷酸甘油酸激酶2(porcine phosphoglycerate kinase 2,PGK2)、甘油磷酸酯脫氫酶2(glycerol-3-phosphate dehydrogenase 2,GPD2)、葡萄糖磷酸異構酶(glucose phosphate isomerase,GPI)的活性而具有抗癌作用[38],還可以在體內外抑制血管內皮生長因子(vascular endothelial growth factor,VEGF)誘導的血管生成,從而對腫瘤組織的擴散轉移產生抑制作用[39]。秦皮乙素還可通過調節細胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)/ NF-κB/AKT以及維甲酸相關孤兒受體γt抗體(ROR gamma T protein,RORγt)/IL-17的表達產生抗炎作用[40],通過血紅素氧合酶-1(heme oxygenase-1,HO-1)表達抑制促炎細胞因子產生[41]。秦皮乙素還能通過沉默調節蛋白3(recombinant sirtuin 3,SIRT3)調節STAT3和miR-19b的活性從而抑制纖溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)的水平,達到對急性冠狀動脈綜合征的治療作用[42],通過苷酸活化的蛋白激酶(adenosine 5′-monophosphate activated protein kinase,AMPK)介導的STAT3還對動脈粥樣硬化存在潛在影響[43],亦或通過降低低密度脂蛋白,從而降低動脈粥樣硬化的發生率[44]。秦皮乙素還能以劑量相關性方式對腦I/R損傷起到保護作用,能夠降低Caspase-3水平,其保護作用機制主要是通過上調B細胞淋巴瘤/白血病-2的表達和下調促細胞凋亡基因的表達來發揮抗凋亡活性[45]。秦皮乙素在體內體外均對乙型肝炎病毒的表達具有抑制作用,可有效抑制乙型肝炎病毒復制[46]。
HPLC指紋圖譜建立過程中,本實驗發現色譜柱溫度略高時,秦皮中某些組分分離度不夠,因此,最終確定柱溫25 ℃,各峰分離效果得到較好的改善。另外,本研究中還存在著保留時間略向后漂移的現象,導致相對保留時間RSD略大于2%,但均小于3%的實驗結果,可能是由于流動相中使用了磷酸,實驗過程中平衡色譜柱時間不足有關。在模式識別中,本實驗選擇HCA、PCA和PLS-DA 3種手段,三者能夠從不同角度對秦皮飲片的產地和基原進行深層次解析。HCA與PLS-DA對樣品進行分類的結果大體相同,PLS-DA較HCA分類更為準確,不但能夠對樣品基原進行分類,對于HCA尚無法實現準確產地區分的樣品,亦可進行大致分類,可對HCA結果進行補充。PLS-DA與PCA結果亦基本相符,體現在通過VIP篩選的主要差異性成分與PCA主成分1所涵蓋的主要峰大體相同,由于PLS-DA包含了PCA的思想,同時又對因變量有較強的解釋能力,更適合Q-Marker的準確篩選。
本研究整合指紋圖譜、模式識別及網絡藥理學手段,辨識出符合“五原則”的秦皮苷、秦皮素、秦皮甲素、秦皮乙素作為秦皮潛在的Q-Marker,能夠為多基原多產地的秦皮質量評價奠定基礎,該研究模式能夠為多基原多產地中藥飲片的Q-Marker辨識合質量控制提供研究思路。
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典 [S]. 一部. 2020: 282.
[2] 聶安政, 林志健, 張冰. 秦皮化學成分和藥理作用研究進展 [J]. 中草藥, 2016, 47(18): 3332-3341.
[3] 劉昌孝, 陳士林, 肖小河, 等. 中藥質量標志物(Q-Marker): 中藥產品質量控制的新概念 [J]. 中草藥, 2016, 47(9): 1443-1457.
[4] 劉昌孝. 中藥質量標志物 (Q-marker): 提高中藥質量標準及質量控制理論和促進中藥產業科學發展 [J]. 中草藥, 2019, 50(19): 4517-4518.
[5] 謝培山. 中藥色譜指紋圖譜鑒別的概念、屬性、技術與應用 [J]. 中國中藥雜志, 2001, 26(10): 653-655.
[6] Wang Y L, Cui T, Li Y Z,. Prediction of quality markers of traditional Chinese medicines based on network pharmacology [J]., 2019, 11(4): 349-356.
[7] 李泮霖, 蘇薇薇. 網絡藥理學在中藥研究中的最新應用進展 [J]. 中草藥, 2016, 47(16): 2938-2942.
[8] 劉樹森, 孫文斌, 李文蘭, 等. 基于網絡藥理學的黃連-吳茱萸藥對抗癌及治療心腦血管疾病機制研究 [J]. 中草藥, 2020, 51(1): 109-117.
[9] 梅茜, 夏金鑫, 郭爽, 等. 基于指紋圖譜及網絡藥理學的白芍質量標志物 (Q-marker) 預測分析 [J]. 中草藥, 2020, 51(10): 2627-2633.
[10] Babu S, Jayaraman S. An update on β-sitosterol: A potential herbal nutraceutical for diabetic management [J]., 2020, 131: 110702.
[11] 葉迎, 柏冬, 包強, 等. 秦皮提取物中香豆素類成分含量測定方法研究 [J]. 中國中醫藥信息雜志, 2015, 22(8): 83-87.
[12] 劉良敘, 李朝風, 王嘉偉, 等. 芳香類天然產物的合成生物學研究進展 [J]. 生物工程學報, 2021, 37(6): 2010-2025.
[13] Wang H D, Xiao B X, Hao Z Q,. Simultaneous determination of fraxin and its metabolite, fraxetin, in rat plasma by liquid chromatography-tandem mass spectrometry and its application in a pharmacokinetic study [J]., 2016, 1017/1018: 70-74.
[14] Kim J S, Ha T Y, Ahn J,. Analysis and distribution of esculetin in plasma and tissues of rats after oral administration [J]., 2014, 19(4): 321-326.
[15] 葉皓, 李敬偉, 曾博文, 等. HPLC法測定秦皮4種有效成分的含量 [J]. 沈陽藥科大學學報, 2019, 36(12): 1087-1092.
[16] 徐宜全, 蔡忠貴, 潘延成. 秦皮苷減輕LPS誘導的肺炎小鼠肺組織炎癥和氧化損傷 [J]. 免疫學雜志, 2021, 37(9): 809-815.
[17] 詹彥婷, 覃再嫩, 鄭立. 秦皮苷對脂多糖誘導的軟骨細胞氧化應激和炎癥因子的影響 [J]. 廣西醫科大學學報, 2021, 38(1): 28-34.
[18] Li W F, Li W Q, Yu J J,. Fraxin inhibits lipopolysaccharide-induced inflammatory cytokines and protects against endotoxic shock in mice [J]., 2020, 34(1): 91-101.
[19] Topda?? ?, Tanyeli A, Akdemir F N E,. Preventive effects of fraxin on ischemia/reperfusion-induced acute kidney injury in rats [J]., 2020, 242: 117217.
[20] 沈永華, 汪峻峰, 程澤星, 等. 秦皮甲素抑制人鼻咽癌細胞系HNE-3增殖 [J]. 基礎醫學與臨床, 2022, 42(8): 1237-1242.
[21] 吳暖, 黃婧文, 王志勝, 等. 秦皮甲素通過調節TLR/NF-κB途徑抑制脂多糖誘導的心肌損傷 [J]. 中國現代應用藥學, 2021, 38(24): 3143-3148.
[22] Yang X D, Chen Z, Ye L,. Esculin protects against methionine choline-deficient diet-induced non-alcoholic steatohepatitis by regulating the Sirt1/NF-κB p65 pathway [J]., 2021, 59(1): 922-932.
[23] Mo M, Chen M J, Huang Y,. Esculin inhibits proliferation of triple negative breast cancer cells by down-regulating FBI-1 [J]., 2020, 42(8): 629-634.
[24] Song Y, Wang X C, Qin S K,. Esculin ameliorates cognitive impairment in experimental diabetic nephropathy and induces anti-oxidative stress and anti-inflammatory effects via the MAPK pathway [J]., 2018, 17(5): 7395-7402.
[25] 趙婧暉, 謝鯤鵬, 隋佳琪, 等. 秦皮素通過抑制EGFR及其下游AKT信號通路抑制MCF-7細胞增殖及遷移 [J]. 中國生物化學與分子生物學報, 2016, 32(1): 56-63.
[26] Ma Z, Sun Y F, Peng W X. Fraxetin down-regulates polo-like kinase 4 (PLK4) to inhibit proliferation, migration and invasion of prostate cancer cells through the phosphatidylinositol 3-kinase (PI3K)/protein kinase B (Akt) pathway [J]., 2022, 13(4): 9345-9356.
[27] Ren S, Xing Y W, Wang C B,. Fraxetin inhibits the growth of colon adenocarcinoma cells via the2/signal transducer and activator of transcription 3 signalling pathway [J]., 2020, 125: 105777.
[28] Zhang Y, Wang L, Deng Y,. Fraxetin suppresses proliferation of non-small-cell lung cancer cells via preventing activation of signal transducer and activator of transcription 3 [J]., 2019, 248(1): 3-12.
[29] Guo Y Y, Xiao Y Y, Guo H C,. The anti-dysenteric drug fraxetin enhances anti-tumor efficacy of gemcitabine and suppresses pancreatic cancer development by antagonizing STAT3 activation [J]., 2021, 13(14): 18545-18563.
[30] Thuong P T, Pokharel Y R, Lee M Y,. Dual anti-oxidative effects of fraxetin isolated from[J]., 2009, 32(9): 1527-1532.
[31] Zhang T Y, Zhou B T, Sun J Y,. Fraxetin suppresses reactive oxygen species-dependent autophagy by the PI3K/Akt pathway to inhibit isoflurane-induced neurotoxicity in hippocampal neuronal cells [J]., 2022, 42(4): 617-628.
[32] Deng S J, Ge J W, Xia S N,. Fraxetin alleviates microglia-mediated neuroinflammation after ischemic stroke [J]., 2022, 10(8): 439.
[33] Cui Y H, Liu M H, Zuo L,. Fraxetin protects rat brains from the cerebral stroke via promoting angiogenesis and activating PI3K/Akt pathway [J]., 2022, 44(3): 400-409.
[34] Wang Q, Zhuang D, Feng W C,. Fraxetin inhibits interleukin-1β-induced apoptosis, inflammation, and matrix degradation in chondrocytes and protects rat cartilage[J]., 2020, 28(12): 1499-1506.
[35] Kuo P L, Huang Y T, Chang C H,. Fraxetin inhibits the induction of anti-Fas IgM, tumor necrosis factor-alpha and interleukin-1beta-mediated apoptosis by Fas pathway inhibition in human osteoblastic cell line MG-63 [J]., 2006, 6(7): 1167-1175.
[36] 李朝燕, 丁亞杰, 李佳, 等. 秦皮乙素抗腫瘤作用及機制 [J]. 中華中醫藥學刊, 2019, 37(7): 1620-1623.
[37] Duan J Y, Shi J, Ma X,. Esculetin inhibits proliferation, migration, and invasion of clear cell renal cell carcinoma cells [J]., 2020, 125: 110031.
[38] Wu S T, Liu B, Ai Z Z,. Esculetin inhibits cancer cell glycolysis by binding tumor PGK2, GPD2, and GPI [J]., 2020, 11: 379.
[39] Park S L, Won S Y, Song J H,. Esculetin inhibits VEGF-induced angiogenesis bothand[J]., 2016, 44(1): 61-76.
[40] Lee H C, Liu F C, Tsai C N,. Esculetin ameliorates lipopolysaccharide-induced acute lung injury in mice via modulation of the AKT/ERK/NF-κB and RORγt/IL-17 pathways [J]., 2020, 43(3): 962-974.
[41] Kim Y, Park Y, Namkoong S,. Esculetin inhibits the inflammatory response by inducing heme oxygenase-1 in cocultured macrophages and adipocytes [J]., 2014, 5(9): 2371-2377.
[42] Katta S, Karnewar S, Panuganti D,. Mitochondria- targeted esculetin inhibits PAI-1 levels by modulating STAT3 activation and miR-19b via SIRT3: Role in acute coronary artery syndrome [J]., 2018, 233(1): 214-225.
[43] Karnewar S, Vasamsetti S B, Gopoju R,. Mitochondria-targeted esculetin alleviates mitochondrial dysfunction by AMPK-mediated nitric oxide and SIRT3 regulation in endothelial cells: Potential implications in atherosclerosis [J]., 2016, 6: 24108.
[44] Lee M J, Chou F P, Tseng T H,.protocatechuic acid or esculetin can inhibit oxidative LDL induced by either copper ion or nitric oxide donor [J]., 2002, 50(7): 2130-2136.
[45] Wang C, Pei A J, Chen J,. A natural coumarin derivative esculetin offers neuroprotection on cerebral ischemia/reperfusion injury in mice [J]., 2012, 121(6): 1007-1013.
[46] Huang S X, Mou J F, Luo Q,Anti-hepatitis B virus activity of esculetin fromand[J]., 2019, 24(19): 3475.
Predictive analysis of quality markers ofbased on fingerprint and network pharmacology
XU Bei-lei1, 2, 3, 4, SUN Wen-bin1, WANG Hao1, 2, 3, WANG Jin-hong1, 2, 3, HU Yang1, 2, 3, YANG Bo1, 2, 3, LIU Jing-jing5, YANG Na-na1, ZHOU En-bao6, HAN Xiao-yu1, LIU Shu-sen1, WU Wen-qi1, LI Wen-lan1, 2, 3
1. School of Pharmacy, Harbin University of Commerce, Harbin 150076, China 2. Engineering Research Center of Natural Anti-cancer Drugs, Ministry of Education, Harbin 150076, China 3. Heilongjiang Key Laboratory of Preventive and Therapeutic Drug Research of Senile Diseases, Harbin 150076, China 4. Engineering Research Center of Chinese Medicine Production and New Drug Development, Beijing 102488, China 5. National Institutes for Food and Drug Control, Beijing 100050, China 6. Department of Medicine, Lunan Pharmaceutical Group Co., Ltd., Linyi 276000, China
To research the potential quality marker (Q-Marker) of Qinpi () based on “five principles” of Q-Markers combined with fingerprint and network pharmacology methods from the perspective of measurability and effectiveness.The fingerprints of 15 batches ofwere established and subjected to clustering analysis (HCA), principal component analysis (PCA) and partial least squares discriminant analysis (PLS-DA). The network diagram of “components-targets-pathways” was constructed using network pharmacology. Q-Marker ofwas predicted and quantitative analysis was conducted simultaneously.The fingerprints of 15 batches ofwere established. Among the 21 common peaks, peak 4 fraxin, peak 6 esculetin, peak 7 fraxetin, and peak 9 esculin were identified. HCA, PCA, and PLS-DA results were generally consistent. Network pharmacology screened out 21 potential active components, 129 core targets and 159 key pathways. The fingerprint, pattern recognition and network pharmacology methods were integrated to jointly identify the potential Q-Marker of the principles of testability, effectiveness and uniqueness—fraxin, esculetin, fraxetin and esculin. The contents of that four components were 0.93%?2.51%, 0.98%?1.41%, 0.71%?1.09%, 0.66%?1.25%.The potential Q-Marker ofwas predicted by the integration of fingerprint, pattern recognition and network pharmacology. This study provided a scientific basis for the comprehensive control and evaluation of the quality ofdecoction pieces, and a theoretical reference for the study of quality standards for multi-base traditional Chinese medicine.
; Q-Marker; fingerprint; network pharmacology; multivariate statistical analysis; fraxin; esculetin; fraxetin; esculin
R284.1
A
0253 - 2670(2023)15 - 5019 - 14
10.7501/j.issn.0253-2670.2023.15.027
2022-12-09
黑龍江省自然科學基金聯合指導計劃(LH2020H069);哈爾濱商業大學青年學術骨干支持計劃(2020CX12);中央支持地方高校改革發展資金人才培養項目
徐蓓蕾(1983—),女,博士,副教授,研究方向為中藥藥效物質與質量評價研究。Tel: 15124515866 E-mail: xubeilei2006@163.com
通信作者:李文蘭(1967—),女,博士,教授/院長,研究方向為中藥藥效物質與質量評價研究。Tel: 13936169153 E-mail: lwldzd@163.com
[責任編輯 王文倩]

