IC-離子選擇電極法聯測高鹵廢水中氟、氯和溴
于樂,韓強強,汪恒
(江西華贛瑞林稀貴金屬科技有限公司,江西豐城 331100)
含鹵廢水是工業中常見的生產廢水,其中含有大量的鹵鹽如氯化鈉、溴化鈉等,有的還含有一定量的氟離子。如果不對此類含鹵廢水加以處理回收,一方面會造成鹵鹽資源和水資源的浪費,另一方面還會造成管道的腐蝕、破壞以及水生環境的污染[1]。 含鹵工業廢水的成分復雜、種類多樣,各種成分含量和分布變化很大,因此目前國內依舊缺少針對含鹵工業廢水的科學的分析方法,尤其是對廢水中的氟、氯、溴等有害元素的測定方法探究較少。對含鹵工業廢水的分析處理往往只能通過經驗總結來實現,這嚴重影響到對含鹵工業廢水的高效處理回收和利用。隨著含鹵工業廢水處理需求量的急劇增加,亟需制定一種能準確測定高鹵廢水中氟、氯、溴元素的分析方法, 從而科學系統地指導處理廢水回收蒸發鹽以及資源循環利用。 考慮到采用傳統的分析方法難以準確測定氟、氯和溴的含量[2-9],本文針對含鹵工業廢水氟質量濃度低,氯、溴質量濃度高的特性,探索出一種通過將試樣稀釋為不同的稀釋倍數,利用IC-離子選擇電極法聯測高鹵廢水中氟、氯和溴量的實驗方法。
1 實驗部分
1.1 儀器與工作條件
本試驗采用:1)PXSJ-216F 型離子選擇電極(上海雷磁儀器有限公司)。環境溫度為20 ℃,電極斜率為90%~100%,PF-202 氟離子復合電極,232-01 型參比電極。 2)Aquion-1200 型離子色譜儀(賽默飛世爾科技有限公司)。 陰離子色譜柱和保護柱,柱溫箱溫度30 ℃; 抑制器電流為112 mA; 淋洗液流速為1.0 mL/min;淋洗液濃度為45 mmol/L。
1.2 試劑及配制方法
本實驗主要試劑包括:1)鹽酸(ρ鹽酸=1.19 g/mL);2)硝酸(ρ硝酸=1.42 g/mL);3)氫氧化鈉溶液(ρ氫氧化鈉=50 g/L);4)鹽酸(1+1);5)總離子強度緩沖溶液(TISABI);6)氟化鈉(PT);7)氯化鈉(PT);8)溴化鉀(PT)。 除非另有說明,本實驗僅使用確認為優級純的試劑和一級水。
試劑配制方法:1)氫氧化鈉溶液的配制。稱取5 g 分析純氫氧化鈉于燒杯中,用水稀釋至100 mL,置于試劑瓶中。2)鹽酸(1+1)的配制。稱取50 mL 分析純鹽酸于燒杯中,用水稀釋至100 mL,置于試劑瓶中。3)總離子強度緩沖溶液的配制。稱取58.8 g 分析純二水檸檬酸鈉和85 g 硝酸鈉于燒杯中, 加水溶解,用鹽酸調節至中性,用水稀釋至1 000 mL 容量瓶中,稀釋至容量瓶刻度并搖勻。
1.3 實驗方法
搖勻工業廢水水樣, 移取100 mL 的工業廢水,用氫氧化鈉溶液或者鹽酸調至中性,平均分成兩份。一份稀釋50 倍,加入10 mL 總離子強度調節緩沖溶液,轉移40 mL 至50 mL 的容量瓶,加水稀釋至刻度并混勻,放置于離子選擇電極上。在選定的儀器工作條件下, 各元素的校正曲線與標準系列溶液進行測定。 另一份稀釋5 000 倍,轉移100 mL 至100 mL的容量瓶中混勻,經預處理柱有效去除陽離子后,將其放置于Aquion-1200 型離子色譜儀上, 在選定的儀器工作條件下, 按各元素的校正曲線與標準系列溶液同時進行測定。
1.4 混合標準系列溶液的配制
1)氟標準儲備液的配制。 將基準物質氟化鈉在100~105 ℃的條件下烘干至恒重, 準確稱取2.211 0 g溶于適量水中,然后將其全部轉移至1 000 mL 的容量瓶中,用去離子水稀釋至刻度,搖勻,再移入干燥的塑料瓶中貯存。此配制溶液中,氟的質量濃度為1000 μg/mL;亦可購買市售有證標準物質。
2)氯標準儲備液的配制。 將基準物質氯化鈉在500~600 ℃的條件下灼燒至恒重, 準確稱取1.648 5 g溶于適量水中,然后將其全部轉移至1 000 mL 的容量瓶中,用去離子水稀釋至刻度,搖勻,再移入干燥的塑料瓶中貯存。此配制溶液中,氯的質量濃度為1000 μg/mL;亦可購買市售有證標準物質。
3)溴標準儲備液的配制。 將基準物質溴化鉀在100~105 ℃的條件下烘干至恒重, 準確稱取1.490 0 g溶于適量水中,然后將其全部轉移至1 000 mL 的容量瓶中,用去離子水稀釋至刻度,搖勻,再移入干燥的棕色瓶中貯存。此配制溶液中,溴的質量濃度為1000 μg/mL;亦可購買市售有證標準物質。
4)氟標準溶液的配制。 準確移取10 mL 氟標準儲備液于100 mL 的容量瓶中,用去離子水稀釋至刻度,混勻。 此溶液中,氟的質量濃度為100 μg/mL。
5)氯、溴混合標準溶液的配制。 準確移取10 mL氯標準儲備液和10 mL 溴標準儲備液于100 mL 容量瓶中,用去離子水稀釋至刻度混勻。此溶液中,氯、溴的質量濃度均為100 μg/mL。
6)氟標準系列溶液的配制。 分別移取0 mL、0.50 mL、1.00 mL、2.00 mL、5.00 mL、10.00 mL、20.00mL 氟標準溶液,依次對應置于同一組50 mL 容量瓶中,用去離子水稀釋至刻度,混勻定容。
7)氯溴混合標準系列溶液的配制。 分別移取0 mL、0.50 mL、1.00 mL、2.00 mL、5.00 mL、10.00 mL、20.00 mL 氯、溴混合標準溶液,依次對應置于同一組100 mL 容量瓶中,用去離子水稀釋至刻度,混勻定容。 7 組標準溶液分別標記為空白、標準1、標準2、標準3、標準4、標準5、標準6。此混合標準系列溶液中各元素的質量濃度見表1。
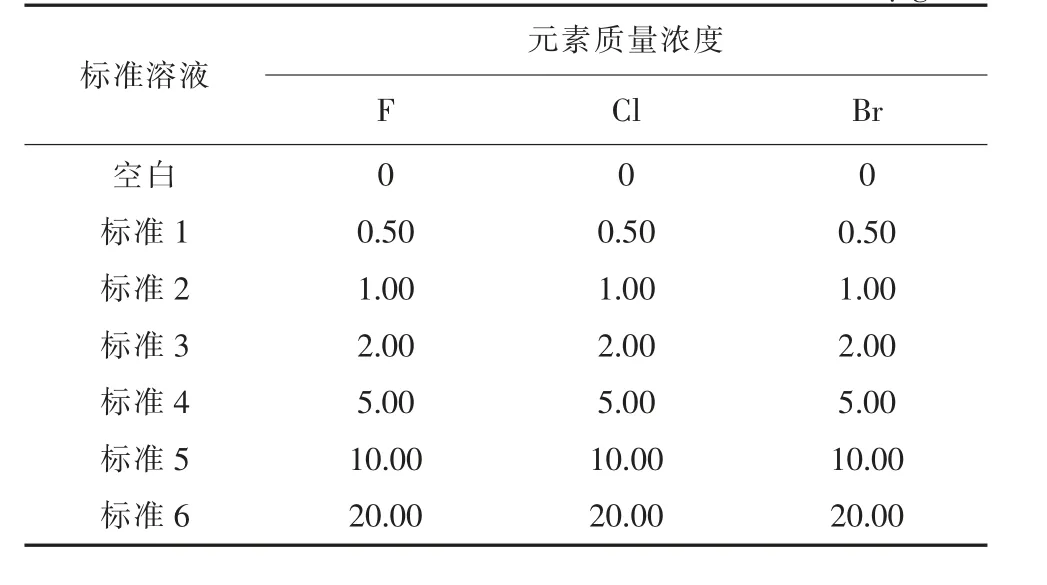
表1 混合標準系列溶液中各元素的質量濃度μg/mL
2 結果與討論
2.1 儀器參數條件的選擇
用氟元素標準系列溶液和試樣溶液, 用所選電極依次檢測,觀察屏幕上顯示的讀數。比較被測氟元素的靈敏度及干擾情況,最終確定干擾小、背景低、信噪比高的條件為離子選擇電極參數條件。
用各單元素標準溶液、 混合標準溶液和試樣溶液,在所選各元素的分析線處依次掃描,觀察屏幕上顯示的色譜輪廓圖像。 比較被測元素各譜圖的靈敏度及色譜干擾情況,最終確定干擾小、背景低、信噪比高的條件為離子色譜儀參數條件。
2.2 校正曲線線性和檢出限
在選定的儀器和儀器工作條件下, 使用氟標準系列溶液及氯溴混合標準系列溶液,建立校正曲線,連續測定11 次試劑空白溶液,以3 倍標準偏差計算方法檢出限,10 倍標準偏差計算方法測定下限,結果見表2。
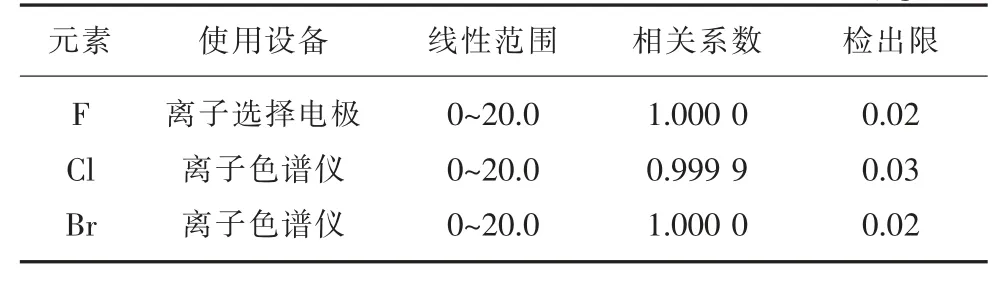
表2 校正曲線參數和檢出限μg/mL
2.3 測定條件的選擇
1)取樣體積。在其他條件不變的情況下,分別取樣10 mL、30 mL、50 mL、70 mL、100 mL 進行測定實驗,根據所測定元素的代表性情況,確定最適宜的取樣體積。 實驗結果見表3。
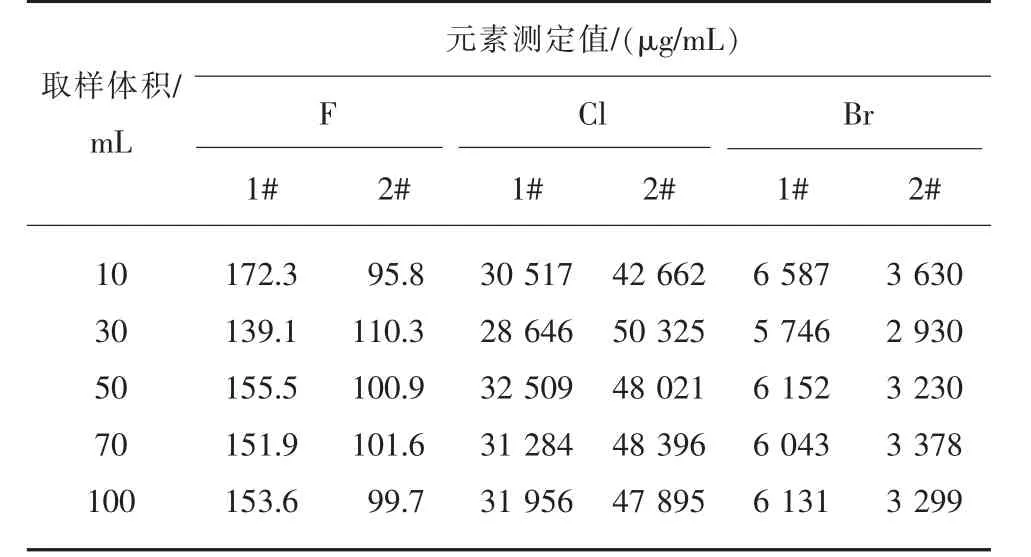
表3 取樣體積對測定的影響
由表3 可知,隨著取樣體積的減少,樣本代表性隨之降低,氟、氯和溴的測定結果不穩定。 當取樣體積超過50 mL 時,樣品雜質偏低不影響測量,氟、氯和溴測定結果更好。考慮到離子選擇電極操作方便,本文選定取樣體積為50 mL。
2)溶液pH 值。 在其他條件不變的情況下,分別選擇pH 值為3、5、7、9、11 的溶液進行測定實驗,根據測定結果,確定最佳的溶液酸度。 實驗結果見表4。
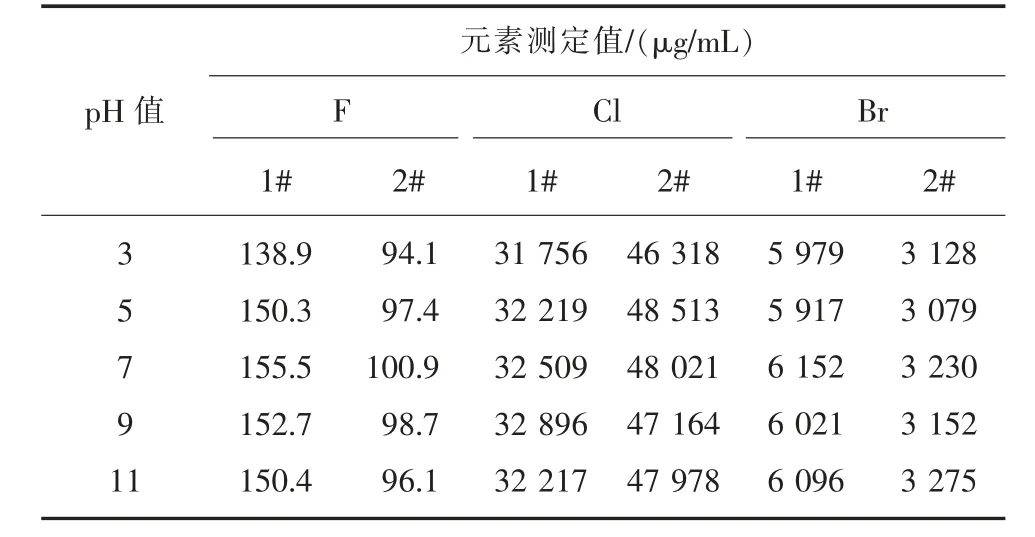
表4 酸度對測定的影響
由表4 可知,在酸性溶液中,H+離子與部分F-離子形成HF 或HF2-,會降低F-離子的質量濃度;在堿性溶液中, 電極LaF3薄膜與OH-離子發生反應而使溶液中F-離子濃度增加。 當pH=7 時,氟的測定結果最好,因此本文選定溶液pH=7。
3)溫度。在其他條件不變的情況下,分別在16 ℃、18 ℃、20 ℃、22 ℃、25 ℃的溫度下進行實驗。根據測定結果,確定最佳的實驗溫度。 實驗結果見表5。

表5 溫度對測定的影響
由表5 可知, 溫度對氟離子電極的電勢有一定影響。溫度每升高10 ℃,電勢斜率值大約增加2 mV左右。溫度在20 ℃時,氟、氯、溴測定值基本一致,本實驗選定溫度為20 ℃(室溫)。
2.4 預處理后溶液陽離子實驗
在其他條件不變的情況下, 分別選擇離子選擇電極和離子色譜儀的待測溶液進行ICP-OES 離子測定實驗,實驗結果見表6。
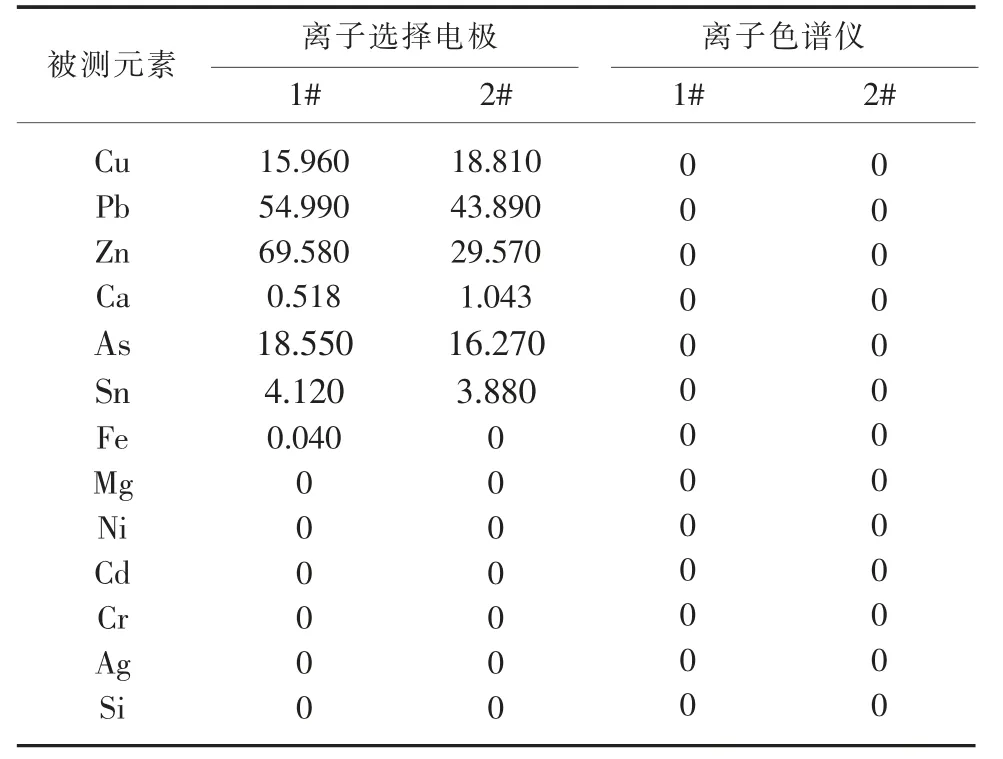
表6 溶液陽離子試驗μg/mL
在離子選擇電極氟的測定中, 加入總離子強度調節緩沖液,可以控制溶液的pH,消除溶液間離子強度差異對電位的影響。由于稀釋倍數足夠,預處理后這些離子含量很低,對離子色譜法氯,溴測定結果基本沒有影響。
2.5 鹽濃度的影響
在其他條件不變的情況下,分別選擇TISABI 體積分數為0%、0.50%、1.00%、2.00%、5.00%、10.00%的溶液進行測定實驗,實驗結果見表7。
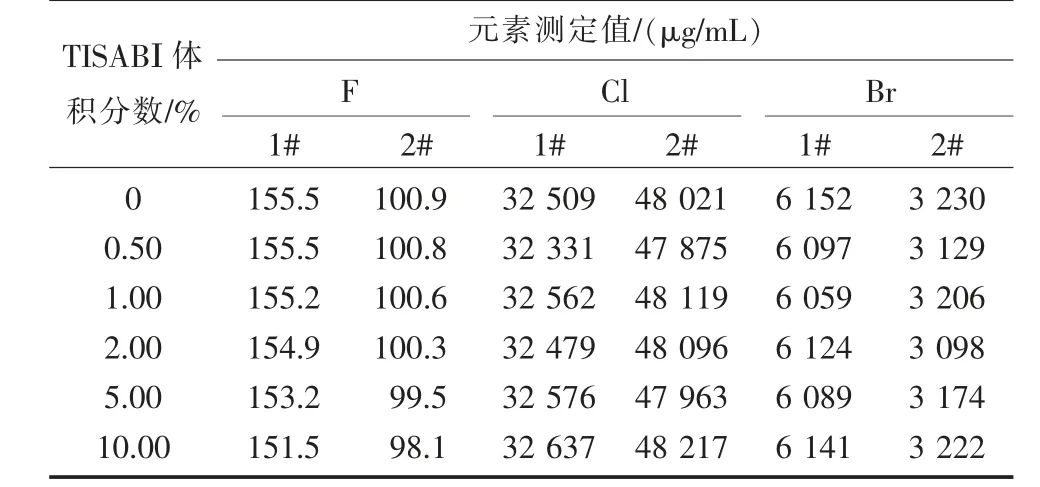
表7 鹽濃度對測定的影響
由表7 可知,由于稀釋倍數足夠,鹽濃度對電極及離子色譜交換樹脂的影響可忽略不計,對氟、氯、溴測定結果趨于穩定。
2.6 精密度試驗
按照實驗方法分析1#、2#樣品,所得結果見表8。相對標準偏差(RSD,n=7)為0.643%~1.588%,可見本方法精密度高。
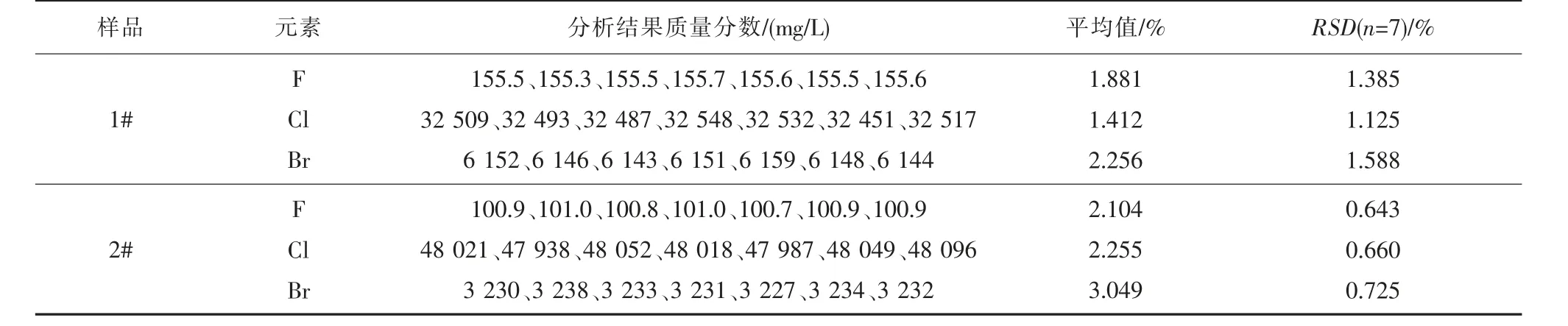
表8 精密度試驗結果(n=7)
2.7 加標回收試驗
用1#、2#樣品按實驗方法進行標準加入回收試驗,其結果見表9。 加標回收率在95.9%~104.8%之間,可見本方法準確度高。
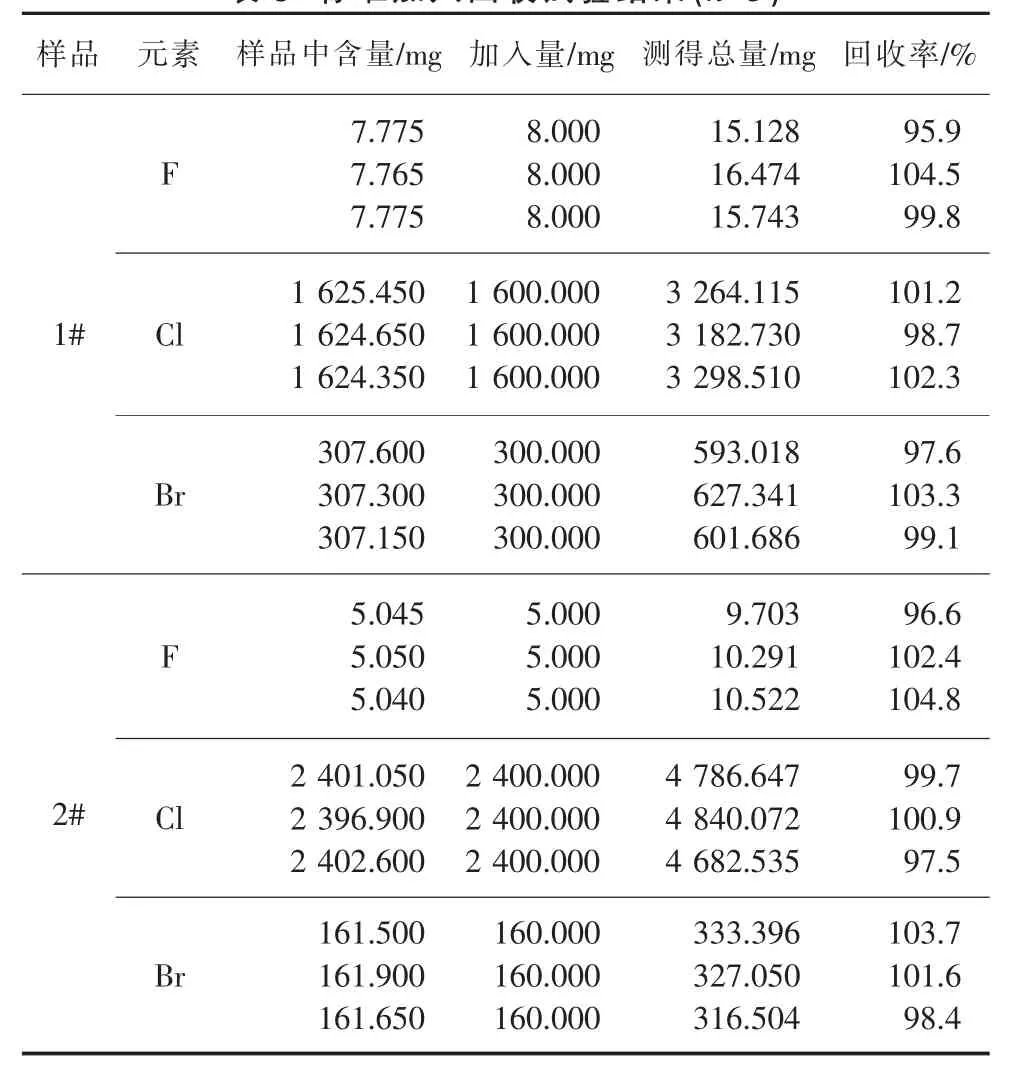
表9 標準加入回收試驗結果(n=3)
3 結論
通過對試樣的處理、測定介質、基體元素對測定元素的影響及工作曲線線性等進行了試驗,選擇了最佳測定條件,并在此條件下進行方法精密度和標準加入回收率的考察,證明本方法精密度好,準確度高,適用于聯測高鹵廢水中氟、氯和溴的測定。

