miR-519d-3p靶向HIF-1α抑制高糖誘導(dǎo)的人視網(wǎng)膜微血管內(nèi)皮細(xì)胞功能障礙及血管生成
蔡 暉,宋 穎,石華宗,楊豫湘
0 引言
糖尿病視網(wǎng)膜病變(diabetic retinopathy,DR)作為糖尿病患者眼部的最常見(jiàn)并發(fā)癥,是導(dǎo)致視力下降、甚至失明的主要原因[1]。目前全球DR患者超過(guò)9300萬(wàn),伴隨糖尿病發(fā)病率的持續(xù)攀升和發(fā)病年齡逐漸年輕化,DR已成為全球性的公共衛(wèi)生問(wèn)題。目前針對(duì)DR的治療方法,如抗血管內(nèi)皮生長(zhǎng)因子藥物的使用、玻璃體內(nèi)注射類(lèi)固醇激素、激光光凝和手術(shù)治療等,雖然可以部分緩解疾病進(jìn)展,但療效仍不能令人滿(mǎn)意[2]。DR的主要病理變化是視網(wǎng)膜微血管病變,與高糖誘導(dǎo)的人視網(wǎng)膜微血管內(nèi)皮細(xì)胞(human retinal microvascular endothelial cells,HRMEC)功能障礙和血管生成增加密切相關(guān)。因此,如何逆轉(zhuǎn)HRMEC功能障礙和抗血管生成是眼科專(zhuān)業(yè)領(lǐng)域亟需解決的關(guān)鍵問(wèn)題。作為一類(lèi)非編碼RNA,微小核糖核酸(microRNA,miRNA)參與多種病理生理過(guò)程,包括調(diào)節(jié)細(xì)胞增殖、凋亡、分化和各種代謝過(guò)程,維持干細(xì)胞的干性潛能,參與炎癥和免疫反應(yīng)等[3]。近期研究發(fā)現(xiàn),miR-519d-3p參與調(diào)控腫瘤進(jìn)展、骨關(guān)節(jié)炎和心肌梗死等疾病進(jìn)展[4-6],但在DR中的研究較少。本團(tuán)隊(duì)前期已報(bào)道,低氧誘導(dǎo)因子-1α(hypoxia inducible factor 1 subunit alpha,HIF-1α)在視網(wǎng)膜內(nèi)皮細(xì)胞增殖、炎癥、血管生成等方面具有重要作用[7],但調(diào)控HIF-1α的miRNA尚不清楚。基于生物信息學(xué)分析推測(cè)HIF-1α可能是miR-519d-3p的靶基因,值得對(duì)該現(xiàn)象進(jìn)行進(jìn)一步研究。基于以上依據(jù),本研究采用高糖誘導(dǎo)HRMEC制作細(xì)胞模型,旨在明確miR-519d-3p對(duì)高糖誘導(dǎo)的HRMEC功能障礙和血管生成的影響,并闡明其對(duì)HIF-1α的調(diào)控機(jī)制,以期從細(xì)胞層面證實(shí)miR-519d-3p/HIF-1α軸在DR中的重要作用。
1 材料和方法
1.1 材料HRMEC,由中山大學(xué)中山眼科中心提供;內(nèi)皮細(xì)胞培養(yǎng)基(1001)、胎牛血清、生長(zhǎng)因子、青霉素/鏈霉素溶液,上海中喬新舟生物科技有限公司;D-(+)-葡萄糖(ST1228)、細(xì)胞增殖/毒性檢測(cè)試劑盒(Cell Counting Kit-8,CCK-8)(C0038)、Hoechst 33342染色試劑盒(C1029),上海碧云天生物技術(shù)公司;陰性對(duì)照模擬物(5’-UUCUCCGAACGUGUCACGUTT-3’)、miR-519d-3p模擬物(5’-CAAAGUGCCUCCCUUUAGAGUG-3’)、HIF-1α過(guò)表達(dá)載體[將HIF-1α mRNA(NM_001530.4)編碼區(qū)序列插入pcDNA3.1(+)載體構(gòu)建],上海吉瑪基因公司;Lipofectamine 3000轉(zhuǎn)染試劑盒(L3000-015),美國(guó)賽默飛世爾科技公司;實(shí)時(shí)熒光定量PCR檢測(cè)試劑盒(638315),北京寶日醫(yī)生物技術(shù)公司;HIF-1α抗體(ab179483)、β-肌動(dòng)蛋白(β-actin)(ab8227)抗體,上海艾博抗公司;酶聯(lián)免疫吸附試驗(yàn)(enzyme-linked immunosorbent assay,ELISA)相關(guān)人腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)檢測(cè)試劑盒(EH0302)、人白細(xì)胞介素(interleukin,IL)-1β檢測(cè)試劑盒(EH0185)、人IL-6檢測(cè)試劑盒(EH0201),武漢菲恩生物科技有限公司;Matrigel基質(zhì)膠(354234),美國(guó)康寧公司;HIF-1α野生型報(bào)告載體[包含miR-519d-3p結(jié)合位點(diǎn)(HIF-1α-wt)]、HIF-1α突變型報(bào)告載體[不包含miR-519d-3p結(jié)合位點(diǎn)(HIF-1α-mut)],廣州伯信生物科技公司;熒光素酶報(bào)告基因檢測(cè)試劑盒(E1910),美國(guó)普洛麥格公司。
1.2 方法
1.2.1 細(xì)胞培養(yǎng)HRMEC復(fù)蘇后采用內(nèi)皮細(xì)胞培養(yǎng)基進(jìn)行培養(yǎng),培養(yǎng)箱條件設(shè)定為37℃、5% CO2、95%空氣。當(dāng)細(xì)胞生長(zhǎng)至約90%融合時(shí),用0.25%胰蛋白酶消化細(xì)胞,按1∶4傳代培養(yǎng)。當(dāng)細(xì)胞傳至2~3代后,取生長(zhǎng)狀態(tài)良好的細(xì)胞進(jìn)行實(shí)驗(yàn)。
1.2.2 制作高糖細(xì)胞模型將D-(+)-葡萄糖用適量PBS溶液配制成5、30mmol/L濃度。取HRMEC在6孔板中鋪板,每孔細(xì)胞數(shù)約為5×106個(gè)。向細(xì)胞中分別加入5、30mmol/L濃度葡萄糖培養(yǎng)48h,建立正常(NG)和高糖(HG)細(xì)胞模型。
1.2.3 實(shí)驗(yàn)分組和細(xì)胞轉(zhuǎn)染對(duì)照組:HG細(xì)胞模型轉(zhuǎn)染陰性對(duì)照模擬物;甘露醇組:在對(duì)照組基礎(chǔ)上加入25mmol/L甘露醇;miR-519d-3p過(guò)表達(dá)組:HG細(xì)胞模型轉(zhuǎn)染miR-519d-3p模擬物;miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組:HG細(xì)胞模型共轉(zhuǎn)染miR-519d-3p模擬物和HIF-1α過(guò)表達(dá)載體。取HRMEC在6孔板中鋪板,每孔細(xì)胞數(shù)約為5×106個(gè),培養(yǎng)過(guò)夜。當(dāng)細(xì)胞生長(zhǎng)至約70%~90%融合時(shí),利用Lipofectamine 3000轉(zhuǎn)染試劑進(jìn)行細(xì)胞轉(zhuǎn)染。對(duì)照組、甘露醇組、miR-519d-3p過(guò)表達(dá)組、miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組分別轉(zhuǎn)染100pmol陰性對(duì)照模擬物、100pmol陰性對(duì)照模擬物、100pmol miR-519d-3p模擬物、50pmol miR-519d-3p和2.0μg HIF-1α過(guò)表達(dá)載體。繼續(xù)培養(yǎng)24h后,收集細(xì)胞供后續(xù)使用。
1.2.4 實(shí)驗(yàn)指標(biāo)
1.2.4.1 實(shí)時(shí)熒光定量PCR法檢測(cè)各組miR-519d-3p的表達(dá)情況提取各組細(xì)胞總RNA,并逆轉(zhuǎn)錄為cDNA。利用cDNA作為模版在ABI 7100熒光定量PCR儀上進(jìn)行擴(kuò)增反應(yīng)。擴(kuò)增條件為:95℃ 20min,隨后95℃ 10s,58℃ 30s,72℃ 30s,共40個(gè)循環(huán)。miR-519d-3p引物:5’- CAAAGTGCCTCCCTTTAGAGTG -3’(正向),5’- CGCAGGGTCCGAGGTATTC -3’(反向); U6引物:5’- CTCGCTTCGGCAGCACA -3’( 正向),5’- AACGCTTCACGAATTTGCGT-3’( 反向)。以U6為內(nèi)參對(duì)照,采用2-ΔΔCt法計(jì)算各組中miR-519d-3p的相對(duì)表達(dá)水平。
1.2.4.2Westernblotting法檢測(cè)各組HIF-1α蛋白的表達(dá)情況采用RIPA蛋白裂解液提取各組細(xì)胞總蛋白,BCA法測(cè)定總蛋白濃度。取40μg總蛋白依次進(jìn)行電泳、轉(zhuǎn)膜和封閉過(guò)程。隨后加入HIF-1α抗體(1∶1000稀釋)4℃過(guò)夜,以β-actin抗體(1∶10000稀釋)為內(nèi)參對(duì)照。第2d利用辣根過(guò)氧化物酶標(biāo)記山羊抗兔二抗(1∶5000)37℃孵育1h后,暗室添加超敏發(fā)光液并曝光膠片。利用Quantity-one軟件對(duì)蛋白條帶進(jìn)定量分析,計(jì)算HIF-1α蛋白的相對(duì)表達(dá)水平。
1.2.4.3 熒光素酶報(bào)告基因?qū)嶒?yàn)檢測(cè)miR-519d-3p和HIF-1α的結(jié)合位點(diǎn)情況取對(duì)照組和miR-519d-3p過(guò)表達(dá)組細(xì)胞在24孔板中鋪板,每孔細(xì)胞數(shù)約為2×105個(gè),培養(yǎng)過(guò)夜。利用Lipofectamine 3000轉(zhuǎn)染試劑向細(xì)胞中分別轉(zhuǎn)染0.8μg HIF-1α-wt和0.8μg HIF-1α-mut報(bào)告載體。培養(yǎng)24h后,裂解細(xì)胞,利用熒光素酶報(bào)告基因檢測(cè)試劑盒測(cè)定各組螢火蟲(chóng)熒光值和海腎熒光值。以螢火蟲(chóng)熒光值為內(nèi)參對(duì)照,計(jì)算相對(duì)熒光素酶活性。相對(duì)熒光素酶活性=(海腎熒光值/螢火蟲(chóng)熒光值)×100%。
1.2.4.4CCK-8法檢測(cè)各組細(xì)胞增殖情況取各組細(xì)胞在96孔板中鋪板,每孔細(xì)胞數(shù)約為7×103個(gè)。培養(yǎng)24、48、72h后分別向細(xì)胞中加入12μL CCK-8溶液,繼續(xù)培養(yǎng)3h。采用多功能酶標(biāo)儀測(cè)定各組450nm波長(zhǎng)時(shí)的吸光度(A)值。
1.2.4.5Hoechst33342染色法檢測(cè)各組細(xì)胞凋亡情況取各組細(xì)胞在24孔板細(xì)胞爬片中鋪板,每孔細(xì)胞數(shù)約為2×105個(gè),培養(yǎng)48h。取出細(xì)胞爬片,采用4%多聚甲醛37℃固定30min,并以5%牛血清白蛋白37℃封閉1.5h。利用Hoechst 33342溶液在暗室中染色2min,通過(guò)熒光顯微鏡觀察凋亡細(xì)胞,并計(jì)算細(xì)胞凋亡率。細(xì)胞凋亡率=[凋亡細(xì)胞數(shù)量(5個(gè)隨機(jī)視野)/總細(xì)胞數(shù)量(5個(gè)隨機(jī)視野)]×100%。
1.2.4.6ELISA法檢測(cè)各組細(xì)胞外液TNF-α、IL-1β、IL-6蛋白的表達(dá)情況取各組細(xì)胞在24孔板中鋪板,每孔細(xì)胞數(shù)約為2×105個(gè),培養(yǎng)48h。收集各組細(xì)胞外液,將細(xì)胞外液加入反應(yīng)板中37℃孵育1h,并加入生物素化抗體工作液37℃孵育1h。隨后加入酶結(jié)合物工作液37℃避光孵育30min。最后加入顯色底物37℃避光孵育15min。通過(guò)多功能酶標(biāo)儀分析各組450nm波長(zhǎng)下的A值,對(duì)比標(biāo)準(zhǔn)曲線,計(jì)算TNF-α、IL-1β、IL-6濃度。
1.2.4.7 小管形成實(shí)驗(yàn)檢測(cè)各組新生毛細(xì)血管管腔樣結(jié)構(gòu)形成情況將24孔板用Matrigel基質(zhì)膠均勻鋪墊,放置30min使其硬化。取各組細(xì)胞在24孔板中鋪板,每孔細(xì)胞數(shù)約為2×105個(gè),培養(yǎng)24h。采用倒置顯微鏡觀察新生毛細(xì)血管樣結(jié)構(gòu)形成情況。采用Image-J軟件計(jì)算各組單個(gè)視野下新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量。
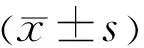
2 結(jié)果
2.1NG和HG細(xì)胞模型中miR-519d-3p和HIF-1α蛋白的表達(dá)情況比較實(shí)時(shí)熒光定量PCR法檢測(cè)NG和HG細(xì)胞模型中miR-519d-3p的表達(dá)水平分別為0.039±0.005和0.022±0.003,且與NG比較,HG中miR-519d-3p表達(dá)水平顯著減少,差異有統(tǒng)計(jì)學(xué)意義(t=9.62,P<0.01)。Western blotting法檢測(cè)NG和HG細(xì)胞模型中HIF-1α蛋白的表達(dá)水平分別為0.104±0.009和0.627±0.044,且與NG比較,HG中HIF-1α蛋白表達(dá)水平顯著增加,差異有統(tǒng)計(jì)學(xué)意義(t=26.53,P<0.01),見(jiàn)圖1。

圖1 Western blotting法檢測(cè)NG和HG細(xì)胞模型中HIF-1α蛋白的表達(dá)情況。
2.2 各組細(xì)胞中miR-519d-3p和HIF-1α蛋白的表達(dá)情況比較實(shí)時(shí)熒光定量PCR法檢測(cè)各組細(xì)胞中miR-519d-3p的表達(dá)情況比較,差異有統(tǒng)計(jì)學(xué)意義(F=171.89,P<0.01),且與對(duì)照組比較,miR-519d-3p過(guò)表達(dá)組和miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組細(xì)胞中miR-519d-3p表達(dá)水平均顯著增加,差異有統(tǒng)計(jì)學(xué)意義(t=38.90、29.16,均P<0.01)。Western blotting法檢測(cè)各組細(xì)胞中HIF-1α蛋白的表達(dá)情況比較,差異有統(tǒng)計(jì)學(xué)意義(F=126.53,P<0.01),且與對(duì)照組比較,miR-519d-3p過(guò)表達(dá)組細(xì)胞中HIF-1α蛋白表達(dá)水平顯著減少,而miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組細(xì)胞中HIF-1α蛋白表達(dá)水平顯著增加,差異有統(tǒng)計(jì)學(xué)意義(t=16.21、44.72,均P<0.01)。對(duì)照組和甘露醇組細(xì)胞中miR-519d-3p和HIF-1α蛋白的表達(dá)情況比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(t=0.17、0.13,均P>0.05),見(jiàn)圖2,表1。

表1 各組細(xì)胞中miR-519d-3p和HIF-1α蛋白的表達(dá)情況比較

圖2 Western blotting法檢測(cè)各組細(xì)胞中HIF-1α蛋白的表達(dá)情況 A:對(duì)照組;B:甘露醇組;C:miR-519d-3p過(guò)表達(dá)組;D:miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組。
2.3miR-519d-3p和HIF-1α的結(jié)合位點(diǎn)檢測(cè)生物信息學(xué)分析顯示,HIF-1α可能是miR-519d-3p的靶基因,miR-519d-3p中“CGUGAAA”序列可以與HIF-1α 3’-非編碼區(qū)(3’-UTR)中“GCACUUU”序列特異性結(jié)合,見(jiàn)圖3。熒光素酶報(bào)告基因?qū)嶒?yàn)檢測(cè)對(duì)照組和miR-519d-3p過(guò)表達(dá)組細(xì)胞中HIF-1α-wt載體的相對(duì)熒光素酶活性分別為5.237±0.485和2.309±0.183,且與對(duì)照組比較,miR-519d-3p過(guò)表達(dá)組細(xì)胞中HIF-1α-wt載體的相對(duì)熒光素酶活性顯著減少,差異有統(tǒng)計(jì)學(xué)意義(t=10.44,P<0.01);對(duì)照組和miR-519d-3p過(guò)表達(dá)組細(xì)胞中HIF-1α-mut載體的相對(duì)熒光素酶活性分別為5.081±0.357和4.837±0.392,差異無(wú)統(tǒng)計(jì)學(xué)意義(t=0.497,P>0.05)。

圖3 miR-519d-3p和HIF-1α 3’-UTR之間的結(jié)合位點(diǎn)預(yù)測(cè)。
2.4 各組細(xì)胞增殖和凋亡情況比較CCK-8法檢測(cè)各組細(xì)胞A值(24、48、72h)比較,差異有統(tǒng)計(jì)學(xué)意義(F=39.57、28.29、52.14,均P<0.01)。Hoechst 33342染色法檢測(cè)各組細(xì)胞凋亡率比較,差異有統(tǒng)計(jì)學(xué)意義(F=74.46,P<0.01)。與對(duì)照組比較,miR-519d-3p過(guò)表達(dá)組細(xì)胞24、48、72h A值均顯著增加,細(xì)胞凋亡率顯著減少,差異有統(tǒng)計(jì)學(xué)意義(t=14.19、17.23、9.88、26.07,均P<0.01)。與miR-519d-3p過(guò)表達(dá)組比較,miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組細(xì)胞24、48、72h A值均顯著減少,細(xì)胞凋亡率顯著增加,差異有統(tǒng)計(jì)學(xué)意義(t=4.65、8.41、5.32、32.02,均P<0.01)。對(duì)照組和甘露醇組細(xì)胞24、48、72h A值和細(xì)胞凋亡率比較差異無(wú)統(tǒng)計(jì)學(xué)意義(t=0.01、0.18、0.06、0.77,均P>0.05),見(jiàn)圖4,表2。

表2 各組細(xì)胞不同時(shí)間點(diǎn)細(xì)胞增殖和凋亡率比較

圖4 Hoechst 33342染色法檢測(cè)各組細(xì)胞凋亡情況 A:對(duì)照組;B:甘露醇組;C:miR-519d-3p過(guò)表達(dá)組;D:miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組。
2.5 各組細(xì)胞外液炎癥因子表達(dá)和血管生成情況比較ELISA法檢測(cè)各組細(xì)胞外液TNF-α、IL-1β、IL-6濃度比較,差異有統(tǒng)計(jì)學(xué)意義(F=65.59、74.91、57.88,均P<0.01)。小管形成實(shí)驗(yàn)檢測(cè)各組中新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量比較,差異有統(tǒng)計(jì)學(xué)意義(F=163.50,P<0.01)。與對(duì)照組比較,miR-519d-3p過(guò)表達(dá)組中TNF-α、IL-1β、IL-6濃度均顯著減少,新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量顯著減少,差異有統(tǒng)計(jì)學(xué)意義(t=14.94、25.28、7.29、16.19,均P<0.01)。與miR-519d-3p過(guò)表達(dá)組比較,miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組中TNF-α、IL-1β、IL-6濃度均顯著增加,新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量顯著增加,差異有統(tǒng)計(jì)學(xué)意義(t=7.32、17.05、26.81、6.34,均P<0.01)。對(duì)照組和甘露醇組中TNF-α、IL-1β、IL-6濃度和新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(t=0.20、0.32、0.55、0.17,均P>0.05),見(jiàn)圖5,表3。

表3 各組細(xì)胞外液炎癥因子表達(dá)和血管生成情況比較

圖5 小管形成實(shí)驗(yàn)檢測(cè)各組新生毛細(xì)血管管腔樣結(jié)構(gòu)形成情況 A:對(duì)照組;B:甘露醇組;C:miR-519d-3p過(guò)表達(dá)組;D:miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組。
3 討論
DR基本病理變化包括周細(xì)胞選擇性缺失、毛細(xì)血管基底膜增厚、微血管瘤形成、內(nèi)皮細(xì)胞增殖及新生血管導(dǎo)致的視網(wǎng)膜脫離。HRMEC在維持視網(wǎng)膜毛細(xì)血管的完整性方面發(fā)揮重要作用,高糖引起HRMEC功能障礙,破壞血-視網(wǎng)膜屏障,導(dǎo)致視網(wǎng)膜出血、滲出、脫離,促進(jìn)DR的發(fā)生和惡化。研究發(fā)現(xiàn),多種因素可以引起HRMEC功能障礙,如高級(jí)糖基化終產(chǎn)物積累、過(guò)氧化物酶體增殖體激活受體γ的失活、慢性炎癥、氧化應(yīng)激異常、生長(zhǎng)因子及細(xì)胞因子表達(dá)失調(diào)等[8]。此外,高糖還會(huì)影響負(fù)責(zé)表觀遺傳修飾和非編碼RNA功能的酶的活性,導(dǎo)致非編碼RNA表達(dá)異常。近年來(lái),miRNAs因其廣泛的調(diào)節(jié)功能而受到青睞,目前已發(fā)表的8篇相關(guān)論文共報(bào)道了93個(gè)miRNAs在DR患者和非DR患者中呈差異表達(dá),如miR-27b、miR-320a、miR-423-5p等[9],闡明這些miRNAs的作用機(jī)制將為DR治療提供新的線索。HG誘導(dǎo)HRMEC細(xì)胞模型是研究DR的常用體外模型,可用于研究該病的分子機(jī)制及防治策略。本研究發(fā)現(xiàn),高糖誘導(dǎo)HRMEC模型中miR-519d-3p表達(dá)下調(diào),與既往文獻(xiàn)[5]報(bào)道一致,表明結(jié)果可信。隨后本研究通過(guò)一系列細(xì)胞實(shí)驗(yàn)證實(shí),miR-519d-3p可以減輕高糖誘導(dǎo)的HRMEC功能障礙并抑制血管生成。
高糖可以引起視網(wǎng)膜內(nèi)皮細(xì)胞的增殖失調(diào),加速DR進(jìn)展。同時(shí),高糖還能誘導(dǎo)視網(wǎng)膜血管內(nèi)皮細(xì)胞凋亡增加,而用抗氧化酶處理能保護(hù)細(xì)胞免受氧化應(yīng)激,并降低細(xì)胞凋亡。研究顯示,炎癥因子包括TNF-α、IL-1β、IL-6在DR進(jìn)展中起著重要作用[10]。持續(xù)的高血糖導(dǎo)致視網(wǎng)膜缺血性改變,刺激血管內(nèi)皮生長(zhǎng)因子釋放,最終促進(jìn)新生血管生成。近年研究表明,一些異常表達(dá)的miRNAs在DR的發(fā)生發(fā)展中發(fā)揮重要作用,如miR-15b、miR-181、miR-373、miR-425-5p等,利用這些miRNAs有望開(kāi)發(fā)DR治療的新靶點(diǎn)[11-14]。miR-519d-3p位于人基因組19q13.42區(qū)域,參與調(diào)控細(xì)胞增殖、凋亡和炎癥等過(guò)程。本研究利用miR-519d-3p模擬物在高糖誘導(dǎo)的HRMEC模型中成功過(guò)表達(dá)miR-519d-3p,經(jīng)CCK-8法和Hoechst 33342染色法發(fā)現(xiàn),miR-519d-3p過(guò)表達(dá)組細(xì)胞24、48、72h吸光度值較對(duì)照組均顯著增加,而細(xì)胞凋亡率較對(duì)照組顯著減少。該結(jié)果與miR-519d-3p在其他類(lèi)型細(xì)胞中的功能一致,提示miR-519d-3p在DR中具有促進(jìn)細(xì)胞增殖作用。經(jīng)ELISA法檢測(cè)發(fā)現(xiàn),miR-519d-3p過(guò)表達(dá)組細(xì)胞外液TNF-α、IL-1β、IL-6的濃度較對(duì)照組均顯著減少,提示miR-519d-3p在DR中具有抗炎作用。這一結(jié)果與miR-519d-3p在初級(jí)成纖維細(xì)胞中促炎作用相悖,具體原因有待進(jìn)一步考究。此外,小管形成實(shí)驗(yàn)結(jié)果顯示,miR-519d-3p過(guò)表達(dá)組新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量較對(duì)照組顯著減少,與既往文獻(xiàn)[4]報(bào)道一致,提示miR-519d-3p在DR中具有抗血管生成作用。基于以上結(jié)果,可以得出miR-519d-3p在DR發(fā)生和發(fā)展中均具有重要作用。
眾多研究表明,miRNAs參與負(fù)性調(diào)控目的基因表達(dá),其作用方式主要通過(guò)與目的基因3’-UTR中特定核苷酸序列結(jié)合,進(jìn)而導(dǎo)致轉(zhuǎn)錄或翻譯過(guò)程抑制。經(jīng)TargetScan 8.0(https://www.targetscan.org/vert_80/)、miRDB(https://mirdb.org/)、miRTarBase 7.0(https://mirtarbase.cuhk.edu.cn/)數(shù)據(jù)庫(kù)預(yù)測(cè)miR-519d-3p調(diào)控的目的基因,發(fā)現(xiàn)HIF-1α預(yù)測(cè)分?jǐn)?shù)較高,推測(cè)HIF-1α可能是miR-519d-3p的靶基因。先前關(guān)于胰腺導(dǎo)管腺癌細(xì)胞與子宮內(nèi)膜上皮細(xì)胞的研究中也曾報(bào)道,miR-519d-3p對(duì)HIF-1α具有負(fù)調(diào)控作用[15-16]。本研究發(fā)現(xiàn),miR-519d-3p過(guò)表達(dá)組中HIF-1α蛋白表達(dá)水平較對(duì)照組顯著減少,提示miR-519d-3p對(duì)HIF-1α具有負(fù)調(diào)控作用。隨后經(jīng)熒光素酶報(bào)告基因?qū)嶒?yàn)驗(yàn)證miR-519d-3p中“CGUGAAA”序列可與HIF-1α中“GCACUUU”序列特異性結(jié)合,提示HIF-1α是miR-519d-3p的靶基因。
HIF-1α蛋白分子量約為92kDa,作為腫瘤治療中的一個(gè)明星分子靶點(diǎn),其廣泛參與細(xì)胞增殖和凋亡、腫瘤轉(zhuǎn)移、血管生成及葡萄糖代謝等過(guò)程[17]。近年來(lái),HIF-1α被報(bào)道與糖尿病及其并發(fā)癥的發(fā)生和發(fā)展密切相關(guān)。Ilegems等[18]研究揭示HIF-1α可以介導(dǎo)糖尿病小鼠模型中胰島β細(xì)胞的損傷,而其抑制劑PX-478則可改善胰島β細(xì)胞的胰島素分泌指數(shù)。Zhang等[19]發(fā)現(xiàn)DR小鼠模型中視網(wǎng)膜血管生成與HIF-1α水平的增加密切相關(guān),沉默HIF-1α可以降低血管內(nèi)皮生長(zhǎng)因子的表達(dá),并以時(shí)間依賴(lài)的方式抑制血管生成。Jiang等[20]報(bào)道HIF-1α通過(guò)血紅素氧合酶1介導(dǎo)的對(duì)線粒體動(dòng)態(tài)控制可以改善糖尿病腎病的腎小管損傷。本研究發(fā)現(xiàn),miR-519d-3p聯(lián)合HIF-1α過(guò)表達(dá)組細(xì)胞24、48、72h 吸光度值較miR-519d-3p過(guò)表達(dá)組均顯著減少,細(xì)胞凋亡率較miR-519d-3p過(guò)表達(dá)組顯著增加,細(xì)胞外液TNF-α、IL-1β、IL-6濃度較miR-519d-3p過(guò)表達(dá)組均顯著增加,新生毛細(xì)血管管腔樣結(jié)構(gòu)數(shù)量較miR-519d-3p過(guò)表達(dá)組顯著增加,與既往文獻(xiàn)[19]報(bào)道結(jié)果一致,提示HIF-1α可以逆轉(zhuǎn)miR-519d-3p的作用。由此得出,HIF-1α是miR-519d-3p發(fā)揮功能的關(guān)鍵下游分子,miR-519d-3p/HIF-1α通路在DR發(fā)生和發(fā)展中均具有重要作用。
綜上所述,高糖誘導(dǎo)HRMEC模型中miR-519d-3p表達(dá)下調(diào),而HIF-1α蛋白表達(dá)上調(diào)。HIF-1α是miR-519d-3p的靶基因。miR-519d-3p靶向HIF-1α增加細(xì)胞增殖并降低細(xì)胞凋亡和炎癥反應(yīng),從而減輕高糖誘導(dǎo)的HRMEC功能障礙并抑制血管生成。本研究尚存幾點(diǎn)不足:(1)由于本研究不涉及組織樣本,故未能檢測(cè)miR-519d-3p和HIF-1α表達(dá)水平的相關(guān)性;(2)未能從基因干擾層面觀察沉默miR-519d-3p對(duì)高糖誘導(dǎo)的HRMEC功能障礙和血管生成的影響;(3)未能使用HIF-1α抑制劑佐證miR-519d-3p/HIF-1α通路的功能。

