普魯卡因通過調控miR-138抑制OGD誘導的大鼠皮層神經元損傷*
張素冰 高輝 趙濱濱 張丹琦
(1.黑龍江中醫藥大學附屬第一醫院麻醉手術科,黑龍江 哈爾濱 150040;2.黑龍江中醫藥大學附屬第三醫院麻醉手術科,黑龍江 哈爾濱 150000)
缺血性腦卒中是常見的腦血管疾病,具有較高的致殘率和致死率[1]。腦缺血誘導大腦神經元損傷,主要表現為神經元活性降低及凋亡增加[2]。因此,抑制腦缺血引起的大腦神經元損傷可減緩及治療腦損傷。普魯卡因(Procaine,PROC)是臨床常用的局部麻醉劑,近年來研究顯示PROC可能在腫瘤[3]、心肌損傷[4-5]等疾病中發揮鎮痛外效用。同時,PROC還具有鈉通道阻滯作用,可抑制細胞膜缺血去極化,從而保護腦缺血[6],然而其具體保護機制還未知。微小RNA(miRNA)是小分子非編碼RNA,研究[7]顯示,miR-138在氧糖剝奪(Oxgen-glucose deprivation,OGD)誘導的大鼠皮層神經細胞中表達下調,上調miR-138可減輕神經細胞損傷,其表達異常可能參與缺血性腦卒中發病。鑒于此,本研究將從miR-138角度,探究普魯卡因對OGD誘導大鼠皮層神經元損傷的影響及機制。
1 材料與方法
1.1 細胞和試劑 大鼠皮層神經元細胞購自武漢普諾賽生命科技有限公司;PROC購自常州市卓燊醫藥化工材料有限公司;DMEM培養液、Annexin V-FITC/PI試劑盒、LipofectamineTM 2000試劑盒和CCK-8試劑盒購自北京索萊寶公司;乳酸脫氫酶(Lactic dehydrogenase,LDH)試劑盒購自南京建成公司;胎牛血清購自浙江天杭公司;活化的半胱天冬酶3(cleaved-caspase3)、cleaved-caspase9抗體、pro-caspase3抗體、pro-caspase 9抗體購自美國Abcam公司;PCR實驗相關試劑盒購自大連寶生物工程公司;引物序列、miR-138模擬物(mimics)及抑制劑(anti-miR-138)、模擬對照序列(miR-NC)及抑制劑陰性序列(anti-miR-NC)由上海生工生物工程公司提供。
1.2 方法
1.2.1 細胞培養、轉染與分組 用含10%胎牛血清的DMEM培養液懸浮大鼠皮層神經元細胞,置于CO2培養箱中培養。參照文獻[8]方法建立OGD模型:以無糖DMEM培養液懸浮細胞,置于5% CO2、95% N2、37 ℃條件下培養90 min;加含10%胎牛血清的DMEM培養液繼續培養12 h。將細胞以1.0×105個/孔接種至96孔板,置于CO2培養箱中培養4 h,分別用含0.00、3.50、7.00、14.00 mg/L[3]PROC的培養液培養24 h,建立OGD模型,作為OGD組、OGD+PROC-L組、OGD+PROC-M組和OGD+PROC-H組,同時設置對照(Con)組,常規培養,用于觀察PROC對OGD細胞模型的影響;將細胞以1.0×106個/孔接種至6孔板中,置于CO2培養箱中培養24 h,利用LipofectamineTM 2000試劑盒分別轉染miR-138 mimics、miR-NC、anti-miR-138、anti-miR-NC,轉染12 h,并采用qRT-PCR法檢測miR-138表達,驗證轉染效果,再建立OGD模型,其中轉染anti-miR-138、anti-miR-NC的細胞用含有14.00 mg/LPROC的培養液培養24 h,分別作為OGD+miR-138組、OGD+miR-NC組、OGD+PROC+anti-miR-138組、OGD+PROC+anti-miR-NC組,用于探究PROC對OGD細胞模型的潛在機制。
1.2.2 CCK-8法檢測神經元存活率 各組培養結束,添加10 μL/孔CCK-8試劑,繼續孵育2 h,再置于酶標儀中,設置波長450 nm,測定各孔吸光度(Absorbance,A)值,計算存活率(%)=A值實驗組/A值對照組×100%。
1.2.3 LDH漏出率檢測 收集各組處理后培養上清液,4500 r/min離心10 min,離心半徑為10 cm,取上清液,嚴格按照LDH試劑盒說明書,檢測LDH含量,計算各組LDH釋放率。
1.2.4 流式細胞術檢測細胞凋亡 收集各組處理后細胞,利用Annexin V-FITC/PI試劑盒,上流式細胞儀檢測凋亡細胞數。
1.2.5 蛋白質印跡法檢測cleaved-caspase3、cleaved-caspase9、pro-caspase3、pro-caspase 9蛋白 收集各組處理后細胞,用RIPA試劑提取總蛋白,BCA法檢測蛋白濃度,用SDS-PAGE分離總蛋白,轉至PVDF膜,用5 %脫脂牛奶封閉2 h,于4 ℃用cleaved-caspase3(1∶500)、cleaved-caspase9(1∶500)、pro-caspase3(1∶500)、pro-caspase 9(1∶500)和GAPDH(1∶1000)一抗孵育過夜,室溫用山羊抗兔二抗孵育1 h,加顯影液顯影,曝光拍照,Image軟件分析條帶灰度值,目的蛋白相對表達量以目的蛋白與內參灰度值的比值表示。
1.2.6 qRT-PCR檢測miR-138表達 收集各組處理后細胞,按照1.2.1分組處理后收集細胞,用miRNA提取試劑盒提取總RNA,逆轉錄為cDNA后,進行PCR擴增。引物序列:miR-138上游5′-GGTGTC CGTGGAGTCGGCAA-3′,下游5′-AACTTCACAA CACCAGCTTA-3′;U6上游5′-CTCGCTTCGGCA GCACA-3′,下游5′-AACGCTTCACGAATTTGCG T-3′。2-△△Ct法計算miR-138相對U6的表達量。
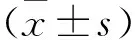
2 結果
2.1 PROC對OGD誘導大鼠皮層神經元存活率和LDH釋放的影響 OGD組存活率低于對照組(P<0.05),LDH釋放率高于對照組(P<0.05)。OGD+PROC-L組、OGD+PROC-M組和OGD+PROC-H組存活率均高于OGD組(P<0.05),LDH釋放率均低于OGD組(P<0.05)。見表1。
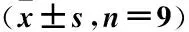
表1 PROC對OGD誘導大鼠皮層神經元存活率和LDH釋放的影響Table 1 Effects of PROC on the survival rate and LDH release of OGD-induced rat cortical neurons
2.2 PROC對OGD誘導大鼠皮層神經元凋亡的影響 OGD組凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表達均高于對照組,pro-caspase3、pro-caspase 9蛋白表達均低于對照組(P<0.05)。OGD+PROC-L組、OGD+PROC-M組和OGD+PROC-H組凋亡率、cleaved-caspase3和cleaved-caspase9蛋白表達均低于OGD組,pro-caspase3、pro-caspase 9蛋白表達均高于OGD組(P<0.05)。見圖1、表2。

圖1 PROC對OGD誘導大鼠皮層神經元凋亡的影響Figure 1 Effects of PROC on OGD-induced apoptosis of cortical neurons in rats注:A.凋亡相關蛋白表達; B.流式細胞術檢測細胞凋亡。
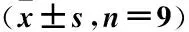
表2 PROC對OGD誘導大鼠皮層神經元凋亡的影響Table 2 Effects of PROC on OGD-induced apoptosis of cortical neurons in rats
2.3 PROC對OGD誘導大鼠皮層神經元中miR-138表達的影響 對照組、OGD組、OGD+PROC-L組、OGD+PROC-M組和OGD+PROC-H組miR-138表達量分別為(1.00±0.00)、(0.28±0.03)、(0.43±0.04)、(0.69±0.05)和(0.86±0.06)。OGD組miR-138表達低于對照組(P<0.05)。OGD+PROC-L組、OGD+PROC-M組和OGD+PROC-H組miR-138表達均高于OGD組(P<0.05)。
2.4 過表達miR-138對OGD誘導大鼠皮層神經元損傷的影響 OGD+miR-138組miR-138表達量高于OGD+miR-NC組[(2.94±0.27)vs(1.00±0.00)](P<0.05)。OGD+miR-138組存活率高于OGD+miR-NC組(P<0.05),LDH釋放率、凋亡率及cleaved-caspase3和cleaved-caspase9蛋白表達均低于OGD+miR-NC組,pro-caspase3、pro-caspase 9蛋白表達均高于OGD+miR-NC組(P<0.05)。見圖2、表3。

圖2 過表達miR-138對OGD誘導大鼠皮層神經元凋亡的影響Figure 2 Effect of overexpression of miR-138 on OGD-induced apoptosis of rat cortical neurons注:A.凋亡相關蛋白表達; B.流式細胞術檢測細胞凋亡。
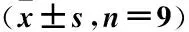
表3 過表達miR-138對OGD誘導大鼠皮層神經元損傷的影響Table 3 Effects of overexpression of miR-138 on OGD-induced rat cortical neurons damage
2.5 敲減miR-138逆轉PROC對OGD誘導大鼠皮層神經元損傷的作用 OGD+PROC+anti-miR-138組miR-138表達量低于OGD+PROC+anti-miR-NC組[(0.33±0.03)vs(1.00±0.00)](P<0.05)。OGD+PROC+anti-miR-138組存活率低于OGD+PROC+anti-miR-NC組(P<0.05),LDH釋放率、凋亡率及cleaved-caspase3和cleaved-caspase9蛋白表達均高于OGD+PROC+anti-miR-NC組,pro-caspase3、pro-caspase 9蛋白表達均低于OGD+PROC+anti-miR-NC組(P<0.05)。見圖3、表4。

圖3 敲減miR-138逆轉PROC對OGD誘導大鼠皮層神經元凋亡的作用Figure 3 Knocking down miR-138 reverses the effect of PROC on OGD-induced cortical neuron apoptosis in rats注:A.凋亡相關蛋白表達;B.細胞凋亡流式圖。
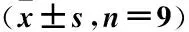
表4 敲減miR-138逆轉PROC對OGD誘導大鼠皮層神經元損傷的作用Table 4 Knocking down miR-138 reverses the effect of PROC on OGD-induced cortical neuron injury in rats
3 討論
缺血性腦卒中是常見的腦血管疾病,缺血狀態下,神經元活性降低,凋亡增加,導致神經功能受損[9-10]。OGD誘導的神經元損傷模型是常見的缺血神經損傷體外模型[11]。LDH是廣泛分布于機體組織中的胞內酶,細胞受損時被大量釋放[12-13]。本實驗顯示,大鼠皮層神經元經OGD誘導后,神經元存活率降低,凋亡率和LDH釋放量明顯增加,說明OGD模型建立成功。同時,PROC可提高OGD誘導大鼠皮層神經元存活率,降低凋亡率、LDH漏出率,說明其對OGD誘導大鼠皮層神經元損傷具有保護作用。Caspase級聯反應參與細胞凋亡,其中caspase9是該級聯反應的起始因子,其在活化后生成cleaved-caspase9,傳遞凋亡信號;caspase3是Caspase級聯反應的核心分子,其被活化后生成cleaved-caspase3,進而剪切細胞內各種底物,誘導細胞凋亡[14-15]。本研究表明,PROC可降低OGD誘導大鼠皮層神經元中cleaved-caspase3和cleaved-caspase9蛋白的表達,增加pro-caspase3、pro-caspase 9蛋白表達,這提示PROC可能通過抑制Caspase級聯反應,阻礙OGD誘導的大鼠皮層神經元凋亡。
miR-138可參與調控細胞凋亡、炎癥及免疫等多種生理病理過程,其異常表達與多種疾病的發生發展相關[16-18]。miR-138在缺血性腦卒中內表達降低,上調miR-138可減輕OGD誘導的星形膠質細胞損傷[19-20]。表明miR-138有望成為缺血性腦卒潛在標記物。本實驗顯示,miR-138在OGD誘導大鼠皮層神經元中表達下調,過表達miR-138后,OGD組細胞增殖活性增加,LDH釋放量和細胞凋亡減少,這與李敏等[7]報道結果一致,提示miR-138可保護大鼠皮層神經元免受OGD損傷。本研究還顯示,普魯卡因可促進OGD誘導大鼠皮層神經元中miR-138表達,而恢復實驗顯示,敲減miR-138可部分逆轉普魯卡因對OGD誘導神經元損傷的作用,這提示普魯卡因在OGD誘導大鼠皮層神經元損傷中的保護作用,可能通過上調miR-138實現。
4 結論
普魯卡因可抑制OGD誘導的大鼠皮層神經元損傷,其作用機制可能與上調miR-138有關,但其具體作用機制仍有待進一步探究,未來將從miR-138靶基因及下游信號通路深入分析。

