應用響應面法優化副豬嗜血桿菌凍干保護劑
蔡國華,周明光,張 迪,戴昕燕,潘建剛,徐曉娟,何啟蓋,蔡旭旺*
(1.華中農業大學 動物醫學院 農業微生物學國家重點實驗室,湖北 武漢 430070;2.武漢科前生物有限公司,湖北 武漢 430200)
副豬嗜血桿菌(Haemophilusparasuis)定植于豬上呼吸道,可導致豬的多發性漿膜炎、關節炎和腦膜炎,對養豬業造成較大的經濟損失[1-2]。近年來,伴隨著“限抗令”的實施,副豬嗜血桿菌病的防控變得更加困難。弱毒活疫苗相比于滅活疫苗,不僅成本相對較低,而且可以刺激機體產生更加全面的免疫應答,在傳染病防控方面發揮著重要作用[3]。
冷凍干燥作為一種物質保存技術,被廣泛應用于活疫苗的制備。然而,冷凍干燥過程存在諸多損傷應力,均會導致細胞活性下降甚至死亡[4],因此,往往需要添加合適的保護成分來降低細胞活性損失[5]。相比于其他細菌,副豬嗜血桿菌十分脆弱,培養時生長緩慢且在外界存活時間短暫[6],因此該菌對冷凍干燥保存條件要求非常苛刻。本研究重點對副豬嗜血桿菌候選疫苗株HS1712的凍干保護劑進行優化,提高菌株在冷凍干燥條件的存活率,進而推動弱毒疫苗商品化生產。
1 材料與方法
1.1 菌株豬嗜血桿菌分離株HS1712,血清型7型,由本實驗室分離鑒定并保存。
1.2 主要試劑及儀器胰蛋白胨大豆瓊脂培養基(Tryptic soy agar,TSA)(批號:0147211)、胰蛋白胨大豆肉湯培養基(Tryptic soy broth,TSB)(批號:0079962)購自美國BectonDickinso公司;煙酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)(批號:70080032)、海藻糖(批號:21211045,純度≥98%)購自北京蘭杰柯科技有限公司;新生牛血清(批號:20200725)購自內蒙古金源康生物工程有限公司;甘油(批號:20190815,分析純)、甘露醇(批號:20200422,分析純)購自國藥集團化學試劑有限公司;脫脂奶粉(批號:EZ6789B128)、牛血清白蛋白(Albumin bovine,BSA)(批號:EZ6789D179)購自德國BioFroxx公司;L-抗壞血酸鈉(批號:C12371584)購自上海麥克林生化科技有限公司;聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)(批號:H08X025)購自于英國Alfa Aesar公司;Christ凍干機(型號:Epsilon 2-6D LSC plus)購自德國Marin Christ公司。
1.3 試驗菌株復蘇及擴培將-20℃冷凍保藏的凍干菌種用TSA培養基(添加體積分數為5%血清和質量濃度為10 mg/L NAD)復蘇活化,置于37℃恒溫箱培養48 h。挑取單菌落接種于5 mL TSB液體培養基(添加體積分數為5%血清和質量濃度為10 mg/L NAD),37℃,180 r/min,振蕩培養7~9 h。以1∶1 000轉接比例轉接于TSB液體培養基擴大培養10~12 h。
1.4 凍干保護劑的制備本試驗所涉及保護劑均使用超純水溶解并配制不同比例,脫脂奶粉、PVP于110℃高溫下滅菌30 min;海藻糖、L-抗壞血酸鈉、甘露醇、甘油使用孔徑0.22 μm的濾膜過濾除菌。
1.5 冷凍干燥過程將TSB液體培養至對數末期的菌液進行離心,5 000×g離心10 min。使用原菌液體積1/2的磷酸鹽緩沖溶液(0.01 mol/L,pH=7.4)重懸菌體沉淀,后將菌液與凍干保護劑成品混合。充分混勻后,吸取2 mL混合液分裝于無菌的7 mL 管制玻璃瓶,置于凍干機進行凍干。凍干結束后,制品于-20℃冰箱冷凍保存。
1.6 試驗指標的測定以副豬嗜血桿菌凍干存活率作為指標來評估不同保護劑配方保護效果,其計算方法如下:
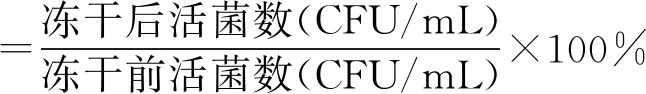
凍干前活菌計數:將菌液與凍干保護劑按照1∶1比例混合,充分渦旋后吸取0.1 mL混合液至0.9 mL TSB液體培養基(未添加NAD和新生牛血清)中進行10倍稀釋,即為10-1稀釋倍數。取100 μL 10-1稀釋液加入第2個離心管進行10倍稀釋,即為10-2稀釋倍數,依此類推,倍比稀釋至合適的稀釋倍數10-n。取100 μL 10-n稀釋液接種于TSA培養基,置于37℃恒溫培養箱,靜置培養24 h,進行計數。
凍干后活菌計數:在凍干制品中加入2 mL磷酸鹽緩沖溶液,使其恢復至凍干前體積,靜置3 min使其充分復水后進行活菌計數,計數方法參照凍干前。
1.7 配方成分組成優化以5.0%脫脂奶粉、1.5%甘油、4.0%海藻糖、2.0%甘露醇、1.0% BSA、1.0%L-抗壞血酸、0.5% PVP為基礎配方,分別對配方中的甘油、海藻糖、甘露醇、BSA、L-抗壞血酸鈉、PVP進行缺失來探究其對副豬嗜血桿菌HS1712凍干存活率的影響,由于配方中的脫脂奶粉具有填充作用,故不對此成分進行缺失(表1)。冷凍干燥具體過程按1.5方法進行,并按1.6方法測定、計算其凍干存活率。
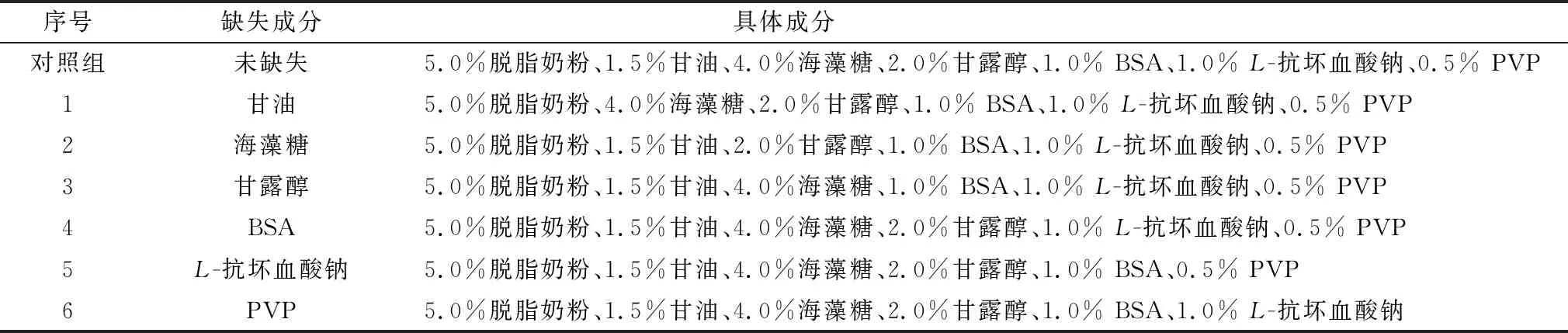
表1 單因素缺失試驗
1.8 配方成分添加比例優化
1.8.1單因素變量試驗 脫脂奶粉對凍干存活率的影響:固定甘油的添加比例為1.5%,海藻糖的添加比例為4.0%,考察不同的脫脂奶粉添加比例3.0%,5.0%,7.0%,9.0%,11.0%對副豬嗜血桿菌HS1712凍干存活率的影響。冷凍干燥過程按1.5方法進行,并按1.6方法測定、計算其凍干存活率。
甘油對凍干存活率的影響:固定脫脂奶粉的添加比例為5.0%,海藻糖的添加比例為4.0%,考察不同的甘油添加比例0.5%,1.5%,2.5%,3.5%,4.5%對副豬嗜血桿菌HS1712凍干存活率的影響。冷凍干燥過程按1.5方法進行,并按1.6方法測定、計算其凍干存活率。
海藻糖對凍干存活率的影響:固定脫脂奶粉的添加比例為5.0%,甘油的添加比例為1.5%,考察不同的海藻糖添加比例0.5%,1.0%,2.0%,3.0%,4.0%對副豬嗜血桿菌凍干存活率的影響。冷凍干燥過程按1.5方法進行,并按1.6方法測定、計算其凍干存活率。
1.8.2Box-Behnken響應面法試驗設計 基于單因素變量試驗結果,以脫脂奶粉、甘油、海藻糖為自變量,副豬嗜血桿菌凍干存活率為響應值,應用Design-Expert 11軟件設計了3因素3水平共17次的Box-Behnken響應面試驗。其中中心點設置為5組重復試驗,用以估計試驗誤差,Box-Behnken試驗設計中各因素選取水平見表2。

表2 Box-Behnken試驗中所選取因素的水平 %
2 結果
2.1 配方成分組成優化由圖1可知,配方中甘油、海藻糖的缺失顯著降低了副豬嗜血桿菌HS1712凍干存活率(P<0.05),缺失后菌株凍干存活率分別從55.14%降至37.83%,41.45%,說明甘油、海藻糖為不可缺少成分。甘露醇、BSA、L-抗壞血酸缺失后,菌株凍干存活率無顯著變化(P>0.05),從經濟角度和保護效果綜合考慮,配方中不添加這3種成分;PVP的缺失對菌株凍干存活率無顯著作用(P>0.05),但是PVP的添加可以改善凍干制品的形態,故將其作為添加成分。因此,最終配方為脫脂奶粉5.0%、甘油1.5%、海藻糖2.0%、PVP 0.5%。
2.2 配方成分添加比例優化
2.2.1單因素變量試驗 由圖2可知,副豬嗜血桿菌HS1712對不同添加比例的保護劑成分表現出明顯的劑量依賴性。脫脂奶粉、甘油、海藻糖的最佳添加比例分別為5.0%,1.5%,2.0%,凍干存活率分別為64.20%,63.79%,74.44%;從經濟成本和保護效果2個方面綜合考慮,最終確定脫脂奶粉的最佳添加比例區間為3.0%~7.0%、甘油的最佳添加比例區間為0.5%~2.5%、海藻糖的最佳添加比例區間為1.0%~3.0%。
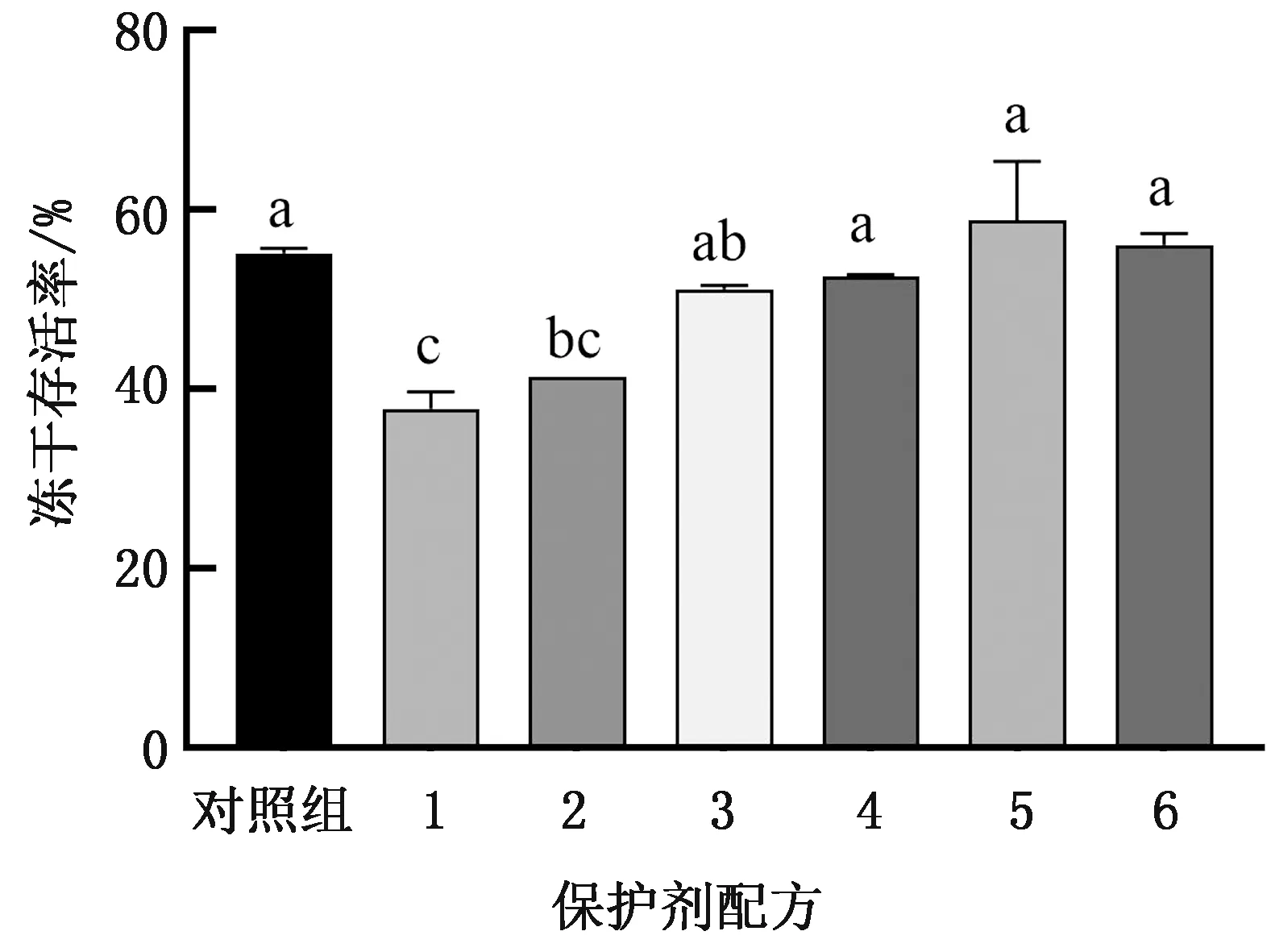
1.甘油缺失;2.海藻糖缺失;3.甘露醇缺失;4.BSA缺失;5.L-抗壞血酸鈉缺失;6.PVP缺失;同組數據含相同字母表示差異性不顯著(P>0.05),不同字母表示差異顯著(P<0.05)。下同
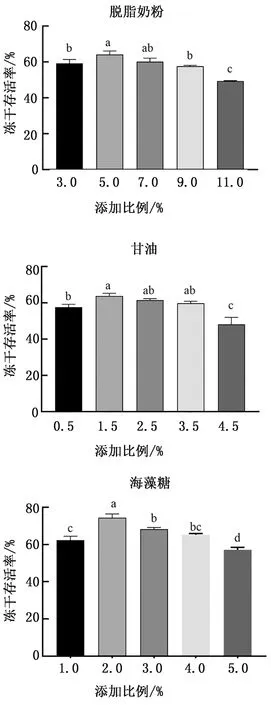
圖2 單因素變量試驗結果
2.2.2Box-Behnken響應面法試驗設計 采用Box-Behnken響應面法對副豬嗜血桿菌HS1712凍干保護劑成分的添加比例進行進一步優化。表3為響應面試驗設計及其響應值。使用Design-Expert 11軟件對表3試驗結果進行模型擬合,擬合得到的回歸方程為:Y=74.48+4.59×A+3.19×B+5.38×C-4.25×AB+2.47×AC+3.45×BC+0.60×A2-2.10×B2-7.70×C2,其中A、B、C 分別表示脫脂奶粉的添加比例、甘油的添加比例、海藻糖的添加比例,Y為副豬嗜血桿菌HS1712的凍干存活率。
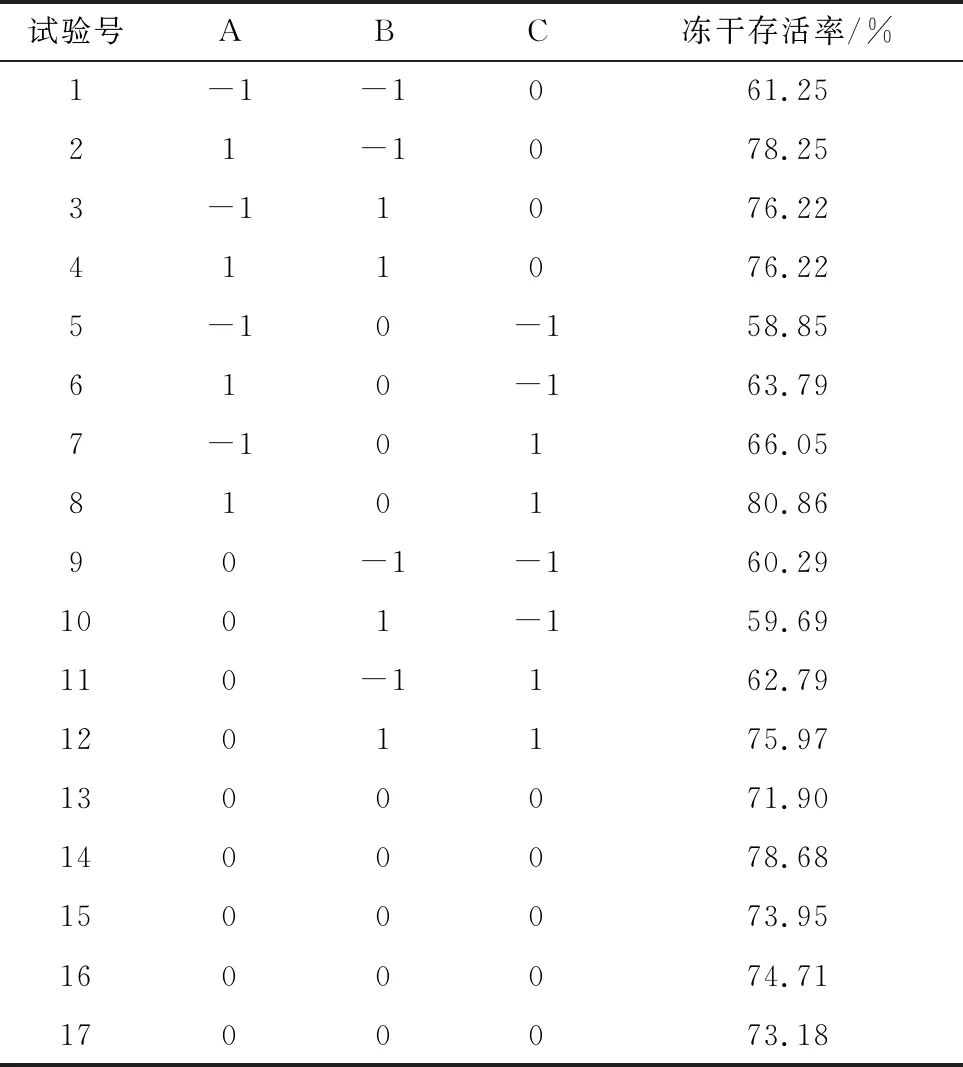
表3 Box-Behnken設計表及其響應值
通過對回歸方程進行方差分析可知(表4),該模型的P值=0.000 2<0.010 0,表明該模型呈現出極顯著水平;失擬項P值=0.865 0>0.050 0,失擬項不顯著,即試驗數據與模型擬合度較好;模型決定系數R2=0.966 7,有96.67%的試驗數據可以用該模型來解釋,即表示相關性好。模型變異系數(CV)值為3.00%,說明模型的精確度和可信度較高;信噪比(adeq precision)為12.865 3,大于下限值4.000 0,說明模型的平均預測誤差小,擬合度好。
在回歸方程中,一次項P值均小于0.010 0,表明在試驗范圍內3個因素對副豬嗜血桿菌HS1712凍干存活均有極顯著影響,交叉項中AB、BC的P值小于0.050 0,說明因素A和因素B、因素B和因素C之間的相互作用對副豬嗜血桿菌HS1712凍干存活影響顯著;二次項中C2對副豬嗜血桿菌HS1712凍干存活有極顯著影響。
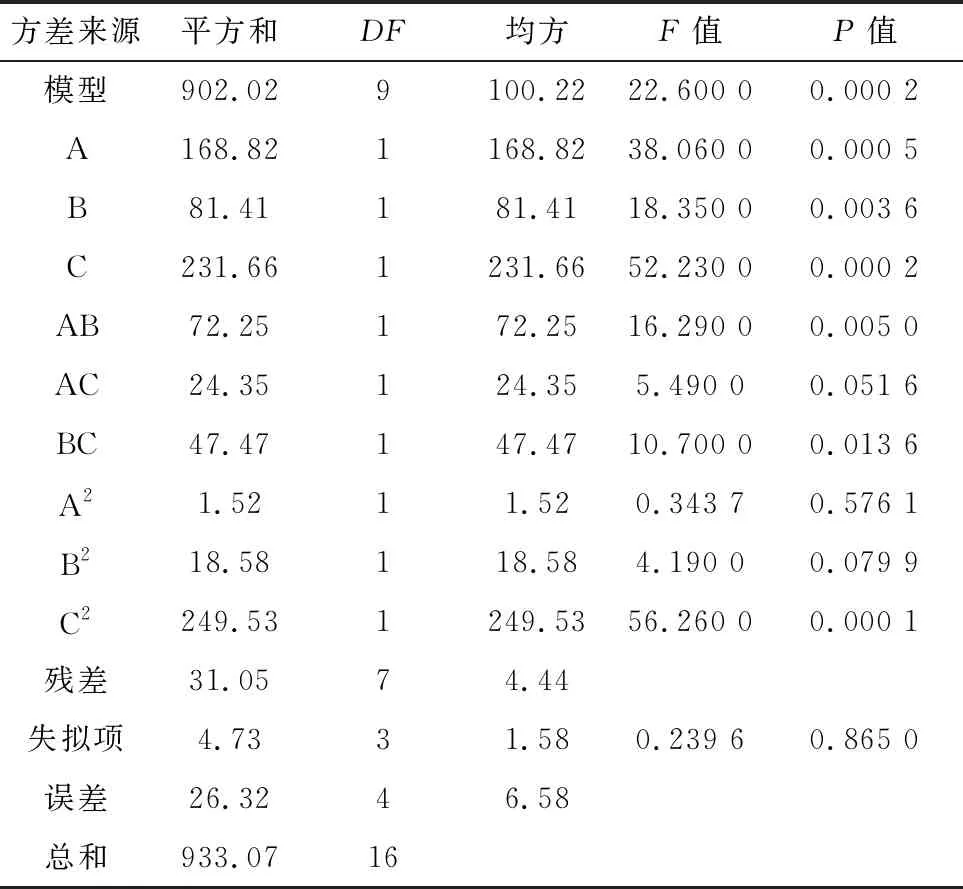
表4 Box-Behnken試驗的方差分析
應用Design Expert 11軟件繪制不同考察因素對于副豬嗜血桿菌HS1712凍干存活率影響的3D響應面圖,用來確定各因素的最佳范圍以及評價各考察因素之間的相互作用。由圖3結果顯示,各3D響應面圖峰開口均朝下,說明擬合的回歸方程有最大值,脫脂奶粉、甘油、海藻糖的最佳添加比例區間分別是6.0%~7.0%,2.0%~2.5%,2.5%~3.0%。圖3A和圖3B響應面圖坡度陡峭,且對應的等高線致密,說明脫脂奶粉與甘油、甘油與海藻糖之間交互作用對副豬嗜血桿菌HS1712凍干存活率影響顯著,與表4方差分析結果一致。
通過解析回歸方程,得出海藻糖、甘油、甘露醇的最佳添加比例分別為:脫脂奶粉6.8%、甘油2.2%、海藻糖2.7%,副豬嗜血桿菌HS1712凍干存活率預測值為80.87%。
2.2.3回歸方程的驗證 使用該配方:脫脂奶粉6.8%、甘油2.2%、海藻糖2.7%、PVP 0.5%進行凍干驗證,副豬嗜血桿菌的凍干存活率分別為80.32%,78.40%,78.89%,平均凍干存活率為79.20%,與預測值相差1.67%,無顯著性差異(P>0.05),說明該回歸模型具有一定的使用價值。
3 討論
在本研究中,基于凍干保護劑的性質組建了多種配方,通過凍干試驗發現,以脫脂奶粉、海藻糖、甘油、PVP為主要成分組成的配方能夠顯著提高副豬嗜血桿菌HS1712對凍干環境的耐受能力,這可能是由于不同保護機制成分共同協同促進的結果。脫脂奶粉作為一種傳統保護劑,其中的蛋白質成分可以在細胞表面形成一層具有黏性的膜層,防止冰晶對細胞造成損傷[7]。CHEN等[8]使用25%脫脂奶粉為基礎的配方使得雙歧桿菌在冷凍干燥后的存活率顯著提高至90.37%。海藻糖作為一種非還原性二糖,在干燥階段可通過氫鍵與脂質相互作用來維持酰基鏈之間正常的范德華力,使得細胞膜維持類似于水存在時的物理狀態[9-10]。甘油作為小分子物質,可減緩低溫以及冰晶對細胞所造成的損傷,從而降低了預凍階段對細胞所造成的損傷[11]。而聚乙烯吡咯烷酮(PVP)的添加通過強化玻璃狀基質來進一步提高蛋白質的穩定性[12]。
響應面法(response surface methodology,RSM)作為一種綜合試驗設計和數學建模的方法,多用于配方及工藝的優化[13-14]。本研究通過Box-Behnken響應面法對配方優化的過程中發現,脫脂奶粉、甘油、海藻糖的添加可顯著影響副豬嗜血桿菌HS1712在冷凍干燥后的存活率,這與楊曉菲等[15]的結果相似,其也發現海藻糖為影響副豬嗜血桿菌凍干存活的顯著成分。通過對Box-Behnken試驗結果進行回歸模型擬合,得到最佳添加比例為脫脂奶粉6.8%、甘油2.2%、海藻糖2.7%,具體配方成分及添加比例為脫脂奶粉6.8%、甘油2.2%、海藻糖2.7%、PVP 0.5%。使用優化后配方制得副豬嗜血桿菌凍干菌粉,理論凍干存活率為80.87%,試驗驗證其實際凍干存活率為79.20%,擬合模型與實際驗證無顯著差異性,證明了模型的可靠性。
另外,本研究還發現,BSA、甘露醇、L-抗壞血酸鈉的添加并不能顯著增強副豬嗜血桿菌HS1712在冷凍干燥后的存活率,其原因可能是:BSA作為大分子蛋白質類保護劑,由于其體積較大,通過空間位阻來抑制了海藻糖、甘油等小分子物質與細胞膜表面的相互作用[16-17];甘露醇作為一種結晶類物質,其在預凍階段所形成的結晶會降低配方的玻璃態黏度,從而影響配方的保護效果[18-19]。L-抗壞血酸鈉作為一種抗氧化劑,其作用可能重點體現在制品儲存階段,通過消耗凍干制品內部的氧或抑制氧化活性物的產生增加凍干制品的儲存穩定性,而對冷凍干燥過程影響較小[20]。

