不同尿碘水平的初診2型糖尿病患者血清代謝組分及腸道菌群生態的差異分析
顧俊菲,張斌華,陶少平
(皖南醫學院第二附屬醫院內分泌科,安徽 蕪湖 241000)
人體是由自身細胞及共生的大量微生物細胞共同組成的復雜生命體。人體腸道微生物數量龐大、種類繁多,被稱為“第二基因組”。在人體微生物組學中,96%~99%的微生物聚集在胃腸道,腸道共生微生物數量高達1014個[1]。近年研究[2]表明,腸道菌群對內分泌系統起著重要的調控功能。而人體內碘水平主要受到飲食中碘攝入的影響,碘營養除通過目前已知的調節甲狀腺激素(TH)水平和氧化還原系統影響代謝外[3],腸道機制可能也參與其中,但目前關于碘營養狀況對甲狀腺以外器官和組織影響的研究較少。本研究擬通過分析碘營養不良對初診2型糖尿病(diabetes mellitus type 2,T2DM)患者胰島素抵抗和糖脂代謝的影響和可能的新的腸道機制。
1 資料與方法
1.1 一般資料
選取2019年9月至2022年2月皖南醫學院第二附屬醫院收治的149例初診T2DM患者作為研究對象。根據WHO碘營養水平標準[4]界定分3組:A組為尿碘(UIC)<100 μg/L,設為碘營養不足組(n=49);B組為100 μg/L≤UIC<300 μg/L,設為碘營養充足組(n=54);C組為UIC≥300 μg/L,設為碘營養過量組(n=46)。A組患者年齡26~73歲,UIC水平為58.3~98.7 μg/L;B組患者年齡25~86歲,UIC水平為102.20~278.60 μg/L;C組患者年齡29~82歲,UIC水平為300.2~368.1 μg/L。各組性別、年齡等一般資料比較,差異均無統計學意義(P>0.05)。見表1。納入標準:(1)所有受試者在采集研究數據時均未接受影響血糖的藥物治療。T2DM診斷根據WHO糖尿病標準診斷[5],空腹血糖≥7.0 mmol/L和/或餐后2 h血糖(2 h BG)≥11.1 mmol/L者;(2)完成饅頭餐試驗或75 g葡萄糖耐量試驗(OGTT),并采取空腹及糖負荷后120 min靜脈血,測定相對應血糖、FIns及C肽水平者。排除標準:(1)合并糖尿病急性并發癥如糖尿病酮癥酸中毒、高血糖高滲狀態,其他特殊類型糖尿病,惡性腫瘤者;(2)合并甲狀腺功能亢進或功能減退的患者;(3)近兩周服用過含碘藥物如胺碘酮,或應用含碘造影劑,或食用過高碘食品等。本研究獲得皖南醫學院第二附屬醫院臨床研究倫理委員會同意,所有患者均簽署知情同意書。
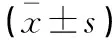
表1 各組患者一般資料及代謝情況比較
1.2 檢測指標
1.2.1 體格檢查及實驗室指標檢測 (1)記錄所有受試者性別、年齡,測量患者身高、體重及血壓,計算體質量指數(BMI)。(2)入院次日抽取患者空腹靜脈血用于HbA1c、TC、TG、空腹血糖(FBG)和FIns等檢測。所有受試者在抽取空腹血后,行75 g OGTT或饅頭餐試驗,分別檢測糖負荷后120 min血糖、血清C肽和FIns水平。血清FIns、C肽水平檢測采用化學發光法;HbA1c測定采用高效液相色譜法;采用日立7600A-020全自動生化分析儀檢測血糖、TC、TG等指標。觀察指標計算公式,BMI=體質量(kg)/身高2(m2);HOMA-IR=[FPG(mmol/L)×Flns(mIU/L)]/22.5。HOMA-β=20×Flns(mmol/L)/(FPG(mmol/L)-3.5)。
1.2.2 尿碘水平測定 尿標本收集:患者檢查前1周內正常作息及飲水,兩周內不服用含碘藥物及高碘食品如海帶等,取患者清晨空腹的中段尿15 mL,囑其將尿樣于4 ℃保存。采用分光光度法行尿碘測定。
1.2.3 腸道菌群特征檢測 (1)糞便標本收集:將收集的糞便樣品液氮冷凍后保存在-80 ℃下。(2)從各組患者糞便標本中各抽取20例患者使用16S rRNA基因測序對菌群組成和豐度進行檢測。同時對這些樣本使用氣相色譜-質譜法對腸道來源糞便中7種主要腸道菌群代謝物SCFA(乙酸、丙酸、丁酸、戊酸、己酸、異丁酸、異戊酸)進行檢測[6]。
1.3 統計學分析
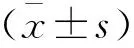
2 結果
2.1 患者一般資料及其代謝情況比較
A、C兩組患者BMI高于B組(P<0.05),但A、C兩組比較,差異無統計學意義(P>0.05);各組UIC水平比較:A組
2.2 各組患者胰島功能比較
A、C兩組患者空腹C肽、空腹FIns水平及HOMA-IR指數均高于B組患者,HOMA-β指數均低于B組患者(P<0.05),但上述各指標A、C兩組比較,差異均無統計學意義(P>0.05)。見表2。
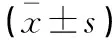
表2 各組患者胰島功能情況比較
2.3 患者腸道菌群組成
在門分類水平上,各組的腸道菌群主要都是由Actinobacteria,Bacteroidetes,Firmicutes和Proteobacteria組成。在屬分類水平上,與B組相比,A、C組產生SCFA的細菌的豐度顯著降低,例如Pediococcus,Megasphaera和Enhydrobacter。見圖1。

2.4 患者腸道SCFA組成和臨床指標相關性
乙酸、丙酸和丁酸占所有7個SCFA的70%以上。A組中丙酸、丁酸和戊酸的含量較B組均有降低,且丁酸的降低最為明顯(P<0.05);C組中丙酸和丁酸含量與B組相比降低,其中丁酸鹽的降低最為明顯(P<0.05)。A組中丁酸濃度與UIC正相關,與HbA1c、FPG、HOMA-IR負相關(P<0.05)。C組中丁酸濃度與UIC負相關,與HbA1c、FPG、HOMA-IR正相關(P<0.05)。見圖2。
3 討論
碘不僅在甲狀腺組織具有重要作用,而且在糖脂代謝方面也發揮重要作用。已有體內實驗[7-9]表明,長期碘攝入過量可使小鼠血脂水平升高,且與高脂血癥存在量效關系。大規模流調分析[10]也認為高水平碘含量與血脂異常之間存在流行病學上的聯系。國內一項納入51 795名受試者的研究[11]證明,UIC≥300 μg/L與高甘油三酯血癥、高膽固醇血癥和高水平低密度脂蛋白膽固醇的發生呈現相關性。該研究發現,UIC在300~799 μg/L時UIC濃度與代謝綜合征和糖耐量受損的發生呈現相關性。在500~799 μg/L時UIC濃度與糖尿病前期的發生呈現相關性。在補充碘后,中度或重度碘缺乏的女性血脂異常的程度有所改善[12]。因此,碘攝入不足或過量都可能給糖脂代謝帶來不良影響。
腸道菌群不僅通過自身參與機體穩態和多種疾病調控,還通過產生多種代謝物如SCFA等對機體功能產生影響。因此包括碘攝入在內的飲食習慣是腸道菌群及其代謝物構成最重要的影響因素。現有研究多局限于碘營養通過影響甲狀腺激素及抗氧化酶水平參與影響機體糖脂代謝[13-15],但可能的腸道因素及具體機制尚未闡明。
SCFA是腸道菌群通過對膳食纖維進行發酵而產生,主要包括乙酸、丙酸、丁酸等[16],表明長期碘營養狀況的不同可對腸道菌群產生直接影響。本研究中,碘攝入充足患者較之其余兩組患者腸道菌群的比例及代謝物SCFA也發生改變,主要表現為存在較高豐度的產丁酸菌和代謝物丁酸。分析其原因可能是丁酸通過激活腸道上皮G蛋白偶聯的細胞表面受體影響腸道和宿主的代謝,予以代謝綜合征患者行腸道產丁酸菌或丁酸移植后,患者胰島素敏感性增加[17]。在肥胖小鼠中,口服丁酸鈉通過增加能量消耗和脂肪氧化導致體重減輕。高脂肪飲食的小鼠口服丁酸鹽可以減輕體重,改善胰島素敏感性[18]。多項體內研究[19-20]表明,用短鏈脂肪酸治療可以減少或逆轉體重和肥胖的增加。
綜上,初診T2DM患者碘營養狀態與患者糖脂代謝及胰島素抵抗密切相關。碘營養不良參與了初診T2DM患者糖脂代謝異常與IR的發生,腸道產丁酸菌豐度和代謝物丁酸水平的降低與代謝水平具有一定程度的相關性,具體機制有待通過動物模型進一步深入研究。通過監測UIC水平并及時調整患者碘營養攝入對于T2DM患者的糖脂代謝可能具有一定的意義。

