微小RNA-29b-3p通過靶向糖原合酶激酶3β抑制骨髓間充質(zhì)干細胞成骨分化實驗研究
陳洪濤,何 云,劉 旭,伊力亞爾·阿不都斯木,阿布都薩拉木·阿布都克力木,伊力哈木·托合提,王海龍
(1.新疆醫(yī)科大學(xué)第六附屬醫(yī)院運動損傷科,新疆 烏魯木齊 830010;2.新疆醫(yī)科大學(xué)第七附屬醫(yī)院骨科,新疆 烏魯木齊 830054)
骨關(guān)節(jié)炎(Osteoarthritis,OA)是常見的一種多因素肌肉骨骼疾病,不可逆地影響關(guān)節(jié)組織[1-2]。OA的特征是關(guān)節(jié)軟骨損傷和喪失,以及軟骨下骨的結(jié)構(gòu)異常和低度慢性關(guān)節(jié)炎癥[3]。OA引起的疼痛和殘疾使人虛弱,并導(dǎo)致相當大的社會經(jīng)濟負擔(dān),然而沒有藥物可以防止疾病的發(fā)生或發(fā)展[4]。目前,OA的治療只能緩解癥狀。在病理過程的早期使用治療策略可以減少或阻止疾病的結(jié)構(gòu)性進展,進而改善病理癥狀[5]。隨著分子生物學(xué)技術(shù)的發(fā)展,對OA的分子機制有了一定了解。Yu等[6]報道了與OA疼痛相關(guān)的通路,包括神經(jīng)生長因子/原肌球蛋白受體激酶A、降鈣素基因相關(guān)肽、趨化因子受體2和腫瘤壞死因子α、白細胞介素-1β、NOD樣受體家族、含pyrin結(jié)構(gòu)域的蛋白3炎癥體以及Wnt/β-catenin信號通路。其中,越來越多的證據(jù)表明Wnt信號在OA發(fā)病機制中具有重要作用,被認為是OA治療的潛在靶點[7]。作為Wnt信號通路中的關(guān)鍵一員,激活糖原合酶激酶3β(Glycogen synthase kinase 3β,GSK3β)信號通路可促進高糖誘導(dǎo)的前成骨細胞活力和分化[8]。Guidotti等[9]證實抑制GSK3β通過對關(guān)節(jié)軟骨細胞外基質(zhì)的協(xié)同作用顯著增強了線粒體氧化應(yīng)激和損傷,因此它的活性代表了一種保持關(guān)節(jié)軟骨穩(wěn)態(tài)的工具。細胞外基質(zhì)(Extracellular matrix,ECM)黏彈性已被證明影響許多其他過程,包括細胞擴散[10]、間充質(zhì)干細胞分化[11]和細胞遷移[12]。鑒于骨髓間充質(zhì)干細胞(Bone marrow mesenchymal stem cells,BMSCs)可以提供更大的再生潛力,已經(jīng)成為緩解OA的焦點。由于具有容易獲得和來源廣泛的優(yōu)點、顯著的增殖能力和多向分化潛能以及調(diào)節(jié)炎癥的能力,BMSCs被認為是用于治療OA的重要細胞[13]。另一方面,微小核糖核酸(microRNA,miRNA,miR)可用于OA的診斷和治療,并且miRNA與其靶標之間的相互作用涉及OA中基因表達和穩(wěn)態(tài)通路的調(diào)節(jié)[14]。此外,miRNA可以激活或抑制Wnt通路的成分,從而作用于OA的不同靶點[15]。研究[16]表明,miR-29家族的表達參與OA進展,卷曲蛋白受體3(FZD3)、FZD5、蓬亂蛋白Dsh同源物3(DVL3)、Wnt信號通路FRAT調(diào)節(jié)因子2(FRAT2)和酪蛋白激酶2α2(CK2A2)被證實是miR-29家族的直接靶點,靶向它們可以調(diào)節(jié)Wnt信號。本研究擬在不同嚴重程度OA患者中比較miR-29b-3p的表達趨勢,并進一步在BMSCs中探討miR-29b-3p通過GSK3β參與OA發(fā)病的可能,以期為闡釋OA疾病機制提供新思路。
1 對象與方法
1.1 研究對象 選擇2020年6月至2020年12月在新疆醫(yī)科大學(xué)第六附屬醫(yī)院確診為OA的患者36例為研究對象,其中男性18例,女性18例;平均年齡(33.2±8.7)歲。根據(jù)2018版最新OA診療指南分為輕度OA組、中度OA組和重度OA組,每組12例,男女各半。病例納入標準:符合OA診斷標準;年齡30~50歲。排除標準:患有已知導(dǎo)致骨或鈣代謝異常疾病,如糖尿病、甲狀腺或甲狀旁腺功能改變、骨軟化癥、類風(fēng)濕性關(guān)節(jié)炎、骨質(zhì)疏松等;患有腦血管疾病或腫瘤;在過去6個月內(nèi)服用影響骨代謝藥物,如雌激素、類固醇激素、降鈣素等;有精神疾病病史。另選擇同期關(guān)節(jié)鏡膝關(guān)節(jié)交叉韌帶重建患者12例為對照組,男性6例,女性6例;平均年齡(30.8±7.2)歲。兩組患者一般資料比較差異無統(tǒng)計學(xué)意義(均P>0.05)。本研究經(jīng)新疆醫(yī)科大學(xué)第六附屬醫(yī)院倫理委員會通過,所有研究對象均閱讀并簽署知情同意書。
1.2 BMSCs收集 在交叉韌帶重建術(shù)中,分別在股骨和脛骨鉆骨性隧道時沖洗收集骨髓,并提取切除的髕骨下脂肪墊中的BMSCs,不會對患者造成額外傷害。通過密度梯度離心和免疫磁珠法分離和純化患者BMSCs,使用流式細胞術(shù)鑒定其純度。
1.3 miRNA靶基因篩選與驗證 使用Star Base v2.0和Targetscan在線工具來篩選miR-29b-3p在Wnt/β-catenin信號通路中的下游靶基因。預(yù)測miR-29b-3p和GSK3β的靶向結(jié)合位點。擴增GSK3β-3’UTR的野生型和突變型序列,并插入其熒光素酶基因啟動子的下游,分別命名為GSK3β-wt或GSK3β-mut。將人胚腎細胞293T細胞鋪于24孔板中,培養(yǎng)過夜,然后用熒光素酶報告基因載體(包含GSK3β-wt或GSK3β-mut)和miR-29b-3p模擬物/抑制劑(miR-29b-3p mimics/miR-29b-3p inhibitors)轉(zhuǎn)染細胞。共轉(zhuǎn)染48 h后,使用雙重?zé)晒馑孛笀蟾婊驕y定系統(tǒng)(Lot No.041219190415,上海碧云天生物技術(shù)有限公司)進行熒光素酶活性檢測。
1.4 BMSCs分離培養(yǎng)及轉(zhuǎn)染 將OA患者的BMSCs重懸于含有10%胎牛血清(FBS)、100 U/ml青霉素和100 mg/L鏈霉素的DMEM培養(yǎng)基中,置于37 ℃、5% CO2孵育箱中培養(yǎng)。取對數(shù)生長期的BMSCs,24孔板鋪板,每孔5×104個,每孔加0.5 ml培養(yǎng)基。使用Lipofectamine RNAi MAX(Lot No.0000000806,jetPRIME)轉(zhuǎn)染miR-29b-3p mimics/miR-29b-3p inhibitors和陰性對照(NC mimics/NC inhibitors),以及pcDNA3.1-GSK3β和空質(zhì)粒對照(pcDNA3.1-NC)。
1.5 成骨誘導(dǎo) 當24孔板中BMSCs匯合度達到70%左右時,將培養(yǎng)液更換為含10% FBS、10-8mol/L地塞米松、50 μg/ml抗壞血酸及10 mmol/L β-甘油磷酸鈉的成骨誘導(dǎo)液,每3 d更換1次誘導(dǎo)液。
1.6 堿性磷酸酶(ALP) 和茜素紅S(ARS)染色 分別在BMSCs成骨誘導(dǎo)0、14、21 d后,用4%多聚甲醛室溫固定30 min,PBS清洗后加入ALP或ARS染色液孵育。室溫靜置孵育30 min后,棄染色液,去離子水洗滌3次,留少量的液體,并置于倒置光學(xué)顯微鏡下進行觀察及拍照。使用ALP活性試劑盒(Lot No.202203,上海碧云天生物技術(shù)有限公司),根據(jù)說明書測定ALP活性。
1.7 實時定量PCR(qRT-PCR)檢測基因表達量 使用RNA提取試劑盒(Lot No.21298205,廣州碩譜生物科技有限公司)常規(guī)提取BMSCs總RNA,并用紫外分光光度計檢測總RNA的OD值。取1 μg總RNA反轉(zhuǎn)錄為cDNA并于-20 ℃保存。在Gene Bank上選取mRNA序列,用Premier 5.0設(shè)計引物序列,由大連寶生物工程有限公司合成,見表1。按照說明書,使用Real Time PCR Easy-SYBR Green l(Lot No.P221201,成都福際生物技術(shù)有限公司)在ABI 7500實時熒光定量系統(tǒng)上擴增PCR產(chǎn)物,用于確定miR-29b-3p和GSK3β基因表達的水平。使用U6或GAPDH作為內(nèi)源性對照,通過2-ΔΔCt方法計算檢測到的miRNA和mRNA的相對表達量。所檢測基因包括miR-29b-3p、GSK3β、ALP、Runx家族轉(zhuǎn)錄因子2(Runx2)、膠原蛋白1(Col-1)和骨鈣素(OCN)。

表1 基因引物序列
1.8 蛋白免疫印跡(Western blot) 使用RIPA裂解緩沖液裂解細胞后收集細胞總蛋白,測定蛋白濃度。兔多克隆抗體ALP(Lot No.3560219105)、Runx2(Lot No.0073760221)、GSK3β(Lot No.3560459025)、Col-1(Lot No.5500010219)、OCN(LOT No.0073140106)以及小鼠單克隆GAPDH抗體(Lot No.3560325317)購自武漢愛博泰克生物科技有限公司。將蛋白質(zhì)(30 μg)在10%聚丙烯酰胺凝膠上分離,然后轉(zhuǎn)移到PVDF膜上。將膜用含0.05% Tween-20的5%脫脂牛奶室溫封閉1 h,然后與一抗在4 ℃下孵育過夜(稀釋度為1∶1000)。隨后,將膜與辣根過氧化物酶偶聯(lián)的二抗孵育1 h(稀釋度為1∶5000)。使用ECL試劑盒通過化學(xué)發(fā)光法觀察抗體的結(jié)合。用Image-Pro Plus 6.0軟件分析蛋白相對表達量。
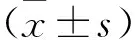
2 結(jié) 果
2.1 不同嚴重程度OA患者miR-29b-3p表達比較 見圖1。流式細胞術(shù)鑒定分離的BMSCs純度大于95%。qRT-PCR檢測結(jié)果顯示,與對照組比較,不同嚴重程度OA患者中miR-29b-3p表達量顯著上調(diào)(均P<0.01)。隨著嚴重程度的增加,miR-29b-3p表達量呈上升趨勢,且中度和重度OA患者miR-29b-3p表達量顯著高于輕度OA患者(均P<0.01)。

注:與對照組比較,*P<0.01;與輕度OA組比較,#P<0.01
2.2 成骨分化過程中miR-29b-3p表達情況 見圖2、3。在BMSCs成骨誘導(dǎo)后0、14、21 d,通過ARS染色確定成骨誘導(dǎo)細胞中的鈣濃度,結(jié)果表明與0 d比較,成骨誘導(dǎo)后鈣濃度逐漸升高。ALP染色活性檢測結(jié)果顯示,與0 d比較,ALP活性在14、21 d顯著增加(均P<0.01)。在BMSCs成骨誘導(dǎo)的過程中,miR-29b-3p的表達水平以時間依賴性方式下調(diào),與0 d比較,14、21 d的miR-29b-3p表達量顯著下調(diào)(均P<0.01)。

圖2 BMSCs成骨誘導(dǎo)0、14、21 d的ARS染色結(jié)果(標尺=200 μm)

注:與0 d比較,*P<0.01
2.3 miR-29b-3p在BMSCs成骨分化中的作用 見圖4、5。轉(zhuǎn)染miR-29b-3p mimics和miR-29b-3p inhibitors可顯著促進或抑制BMSCs中miR-29b-3p的表達。Western blot分析表明,轉(zhuǎn)染miR-29b-3p mimics后BMSCs中ALP、Runx2、Col-1和OCN蛋白水平低于轉(zhuǎn)染NC mimics;轉(zhuǎn)染miR-29b-3p inhibitors后ALP、Runx2、Col-1和OCN蛋白水平則高于轉(zhuǎn)染NC inhibitors。BMSCs成骨誘導(dǎo)21 d時檢測miR-29b-3p對細胞成骨分化的影響,ALP統(tǒng)計結(jié)果顯示,與轉(zhuǎn)染NC mimics比較,轉(zhuǎn)染miR-29b-3p mimics的BMSCs中ALP活性顯著下降,而轉(zhuǎn)染miR-29b-3p inhibitors后ALP活性顯著升高;ARS染色結(jié)果顯示,miR-29b-3p mimics抑制了BMSCs成骨分化,而miR-29b-3p inhibitors促進了成骨分化。

注:與NC inhibitors比較,*P<0.01;與NC mimics比較,#P<0.01

圖5 BMSCs轉(zhuǎn)染后ARS染色結(jié)果(標尺=200 μm)
2.4 miR-29b-3p靶向GSK3β調(diào)控BMSCs成骨分化 見圖6。GSK3β-wt、GSK3β-mut與miR-29b-3p mimics或miR-29b-3p inhibitors共轉(zhuǎn)染后的雙重?zé)晒馑孛笝z測結(jié)果表明,miR-29b-3p過表達顯著降低了含有GSK3β-wt載體中的熒光素酶活性,含有GSK3β-mut阻斷了miR-29b-3p對熒光素酶活性的抑制作用。在轉(zhuǎn)染miR-29b-3p mimics表達后,GSK3β蛋白水平下降,而轉(zhuǎn)染miR-29b-3p inhibitors 后GSK3β蛋白水平升高。此外,BMSCs成骨誘導(dǎo)21 d時,GSK3β蛋白水平顯著升高。

注:A圖為Targetscan數(shù)據(jù)庫中預(yù)測的miR-29b-3p與GSK3β靶向結(jié)合位點;B圖為雙熒光素酶試驗結(jié)果,與Negative Control比較,*P<0.01;C圖為BMSCs轉(zhuǎn)染miR-29b-3p mimics和miR-29b-3p inhibitors后GSK3β蛋白電泳圖;D圖為BMSCs成骨誘導(dǎo)0、21 d的GSK3β蛋白電泳圖
2.5 過表達GSK3β對成骨分化蛋白的影響 見圖7、8。與pcDNA3.1-NC組比較,轉(zhuǎn)染pcDNA3.1-GSK3β后BMSCs中GSK3β mRNA和蛋白水平均顯著上調(diào)(均P<0.05)。miR-29b-3p mimics可顯著減少ALP、Runx2、Col-1和OCN蛋白水平,而上調(diào)GSK3β表達可增強蛋白水平。這表明miR-29b-3p mimics對ALP、Runx2、Col-1和OCN蛋白水平的抑制作用可能會通過GSK3β升高而部分逆轉(zhuǎn)。

注:與pcDNA3.1-NC比較,*P<0.01

注:*P<0.01
3 討 論
BMSCs能夠分化成多種細胞類型,包括參與軟骨組織形成的軟骨細胞[17-19]。因此,BMSCs的軟骨分化被認為在軟骨修復(fù)中起著不可或缺的作用。Runx2是轉(zhuǎn)錄因子Runx家族的成員,也是成骨細胞分化的最早指征之一。Runx2可以誘導(dǎo)OCN等關(guān)鍵成骨基因的表達[20]。Col-1是另一個關(guān)鍵的成骨分化基因,其形成的網(wǎng)狀結(jié)構(gòu)不僅是成骨細胞實現(xiàn)礦化功能的前提,也是反映骨形成能力的重要指標。本研究結(jié)果表明,抑制miR-29b-3p是促進骨分化過程的調(diào)節(jié)因子。
miR-29b-3p越來越受到重視,因為它在多種生理和病理過程中發(fā)揮新的作用,包括細胞生長和分化、衰老、轉(zhuǎn)移、免疫調(diào)節(jié)和細胞周期調(diào)節(jié)以及凋亡。OA患者軟骨組織中miR-29b-3p水平上調(diào),誘導(dǎo)軟骨細胞凋亡,促進OA的發(fā)生和發(fā)展。研究發(fā)現(xiàn)miR-29b-3p不僅在OA患者的滑液中的表達高于非OA組,在外周血單核細胞(PBMCs)中的表達同樣顯著高于健康對照組。研究證實,miR-29b-3p可以通過促進軟骨細胞的凋亡和抑制軟骨細胞的增殖來促進OA的發(fā)展。炎癥誘導(dǎo)的軟骨細胞凋亡是OA疾病進展的重要機制[21]。miR-29b-3p在OA組織和模型中上調(diào)表達,并靶向顆粒蛋白前體(PGRN)促進細胞凋亡和炎癥反應(yīng)。為了探討miR-29b-3p在OA中的功能,本研究在BMSCs中測定成骨細胞分化,并在細胞中轉(zhuǎn)染miR-29b-3p mimics和miR-29b-3p inhibitors。經(jīng)鑒定,隨著細胞成骨誘導(dǎo)時間的延長,miR-29b-3p的表達逐漸減少。過表達miR-29b-3p顯著下調(diào)成骨相關(guān)標志物的表達,從而阻止BMSCs成骨分化。
靶向預(yù)測結(jié)果顯示,miR-29b-3p與GSK3β間具有靶向調(diào)控作用,這也被雙熒光素酶報告基因結(jié)果所證實。GSK3β是Wnt/β-連環(huán)蛋白途徑中細胞分化和凋亡的重要調(diào)節(jié)因子,并作為骨細胞和破骨細胞間平衡的調(diào)節(jié)因子發(fā)揮作用。減少的GSK-3β提示高濃度β-catenin并激活Wnt/β-catenin通路,促進基質(zhì)金屬蛋白酶13(MMP-13)的表達,導(dǎo)致軟骨基質(zhì)降解,最終導(dǎo)致關(guān)節(jié)軟骨退變。軟骨中Wnt信號增加和皮質(zhì)骨厚度增加相關(guān),過度的Wnt激活可導(dǎo)致OA[22]。抑制Wnt信號減弱了體外滑膜成纖維細胞的增殖。受干擾的軟骨細胞增殖以及肥大性分化導(dǎo)致骨結(jié)構(gòu)和穩(wěn)定性的改變。內(nèi)源性GSK-3β是軟骨細胞分化所必需的。肥胖的OA患者軟骨中GSK3β失活水平較高,這種GSK3β失活可導(dǎo)致線粒體功能障礙、基質(zhì)重塑,并最終導(dǎo)致OA的發(fā)展。
本研究集中在Wnt/β-catenin信號傳導(dǎo)途徑中的關(guān)鍵基因GSK3β,以尋找針對BMSCs成骨分化的有效靶標。上述結(jié)果表明,miR-29b-3p通過抑制GSK3β的表達來促進OA的疾病進程。本研究首次報道了成骨過程中低表達miR-29b-3p通過靶向調(diào)控GSK3β促進成骨。本研究中,GSK3β過度表達對miR-29b-3p過表達對成骨抑制作用的部分逆轉(zhuǎn)足以支持我們的結(jié)論,即miR-29b-3p通過靶向GSK3β參與OA的病理機制。
綜上所述,miR-29b-3p靶向GSK3β表達抑制BMSCs成骨分化,其可能成為OA患者治療的靶標基因。

