結直腸癌患者手術前后淋巴細胞與單核細胞比值動態變化及其對預后的預測價值
胡旭昊,孟 昆,狄茂軍
(1.湖北醫藥學院,湖北 十堰 442000;2.湖北醫藥學院附屬太和醫院感染與免疫性疾病研究所,湖北 十堰 442000;3.湖北醫藥學院附屬太和醫院普外二科,湖北 十堰 442000)
目前,結直腸癌(Colorectal cancer,CRC)在消化道腫瘤中的發病率位居第一[1]。過去的幾十年里,使用的診斷技術和治療方案在提高CRC患者生存率方面已取得重大進展,但依然有望進一步提高[2-3]。生物標志物在CRC的輔助診斷、預后預測、療效和不良反應監測等方面得到了廣泛應用,其中炎癥標志物淋巴細胞與單核細胞比值(Lymphocyte-to-monocyte ratio,LMR)、中性粒細胞與淋巴細胞比值(Neutrophil-to-lymphocyte ratio,NLR)、血小板與淋巴細胞比值(Platelet-to-lymphocyte ratio,PLR)和全身免疫炎癥指數(Systemic Immune-Inflammation Index,SII)可從全血細胞計數中獲得,反映了腫瘤微環境中局部免疫反應和全身炎癥反應間復雜的相互作用,是用于CRC患者手術前后動態監測的簡便方法[4-5]。以往的研究大多局限于探討手術及化療前后單一時間炎癥標志物和CRC患者預后的關系。本研究從手術前后多個時間點縱向評價,分析LMR、NLR、PLR和SII的動態變化對5年生存率的影響。
1 資料與方法
1.1 一般資料 本研究為回顧性病例分析,選取2017年1月至2020年6月于我院行CRC根治術的患者157例,其中男性122例,女性35例;年齡39~75歲,平均(60.92±11.28)歲;體重指數(BMI)17.31~29.52 kg/m2,平均(22.53±8.82)kg/m2;結腸癌66例,直腸癌91例;TNM分期中,Ⅰ期32例,Ⅱ期45例,Ⅲ期80例;ASA分級中,1級91例,2級62例,3級4例。病例納入標準:年齡>18歲;經病理診斷為CRC,臨床分期Ⅰ-Ⅲ期;行根治性切除術治療;術前未接受任何化療或放療。排除標準:有遠處轉移或手術切緣陽性者;嚴重心、肝、腎功能不全者;合并其他原發腫瘤者;預計生存期少于6個月。本研究經醫院倫理審查委員會批準,患者在入院時均簽署書面知情同意書。
1.2 研究方法
1.2.1 資料收集:從電子病歷系統中檢索并收集患者的臨床特征信息,包括年齡、性別、腫瘤直徑、術后化療、TNM分期等。TNM分期根據第8版美國癌癥聯合委員會(AJCC)和國際癌癥控制聯盟(UICC)分期標準確定[6]。患者分別于術前常規接受血液檢測,術后血液檢測在術后1~6個月及術后12個月多個時間點進行,樣本采集條件、檢查試劑和設備均完全相同。SII定義為血小板計數×中性粒細胞計數/淋巴細胞計數。
1.2.2 術后隨訪:包括臨床隨訪、實驗室檢查和計算機斷層掃描,在術后2年內每3~6個月隨訪1次,術后2~5年每6~12個月隨訪1次,5年后每年隨訪1次。記錄從手術到最后隨訪日期、死亡或隨訪截止時間。
1.2.3 炎癥標志物臨界值確定:使用X-tile程序(http://medicine.yale.edu/lab/rimm/research/software.aspx)確定炎癥標志物的臨界值。X-tile為評估生物標志物與結果間關系的工具。通過每個可能的分界點,將樣本劃分為不同組,對臨界點的劃分進行統計評估。根據每個可能劃分的總體χ2值,通過選擇最小P值和最大χ2值計算。根據X-tile軟件測定,術前LMR、NLR、PLR和SII的臨界值分別為3.42、3.87、162.50和569.93,術后12個月LMR臨界值為4.00。
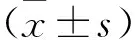
2 結 果
2.1 手術前后不同時間點炎癥標志物的變化 見表1。術后1、2、3、12個月LMR顯著高于術前(均P<0.05)。術后4~6個月NLR顯著高于術前(均P<0.05)。術后3~5個月PLR顯著高于術前(均P<0.05)。術后2~6個月SII顯著高于術前(均P<0.05)。
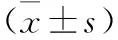
表1 手術前后不同時間點炎癥標志物的變化
2.2 CRC患者術后生存率影響因素Cox回歸分析 見表2。所有患者中位隨訪時間60.6個月,生存率為67.5%。Cox回歸分析結果顯示,術前LMR、年齡≥60歲、BMI≥25 kg/m2、腫瘤直徑≥50 mm、輔助化療、TNM Ⅱ-Ⅲ期是CRC患者術后生存率的獨立影響因素(均P<0.05)。

表2 CRC患者術后生存率影響因素Cox回歸分析
2.3 不同時間段炎癥標志物對CRC患者術后生存率的預測價值 見表3。ROC曲線分析顯示,術后12個月LMR預測CRC患者術后生存率的AUC最高。

表3 不同時間段炎癥標志物對CRC患者術后生存率的預測價值
2.4 不同水平LMR對CRC患者術后生存率的影響 見圖1。將患者術前及術后12個月的LMR根據X-tile軟件測定的臨界值分為術前高+術后高(H-H)組、術前高+術后低(H-L)組、術前低+術后高(L-H)組和術前低+術后低(L-L)組。Kaplan-Meier曲線分析顯示,L-L組生存率為43.2%,H-H組生存率為81.6%,L-H組生存率為81.8%,H-L組患者生存率為45.8%。術后12個月LMR高的患者生存率長于LMR低的患者(P<0.001)。
2.5 術后12個月不同水平LMR患者臨床資料比較 見表4。術后12個月低LMR組患者腫瘤直徑、神經受侵率、TNM分期、輔助化療比例與高LMR組比較差異有統計學意義(均P<0.05)。

表4 術后12個月不同水平LMR患者臨床資料比較
2.6 術后12個月不同水平LMR患者復發情況比較 見表5。術后12個月低LMR組患者總復發率、腹膜轉移率和遠端轉移率顯著高于高LMR組(均P<0.05)。

表5 術后12個月不同水平LMR患者復發情況比較[例(%)]
3 討 論
炎癥是癌癥的主要特征之一,炎癥反應可以促進腫瘤的形成、增殖和轉移[7-9]。大量研究[10-11]證實,術前LMR、NLR、PLR和SII與CRC患者的生存密切相關。然而,炎癥標志物的動態變化及其對預后的影響目前少有研究。研究[12]證實,切緣狀態是CRC患者生存率的獨立預測因子,與R0切除相比,R1切除的死亡風險為2.29。因此,本研究僅選取R0切除患者進行分析。
本研究顯示,術后短期內LMR和NLR均較術前有所升高,PLR和SII則有所降低,可能是由于根治性手術消除了大部分腫瘤負擔以及化療對血液的影響等。術后12個月輔助化療結束后,NLR、PLR和SII與術前比較無統計學差異,LMR仍高于術前。以往研究[13-14]顯示,單核細胞是維持慢性炎癥過程的關鍵。因此,術后LMR持續高于術前可能反映了長期的慢性炎癥過程,這些過程不會隨著腫瘤治療的終止而輕易改變。然而,這些差異背后的機制還需進一步研究。
本研究還探討了手術前后全身炎癥反應水平變化對5年生存率的影響。由于術前LMR是多因素Cox回歸分析中影響生存率的獨立因素,并且LMR在術后12個月預測生存率的準確性最高,因此本研究使用手術前后LMR探討全身炎癥反應水平變化及其預后價值。根據X-tile軟件,術前LMR的臨界值為3.42,12個月后的臨界值為4.00。手術前后血液學參數的最佳閾值差異可能是由手術相關應激、術后并發癥和輔助化療引起的[15-16]。在腫瘤微環境中,單核細胞在腫瘤生長和進展的不同階段可能具有不同的功能,其活性與M1和M2兩種表型相關,M1表型細胞通過產生白細胞介素-1(IL-1)、IL-6、IL-12、腫瘤壞死因子(TNF)-α、活性氧(ROS)等方法增強抗腫瘤反應[17]。M2表型細胞產生IL-12、IL-23和IL-10,有助于抑制炎癥過程并削弱機體的抗腫瘤免疫反應[18]。因此,巨噬細胞為腫瘤的發展創造了良好的免疫微環境,并且起著核心作用,是抗腫瘤治療的重要藥物靶點[19-20]。本研究中,L-L組表現出與H-L組相似的低生存率,H-H組與L-H組有相似的高生存率,說明患者的生存率受術后12個月LMR水平影響較高,受術前LMR水平影響較少,但這并不意味著術前LMR不重要,術前LMR預測的生存率的準確性僅低于術后12個月LMR,而高于術后其他時間點的LMR。這些結果表明,術前LMR對CRC患者術后1年生存率具有預測價值。然而,當術后隨訪至第12個月時,應通過血常規重新檢查LMR替代術前LMR作為長期預后指標。
綜上所述,術前LMR≥3.42是CRC術后患者預后的獨立影響因素,術后12個月LMR可預測CRC患者5年生存率,且無論術前LMR水平如何,術后12個月LMR≥4.00的患者5年生存率高于低水平患者。但本研究也存在不足之處:首先,本研究是一項單中心回顧性研究,缺乏外部驗證;其次,由于并非所有患者都在術后按計劃進行血液檢查,因此具有術后12個月完整資料的患者較少。這些都可能對研究結果有一定影響,后續將針對上述問題進行完善,進一步開展研究。

