Kruppel樣因子15通過調控核苷酸結合寡聚化結構域樣受體蛋白3表達影響胰島素抵抗實驗研究
劉泮力,王尚農,段玉敏,肖英麗,朱瑾英,褚 璐,李秋云
(1.北京市第六醫院內分泌科,北京 100007;2.開灤總醫院趙各莊醫院內分泌科,河北 唐山063101;3.開灤總醫院內分泌科,河北 唐山 063000)
2型糖尿病(Type 2 diabetes mellitus,T2DM)常見于中老年人群,胰島素抵抗是T2DM發生的重要危險因素[1]。胰島素抵抗可以定義為胰島素刺激葡萄糖攝取和利用的效率下降,當胰島素抵抗個體不能分泌足夠的胰島素來調控葡萄糖濃度時就會出現T2DM[2-3]。Kruppel樣因子15(Kruppel-like factor 15,KLF15)是Kruppel樣因子轉錄因子家族的一員,在細胞分化、血管生成和干細胞命運決定及調節應激反應、心肌肥厚和纖維化中起著關鍵作用[4]。有研究發現肝臟KLF15在禁食期間快速誘導,被認為有助于調節肝臟糖異生、氨基酸分解代謝、內源性代謝和外源性代謝。也有研究[5]表明KLF15可促進昆蟲變態過程中自噬相關和糖異生相關基因的表達。而在小鼠中KLF15是一種重要的轉錄因子,參與糖代謝,尤其是糖異生的調節[6]。但KLF15與糖尿病及胰島素抵抗等相關疾病的關系鮮有研究報道。核苷酸結合寡聚化結構域樣受體蛋白3(NOD-like receptor protein 3,NLRP3)炎癥小體激活是炎癥反應的重要機制,在炎癥反應和各種疾病中發揮關鍵作用[7]。越來越多的證據[8]表明,NLRP3炎癥小體有助于糖尿病的發展,而NLRP3的炎癥失活有利于糖尿病的治療。有研究[9]發現,肝細胞KLF15可以控制炎癥反應,KLF15缺陷小鼠的腦血流量極低,血漿皮質類固醇結合能力降低,在炎癥應激期間死亡率升高。但KLF15是否可以通過調控NLRP3影響疾病的發生和發展還尚不清楚。因此,本研究重點探索KLF15是否通過影響NLRP3表達對T2DM胰島素抵抗產生影響,希望為T2DM患者胰島素抵抗的研究和治療提供參考。
1 材料與方法
1.1 實驗動物 C57BL/6小鼠(5~6周,18~20 g)60只,均來自青龍山(中國蘇州南京)動物試驗中心。
1.2 主要試劑 人肝癌細胞株HepG2購自上海酶研生物科技有限公司;鏈脲佐菌素(STZ)購自上海Sigma公司;胎牛血清(FBS)購自美國Gibco公司;Lipofectamine 2000購自賽默飛世爾科技(中國)有限公司;酶聯免疫吸附試驗(ELISA)試劑盒購自江蘇碧云天生物技術研究所;iScript 反轉錄試劑盒購自美國Bio-Rad公司;Taq Man探針購自羅氏診斷產品(上海)有限公司;RIPA裂解液(批號:P0013C)和苯甲基磺酰氟(PMSF,批號:ST507-10ml)購自上海碧云天生物技術有限公司;抗-NLRP3抗體(批號:ab4207)和抗β-肌動蛋白(β-actin)抗體(批號:A2228-100UL)購自美國Abcam公司;磷酸緩沖鹽溶液(PBS,批號:P1002)購自北京索萊寶生物科技公司;PBST(PBS-Tween-20)購自賽默飛世爾科技(中國)有限公司。
1.3 實驗方法
1.3.1 動物模型:根據高脂飲食時間分為空白組、1個月組、2個月組和4個月組,每組15只。空白組只給予等量無菌0.9%氯化鈉溶液。1個月組、2個月組和4個月組用高脂飲食喂養C57BL/6小鼠12周,然后連續7 d腹腔注射STZ 30 mg/kg。每月檢測血糖和胰島素水平,最后一次注射1周后測量小鼠的血糖水平,隨機血糖≥16.7 mmol/L且持續2周為造模成功。在麻醉下處死小鼠,并取其肝臟進行分析。
1.3.2 細胞模型:人肝癌細胞株HepG2在37 ℃、5% CO2濕化下,加入含10% FBS的RPMI 1640。HepG2細胞用10、20、40 mmol/L D-葡萄糖刺激24 h。使用Lipofectamine 2000進行轉染。轉染48 h后,用10、20、40 mmol/L D-葡萄糖刺激HepG2細胞24 h。取成功培養的40 mmol/L D-葡萄糖刺激HepG2細胞模型繼續分組實驗,過表達NLRP3(ox-NLRP3)組轉染NLRP3載體慢病毒,過表達NLRP3對照(control)組轉染NLRP3空載體慢病毒,si-NLRP3組轉染NLRP3-RNAi載體慢病毒,si-NLRP3對照組轉染NLRP3-RNAi空載體慢病毒,KLF15過表達(ox-KLF15)組過表達轉染KLF15質粒,KLF15抑制(si-KLF15)組轉染敲低KLF15質粒,KLF15過表達對照組轉染空白質粒,KLF15抑制對照(si-NC)組轉染敲低空白質粒。實驗至少重復3次。
1.3.3 細胞蛋白電泳檢測細胞內目的蛋白表達:用RIPA裂解液充分裂解細胞,提取各組細胞總蛋白,并用BCA法測定蛋白濃度。將蛋白質樣品與蛋白質上樣緩沖液混勻,100 ℃下反應 3~5 min充分變性,冷卻至室溫,取30~50 μg蛋白樣品進行十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,300 mA恒流濕轉至 PVDF膜,封閉液室溫封閉1 h,加一抗[NLRP3(1∶1000),干擾素-γ(INF-γ,1∶1000),腫瘤壞死因子-α(TNF-α,1∶1000),白細胞介素-6(IL-6,1∶1000),IL-1β(1∶1000),胰島素受體底物1(IRS1,1∶1000),葡萄糖轉運蛋白4(GLUT4,1∶1000),β-actin(1∶10000)],4 ℃孵育搖勻過夜。TBST洗膜3次,加入HRP標記的二抗(1∶5000)室溫孵育2 h。TBST 洗膜3次,用化學發光液進行顯影,凝膠成像系統采集圖像,Image J軟件分析蛋白條帶灰度值。
1.3.4 聚合酶鏈反應(PCR)檢測KLF15表達量:從血清中分離RNA,使用iScript反轉錄Supermix for RT-qPCR對RNA進行反轉錄。采用Taq Man方法(羅氏通用探針庫系統)進行定量反轉錄PCR(qRT-PCR)。KLF15使用引物0.25 μl,正向引物序列為5’-ACAGGCGAGAAGCCCTTT-3’ ,反向引物序列為5’-CATCTGAGCGGGAAAACCT-3’。以U6為內參,正向引物序列為5’-CTCGCGCAGCCTTGACA-3’,反向引物序列為5’-AACTTCGGAATTGCACTCGT-3’。反應條件:95 ℃ 5 min;92 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,擴增40個周期;4 ℃保存。使用2-ΔΔCt方法計算相對表達量。
1.3.5 Western blot檢測NLRP3相對表達量:使用RIPA裂解液和PMSF試劑從細胞樣本中提取總蛋白。基于SDS/PAGE凝膠上的分子量分離蛋白質裂解物,并轉移到PVDF膜上。在室溫下用脫脂牛奶(5%)封閉膜2 h,并在4 ℃下與抗-NLRP3抗體和抗β-actin抗體一起孵育過夜。然后去除抗體,用TBST清洗膜。將膜與二級抗體在室溫下孵育2 h。以β-actin為對照,用增強化學發光法(ECL)檢測結合抗體。
1.3.6 免疫組化染色檢測組織KLF15蛋白表達:將石蠟包埋的肝組織進行連續切片,厚度為4 μm,65 ℃烘烤60 min,切片脫水處理后通過3%雙氧水浸泡封閉處理。枸櫞酸鹽微波組織修復后,PBS清洗3次,滴加10%血清,對非特異性結合進行阻斷后孵育。滴加一抗(1∶200),過夜后PBS清洗3次,滴加生物素標記二抗,孵育10 min。孵育后,DAB顯色,蘇木精復染,脫水后干燥,樹脂封片。
1.3.7 免疫熒光染色檢測細胞增殖相關蛋白:取1.3.6實驗步驟肝組織經過烘片和脫蠟處理后,進行酒精梯度脫水,在修復液中處理后將石蠟片置于PBST(PBS-Tween-20)洗液中進行3次清洗,封閉,孵育。加FITC綠色和Cy3紅色熒光孵育,DAPI核染色,聚焦顯微鏡下觀察并拍照。相關蛋白包括NLRP3、GLUT4和IRS1。
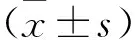
2 結 果
2.1 小鼠模型和細胞模型KLF15 mRNA表達比較 見圖1。STZ誘導小鼠后1~4個月,血清KLF15 mRNA表達水平被抑制。10、20、40 mmol/L D-葡萄糖誘導HepG2細胞24 h后,HepG2細胞內KLF15 mRNA表達水平減少(均P<0.05)。

注:與空白組比較,*P<0.05
2.2 四組小鼠血糖及胰島素水平比較 見表1。四組小鼠血糖及胰島素水平比較差異有統計學意義,且呈時間依賴性(均P<0.05)。
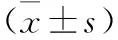
表1 四組小鼠血糖及胰島素水平比較
2.3 各組小鼠KLF15蛋白表達比較 見圖2。免疫組化染色和Western blot檢測發現,KLF15在空白組表達最高,其次為1個月組、2個月組和4個月組(均P<0.05)。

注:A圖為免疫組化染色結果(×400);B圖為蛋白電泳圖;C圖中,與空白組比較,*P<0.05
2.4 四組大鼠肝組織中NLRP3、GLUT4、IRS1蛋白表達比較 見圖3。空白組GLUT4、IRS1蛋白表達最高,1個月組、2個月組和4個月組依次降低(均P<0.05)。空白組NLRP3蛋白最低,其次為1個月組、2個月組和4個月組依次升高(均P<0.05)。

圖3 四組大鼠肝組織中NLRP3、GLUT4、IRS1蛋白表達比較(免疫熒光染色,×100)
2.5 si-NLRP3對細胞模型炎癥因子、GLUT4、IRS1表達的影響 見圖4。在細胞模型中,si-NLRP3質粒可以降低NLRP3表達量,抑制NLRP3表達可以減少INF-γ、TNF-α、IL-6和 IL-1β表達水平,同時增加IRS1、GLUT4表達量(均P<0.05)。

注:左圖為相關蛋白電泳圖;右圖中,與control比較,*P<0.05
2.6 過表達NLRP3對細胞模型炎癥因子、GLUT4、IRS1表達的影響 見圖5。NLRP3質粒可以提高NLRP3表達水平,過表達NLRP3可以促進INF-γ、TNF-α、IL-6以及IL-1β的表達,同時減少IRS1、GLUT4表達水平(均P<0.05)。

注:左圖為相關蛋白電泳圖;右圖中,與control比較,*P<0.05
2.7 調控KLF15對細胞模型NLRP3蛋白表達的影響 見圖6。上調KLF15可以抑制NLRP3 蛋白表達,抑制KLF15可以促進NLRP3 蛋白表達(均P<0.05)。

注:A圖為上調KLF15對NLRP3 蛋白表達的影響;與control比較,*P<0.05。B圖為抑制KLF15對NLRP3 蛋白表達的影響;與si-NC比較,*P<0.05
3 討 論
長期以來,胰島素抵抗一直被認為是人類和嚙齒動物衰老的特征,而衰老被認為是加速代謝綜合征發展和進程的因素之一[10]。胰島素抵抗是代謝綜合征的重要組成部分,先于糖尿病、心血管疾病和阿爾茨海默病的發展[11-12]。盡管已經證實了許多致病機制,但其病因尚未明確。研究[13]發現,胰島素抵抗可能會隨著年齡的增長而增加,這與包括激素變化、氧化應激增加和炎癥等在內的幾種與年齡有關因素的變化有關。因此,本研究通過探索能夠調控炎癥狀態的重要因子對研究胰島素抵抗的機制進行初步研究。
KLF15在調節炎癥基因表達中起著關鍵作用,有研究[14]證明肝細胞KLF15可通過編碼皮質類固醇結合球蛋白的Serpina6直接轉錄激活控制血漿皮質類固醇轉運和炎癥反應。KLF15缺陷小鼠的類固醇結合球蛋白極低,血漿皮質類固醇結合能力降低,炎癥應激期間死亡率升高[3]。另外,KLF15有助于調節肝中的糖異生,且其在肝中的表達是在禁食狀態下誘導的[15]。KLF15缺失的動物在某些氨基酸降解酶中表現出KLF15顯著減少,并且KLF15在低血糖動物基礎氨基酸分解代謝中具有重要作用[16]。本研究發現,STZ誘導小鼠后1~4個月,血清和組織中KLF15 mRNA表達水平被抑制;通過10、20、40 mmol/L D-葡萄糖誘導HepG2細胞24 h后,HepG2細胞內KLF15 mRNA表達水平減少,提示KLF15可能與胰島素抵抗形成密切相關,其水平的降低可能與高血糖有關,通過調控KLF15表達可能對胰島素抵抗的預防和治療具有重要意義。結合KLF15與炎癥間的關系,我們繼續討論KLF15是否可以通過控制炎癥表達影響胰島素抵抗。
胰島素抵抗誘導的細胞氧化應激包括DNA損傷反應、凋亡、炎癥激活等。有研究[17]發現,胰島素靶細胞可通過產生代謝產物在局部和系統上加劇細胞炎癥的產生,也有部分是通過招募和激活維持慢性炎癥狀態。而炎癥可加重脂肪細胞的炎癥和胰島素抵抗,尤其是NLRP3在肥胖誘導的炎癥、胰島素抵抗和T2DM中起著關鍵作用[18-19]。NLRP3信號通路的異常激活影響炎癥過程,包括激活、成熟和釋放INF-γ、TNF-α、IL-6和 IL-1β等促炎細胞因子[20-21]。本研究發現,NLRP3蛋白水平在空白組最低,其次為1個月組、2個月組、4個月組依次升高,提示炎癥可能在胰島素抵抗中發揮了重要作用,這與以往研究結果具有一致性。IRS1是胰島素受體的主要底物之一,研究[22]發現其對激活磷脂酰肌醇3激酶(PI3K)以響應胰島素至關重要,可導致質膜中GLUT4轉運體的增加。胰島素通過誘導GLUT4從細胞內儲存到質膜的凈再分配控制葡萄糖進入肌肉和脂肪細胞[23]。因此,IRS1、GLUT4是目前評價胰島素抵抗的重要指標,本研究細胞模型中si-NLRP3質粒可增加IRS1、GLUT4表達量,NLRP3質粒可以增加IRS1、GLUT4表達量,這與臨床實際情況相符。另外,我們還發現KLF15與NLRP3、IRS1、GLUT4存在顯著相關性,說明NLRP3、IRS1、GLUT4表達可能與KLF15變化水平有關,但KLF15是否可以通過炎癥影響胰島素抵抗仍需要我們用細胞模型進一步研究。
KLF15通過肝細胞可調節皮質類固醇結合球蛋白的生成,控制血漿類固醇皮質激素的轉運和炎癥應激的全身反應[24]。也有研究[25]發現,KLF15缺失小鼠在脂多糖(LPS)刺激后炎癥水平顯著升高。越來越多的證據證明了葡萄糖穩態、胰島素和脂質代謝在T2DM病理生理學中的核心作用[26]。而NLRP3炎癥小體在調節先天免疫系統中發揮重要作用,研究發現NLRP3炎癥小體的激活會影響糖耐量、胰島素敏感性以及與腸道微生物的相互作用。我們在細胞模型中發現,抑制NLRP3表達可以減少INF-γ、TNF-α、IL-6和 IL-1β表達水平,同時增加IRS1、GLUT4表達水平,而NLRP3過表達則出現相反的結果,這說明NLRP3除了影響炎癥反應,還可以影響IRS1、GLUT4表達。結合前一部分結果我們推測,如果控制KLF15表達,則可以通過影響NLRP3表達進而影響胰島素抵抗。因此我們進一步實驗發現KLF15可以抑制NLRP3 蛋白表達,而抑制KLF15可以促進NLRP3 蛋白表達。這些結果說明,KLF15可能通過抑制NLRP3表達減少T2DM胰島素抵抗患者的炎癥水平,保護或者抑制胰島素抵抗的進展。
綜上所述,KLF15表達與T2DM胰島素抵抗有關,KLF15低表達可能會增加胰島素抵抗。KLF15可能通過抑制NLRP3表達減少T2DM胰島素抵抗患者的炎癥水平,抑制胰島素抵抗。KLF15可能為胰島素抵抗T2DM的潛在治療和診斷靶點,為以后的相關研究提供實驗依據。

