煙酰胺腺嘌呤二核苷酸磷酸氧化酶-活性氧氧化應(yīng)激信號(hào)通路在過(guò)敏反應(yīng)中的作用及抗氧化劑干預(yù)實(shí)驗(yàn)研究
李 黎,史先鵬,周 楠,武 敏,周永春
(陜西省人民醫(yī)院藥學(xué)部,陜西 西安 710068)
過(guò)敏反應(yīng)是過(guò)敏原進(jìn)入機(jī)體后刺激機(jī)體產(chǎn)生抗體,當(dāng)過(guò)敏原再次進(jìn)入機(jī)體時(shí)與機(jī)體中的抗體結(jié)合,從而引起機(jī)體的變態(tài)反應(yīng)。肥大細(xì)胞在機(jī)體的過(guò)敏反應(yīng)、炎癥反應(yīng)、組織修復(fù)及免疫反應(yīng)等生理病理進(jìn)程中扮演著重要角色。肥大細(xì)胞表達(dá)了大量的IgE Fc段受體Ⅰ(Receptor Ⅰ for the Fcε fragment of IgE,FcεRⅠ),過(guò)敏發(fā)生時(shí)抗變應(yīng)原的特異性抗體IgE與FcεRⅠ受體交聯(lián)形成IgE/FcεRⅠ復(fù)合物,進(jìn)而引發(fā)變態(tài)反應(yīng),釋放胞漿中存在的大量顆粒,以及白介素、組胺等生物介質(zhì)[1]。研究[2-3]報(bào)道活性氧(Reactive oxygen species,ROS)在過(guò)敏反應(yīng)發(fā)生中起著舉足輕重的作用。該研究使用了鼠源肥大細(xì)胞——大鼠原代嗜堿性白血病細(xì)胞系(Rat basophil leukemia cells,RBL-2H3),利用H2O2對(duì)其刺激誘導(dǎo)產(chǎn)生過(guò)量的ROS,將誘導(dǎo)結(jié)果與生理性IgE依賴(lài)性刺激進(jìn)行了比較,結(jié)果發(fā)現(xiàn)與IgE刺激一樣,H2O2上調(diào)炎癥因子白細(xì)胞介素4(Interleukin,IL-4)、IL-6基因表達(dá)和細(xì)胞因子分泌,同時(shí)使用H2O2與IgE結(jié)合FcεRⅠ觸發(fā)肥大細(xì)胞,對(duì)IL-4表達(dá)有相加作用。此外,ROS與肥大細(xì)胞脫顆粒,釋放組胺、5-羥色胺等過(guò)敏反應(yīng)介質(zhì)亦有相關(guān)性[4-5]。
ROS主要由煙酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate hydrogen,NADPH)氧化酶(NADPH oxidases,Noxs)產(chǎn)生。Noxs作為電子供體催化NADPH產(chǎn)生O2,繼而產(chǎn)生ROS。Noxs家族有7種成員,即Nox1-5、雙氧化酶1(Dual oxidase,DUOX1)和DUOX2。Noxs蛋白本身幾乎沒(méi)有催化活性,需要與多種調(diào)節(jié)亞基結(jié)合形成穩(wěn)定的復(fù)合物才能發(fā)揮催化作用,包括p22Phox、p47Phox(異構(gòu)體Noxo1)、p67Phox(異構(gòu)體Noxa1)和p40Phox[6-7]。不同細(xì)胞中Noxs的分布及功能也是不同的。肥大細(xì)胞系RBL-2H3已被證實(shí)檢測(cè)到Noxs家族mRNA的表達(dá)[8-10],并且其可觸發(fā)肥大細(xì)胞胞漿鈣震蕩。因此,ROS在過(guò)敏反應(yīng)中的角色揭示為過(guò)敏發(fā)生及過(guò)程的本質(zhì)提供了一個(gè)嶄新的視角,針對(duì)過(guò)氧化水平的治療為抗過(guò)敏提供了新的思路。然而,Noxs不同亞型在過(guò)敏反應(yīng)中的作用仍不清楚,本研究擬進(jìn)一步探索Noxs亞型在過(guò)敏反應(yīng)中的角色,并考察抗氧化劑對(duì)過(guò)敏反應(yīng)的作用。
1 材料與方法
1.1 實(shí)驗(yàn)細(xì)胞 鼠源肥大細(xì)胞(大鼠嗜堿性細(xì)胞白血病細(xì)胞)RBL-2H3購(gòu)于武漢普諾賽生命科技有限公司。
1.2 試劑與儀器 二苯基氯化碘鹽(DPI,批號(hào):HY-100965,MCE);二氫乙錠(DHE,批號(hào):S0063,碧云天);DMEM培養(yǎng)基(批號(hào):11965-092,GIBCO 公司);噻唑藍(lán)(MTT,批號(hào):E-CK-A362,BIOFROX);Compound48/80(C48/80,批號(hào):HY-130592,MCE);脂質(zhì)過(guò)氧化物(LPO)測(cè)試試劑盒(批號(hào):A106-1,南京建成生物工程研究所);超氧化物歧化酶(SOD)測(cè)試試劑盒(批號(hào):A001-1,南京建成生物工程研究所);β氨基己糖苷酶(β-Hex)酶聯(lián)免疫吸附測(cè)定試劑盒(批號(hào):H485-1,南京建成);大鼠IL-4酶聯(lián)免疫吸附測(cè)定試劑盒(批號(hào):E-EL-R0014c,伊萊瑞特);大鼠IL-6酶聯(lián)免疫吸附測(cè)定試劑盒(批號(hào):E-EL-R0015c,伊萊瑞特);兔多抗Nox1(64 kD,批號(hào):DF8684,Affinity);兔單抗Nox2(60 kD,批號(hào):ab129068,Abcam);兔多抗Nox3(65 kD,批號(hào):A3677,Abclonal);兔多抗Nox4(67 kD,批號(hào):DF6924,Affinity);HRP標(biāo)記羊抗兔二抗(批號(hào):BA105,武漢博士德生物工程有限公司);顯影定影試劑盒(天津市漢中攝影材料廠(chǎng));電熱恒溫培養(yǎng)箱(日本ASONE);FlexStation 3多功能酶標(biāo)儀(Molecular Devices); CO2恒溫培養(yǎng)箱(SANYO);倒置顯微鏡(Nikon);流式細(xì)胞儀(Beckmancoulter)。
1.3 研究方法
1.3.1 接種:將對(duì)數(shù)生長(zhǎng)期的RBL-2H3細(xì)胞用0.25%胰蛋白酶溶液消化制成單細(xì)胞懸液,細(xì)胞計(jì)數(shù)后以一定密度接種于96孔板中(5×104/孔),細(xì)胞懸液體積為150 μl/孔。每組設(shè)4個(gè)平行孔,于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)。
1.3.2 細(xì)胞分組與處理:培養(yǎng)24 h,待細(xì)胞貼壁后,將細(xì)胞分為空白組(加入等體積新鮮培養(yǎng)基)、陽(yáng)性對(duì)照組(培養(yǎng)基中含有C48/80 100 μmol/L)和抗氧化劑組(培養(yǎng)基中含有C48/80 100 μmol/L+DPI 5 μmol/L)。吸棄各孔培養(yǎng)基,每孔依次加入藥物溶液和陽(yáng)性藥液100 μl,37 ℃培養(yǎng)30 min。
1.3.3 相關(guān)因子檢測(cè):吸取上清4 ℃下以2000 g離心10 min,用0.1% Trition X-100裂解液裂解各組細(xì)胞5 min。取裂解液4 ℃下以2000 g離心10 min。分別根據(jù)β-Hex、SOD、LPO、IL-4、IL-6酶聯(lián)免疫吸附測(cè)定試劑盒測(cè)定細(xì)胞β-Hex、SOD、LPO、IL-4、IL-6濃度。
1.3.4 細(xì)胞內(nèi)ROS水平檢測(cè):取處于對(duì)數(shù)生長(zhǎng)期、生長(zhǎng)狀態(tài)良好的RBL-2H3細(xì)胞,用1640完全培養(yǎng)基調(diào)整細(xì)胞密度到2.5×105/ml,接入6孔板,每孔2 ml細(xì)胞懸液,于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)過(guò)夜。根據(jù)不同分組和細(xì)胞處理方法分別處理細(xì)胞,于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)過(guò)夜。DPI孵育 24 h后,C48/80孵育30 min,換液,再加入C48/80孵育30 min。用不含EDTA的0.25%胰酶消化細(xì)胞,終止消化后收集細(xì)胞,以1500 r/min離心5 min,去上清,加PBS重懸。用PBS將細(xì)胞潤(rùn)洗2次,以1500 r/min離心5 min。去PBS加入稀釋好的DHE 1 ml。37 ℃培養(yǎng)箱孵育20 min,每隔3 min混勻1次。用無(wú)血清培養(yǎng)基洗滌細(xì)胞3次,500 μl PBS重懸,流式細(xì)胞儀上機(jī)檢測(cè)ROS水平。
1.3.5 Noxs蛋白表達(dá)檢測(cè):在細(xì)胞板中加入預(yù)先配制的裂解液(PMSF∶RIPA為1∶100)提取總蛋白。將定量后的樣品加入電泳槽中電泳分離,切膠、轉(zhuǎn)膜以后封閉2 h,加入一抗GAPDH(1∶1000)、 Nox1(1∶1000)、Nox2(1∶5000)、Nox3(1∶1000)、Nox4(1∶1000)。4 ℃孵育過(guò)夜,次日TBST充分洗滌PVDF膜5次,每次5 min。用TBST稀釋相應(yīng)的HRP標(biāo)記二抗(1∶10000稀釋),使PVDF膜浸泡于二抗孵育液中,室溫?fù)u床孵育2 h。TBST充分洗滌PVDF膜5次,每次5 min。將ECL試劑中增強(qiáng)液與穩(wěn)定的過(guò)氧化物酶溶液按1∶1比例混勻,滴加工作液于PVDF膜上反應(yīng)數(shù)分鐘,待熒光帶明顯后用濾紙吸去多余的底物液,覆上保鮮膜,X線(xiàn)膠片壓片后依次放入顯影液顯影和定影液中定影,沖洗膠片。晾干膠片后掃描膠片,用BandScan分析膠片灰度值。
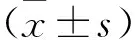
2 結(jié) 果
2.1 抗氧化劑DPI對(duì)RBL-2H3脫顆粒的影響 見(jiàn)表1。與空白組比較,陽(yáng)性對(duì)照組RBL-2H3細(xì)胞脫顆粒β-Hex及組胺釋放增加,而抗氧化劑組可顯著改善由C48/80誘導(dǎo)的脫顆粒反應(yīng),β-Hex釋放、組胺有顯著性下降(均P<0.01)。同樣的,在過(guò)敏誘導(dǎo)炎癥因子釋放過(guò)程中,DPI亦可以起到抑制作用,陽(yáng)性對(duì)照組IL-4、IL-6胞內(nèi)濃度高于空白組,抗氧化劑組細(xì)胞內(nèi)IL-4、IL-6有明顯下降(均P<0.01)。
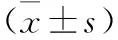
表1 抗氧化劑DPI對(duì)RBL-2H3細(xì)胞脫顆粒的影響
2.2 抗氧化劑DPI對(duì)RBL-2H3細(xì)胞胞內(nèi)過(guò)氧化水平的影響 見(jiàn)表2。與空白組比較,陽(yáng)性對(duì)照組RBL-2H3細(xì)胞胞內(nèi)氧化水平上升,SOD水平下降,LPO水平提高,并且胞內(nèi)的ROS水平大幅升高(均P<0.01)。與陽(yáng)性對(duì)照組比較,抗氧化劑組可以降低過(guò)氧化水平(均P<0.01)。
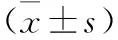
表2 抗氧化劑DPI對(duì)RBL-2H3細(xì)胞胞內(nèi)過(guò)氧化水平的影響
2.3 抗氧化劑DPI對(duì)RBL-2H3細(xì)胞胞內(nèi)Noxs蛋白表達(dá)水平的影響 見(jiàn)圖1。陽(yáng)性對(duì)照組RBL-2H3細(xì)胞胞內(nèi)的Nox1、Nox2、Nox3及Nox4蛋白可被C40/80誘導(dǎo)表達(dá)增高,水平高于空白組(均P<0.01)。抗氧化劑組RBL-2H3細(xì)胞胞內(nèi)的Nox1、Nox2、Nox3及Nox4蛋白表達(dá)可被抗氧化劑DPI抑制,表達(dá)水平低于陽(yáng)性對(duì)照組(均P<0.01)。

注:與空白組比較,*P<0.01;與陽(yáng)性對(duì)照組比較,#P<0.01
3 討 論
在臨床觀(guān)察研究中發(fā)現(xiàn)各種過(guò)敏反應(yīng)與ROS關(guān)系緊密[11-12]。與健康人群相比,在過(guò)敏性接觸性皮炎患者血液中總過(guò)氧化物濃度(TPX)明顯升高,而總抗氧化能力(TAC)明顯降低。相關(guān)分析和多元線(xiàn)性回歸分析確定了TPX和TAC可以作為評(píng)價(jià)過(guò)敏性接觸性皮炎的獨(dú)立標(biāo)志物[13]。春季角結(jié)膜炎患兒血清和眼淚中的H2O2濃度高于健康兒童,經(jīng)過(guò)環(huán)孢素A治療后的患兒血清和眼淚中的H2O2濃度與健康組比較無(wú)統(tǒng)計(jì)學(xué)差異[14]。有研究者對(duì)常年性變應(yīng)性鼻炎患者紅細(xì)胞丙二醛含量、血漿過(guò)氧化氫水平以及血漿總抗氧化狀態(tài)進(jìn)行了量化,同樣發(fā)現(xiàn)未經(jīng)治療患者的氧化應(yīng)激反應(yīng)明顯增加,而地氯雷他定治療可以使丙二醛、超氧化物歧化酶和過(guò)氧化氫酶活性正常化。在藥物過(guò)敏患者體內(nèi)的過(guò)氧化水平亦是增高的。有研究[15]臨床招募了26例磺胺類(lèi)藥物(SMX)過(guò)敏患者、19例健康對(duì)照者和6例磺胺類(lèi)藥物耐受患者參與研究,數(shù)據(jù)顯示氧化應(yīng)激在SMX過(guò)敏中起主要作用,患者體內(nèi)清除氧自由基的能力明顯降低。在臨床前研究實(shí)驗(yàn)中同樣發(fā)現(xiàn)ROS與過(guò)敏反應(yīng)相關(guān)聯(lián)[16]。因此,針對(duì)ROS與過(guò)敏反應(yīng)相關(guān)聯(lián)的研究將有一定的臨床意義。
肥大細(xì)胞作為主要的免疫細(xì)胞之一,不僅參與機(jī)體過(guò)敏、炎癥,組織損傷修復(fù)、免疫等反應(yīng),還與很多生理病理過(guò)程有關(guān)[17-18]。肥大細(xì)胞廣泛存在于人及動(dòng)物體內(nèi),胞內(nèi)含有豐富的顆粒物質(zhì),如活性胺類(lèi)物質(zhì)、β-Hex等。過(guò)敏原或補(bǔ)體途徑被激活后釋放的過(guò)敏毒素如C3a、C4a與肥大細(xì)胞表面的G蛋白偶聯(lián)受體結(jié)合,進(jìn)而激活下游信號(hào)轉(zhuǎn)導(dǎo)通路,如磷脂酶Cγ鏈(PLCγ)、磷脂酰肌醇三羥基激酶(PI3K)、磷脂酶A2(PLA2)、蛋白激酶C(PKC)等[19-20],最終使細(xì)胞內(nèi)鈣離子濃度升高,從而激活細(xì)胞使其發(fā)生脫顆粒反應(yīng),釋放出炎癥介質(zhì)引起一系列的臨床癥狀。
本研究中,我們首先體外誘導(dǎo)了肥大細(xì)胞脫顆粒模型,利用C48/80誘導(dǎo)RBL-2H3細(xì)胞釋放β-Hex、組胺及炎癥介質(zhì)IL-4、IL-6,同時(shí)檢測(cè)了胞內(nèi)的過(guò)氧化水平,發(fā)現(xiàn)RBL-2H3細(xì)胞脫顆粒過(guò)程中胞內(nèi)SOD含量呈下降趨勢(shì),而LPO及ROS濃度升高,這也驗(yàn)證了過(guò)敏反應(yīng)中氧化應(yīng)激的存在。其次,利用氧化抑制劑工具藥DPI處理脫顆粒的RBL-2H3細(xì)胞后,可以抑制胞內(nèi)ROS水平,同時(shí)升高胞內(nèi)SOD含量,降低LPO濃度,并且抑制了β-Hex、組胺、IL-4及IL-6的釋放。這意味著具有抗氧化作用的藥物在抑制過(guò)敏反應(yīng)中也取得良好的效果。有文獻(xiàn)[21]報(bào)道,黃酮類(lèi)化合物是由于其強(qiáng)大的抗氧化能力才起到抗過(guò)敏作用的。此外,有文獻(xiàn)[22]報(bào)道,姜黃素可減少I(mǎi)gE介導(dǎo)或A23187誘導(dǎo)的RBL-2H3細(xì)胞脫顆粒產(chǎn)生的ROS,從而成功降低FcεRⅠ的表達(dá)和一些促炎細(xì)胞因子的釋放,如IL-4、IL-2及IL-13。
研究證明ROS能上調(diào)CRAC通道(ORAI1)與基質(zhì)相互作用分子1(STIM1)兩種可以激活鈣池調(diào)控鈣離子通道(SOC)的必備膜蛋白。SOC通道是肥大細(xì)胞最主要的鈣離子通道,肥大細(xì)胞膜上存在大量的FcεRⅠ受體,與IgE特異性結(jié)合后能夠致敏細(xì)胞,從而引起一系列的信號(hào)轉(zhuǎn)導(dǎo),磷脂酰肌醇(PIP2)會(huì)被磷脂酶(PLC)水解成肌醇三磷酸(InsP3),而InsP3與內(nèi)質(zhì)網(wǎng)上的受體結(jié)合可誘導(dǎo)Ca2+釋放,當(dāng)鈣池內(nèi)Ca2+被耗竭到一定程度時(shí)會(huì)引起外鈣內(nèi)流,從而開(kāi)啟SOC,激活肥大細(xì)胞脫顆粒,釋放組胺、5-羥色胺等過(guò)敏反應(yīng)介質(zhì),出現(xiàn)過(guò)敏現(xiàn)象。NADPH氧化酶的許多同源物已被發(fā)現(xiàn),目前已知哺乳動(dòng)物系統(tǒng)包含7種NOX同源物,包括NOX1-5和兩種較大的雙氧化酶(DUOX1和DUOX2),它們?cè)谠S多不同的細(xì)胞類(lèi)型中廣泛表達(dá),參與調(diào)節(jié)胞內(nèi)ROS水平,以調(diào)節(jié)多種生物功能。其中,在呼吸道組織細(xì)胞中(氣道/肺泡上皮、內(nèi)皮細(xì)胞、平滑肌細(xì)胞、中性粒細(xì)胞/嗜酸性粒細(xì)胞、淋巴細(xì)胞等)報(bào)道最多的、參與ROS水平調(diào)節(jié)的NOXs為NOX1-4,但是未有文獻(xiàn)探究這些不同Noxs亞型在過(guò)敏反應(yīng)中的變化,因此本研究主要探索了不同NOX1-4在過(guò)敏反應(yīng)過(guò)程中的蛋白表達(dá)情況。研究結(jié)果表明,當(dāng)肥大細(xì)胞脫顆粒時(shí),Nox1-4的蛋白表達(dá)均呈上升趨勢(shì),抗氧化劑DPI可以抑制這一反應(yīng),證明了通過(guò)阻斷Noxs-ROS信號(hào)通路可以抑制SOC的激活,降低胞內(nèi)Ca2+釋放,從而起到抗過(guò)敏作用。
綜上所述,阻斷Noxs-ROS信號(hào)通路可以抑制過(guò)敏反應(yīng),抗氧化劑的應(yīng)用為抗過(guò)敏提供了新的治療思路。然而,本研究?jī)H在細(xì)胞學(xué)水平驗(yàn)證了Noxs-ROS信號(hào)通路在過(guò)敏中的作用,進(jìn)一步的動(dòng)物學(xué)實(shí)驗(yàn)及機(jī)制仍有待研究。

