長鏈非編碼RNA C16orf89在胃癌組織中的表達及對胃癌細胞增殖和侵襲的影響
王長亮,田文靜,黃景榮,計春燕,王 慧,趙 莉,孫 俊
(1.湖北省中西醫結合醫院消化內科,湖北 武漢 430010;2.廣州醫科大學附屬第一醫院腫瘤科,廣東 廣州 510120)
胃癌是消化系統最常見的惡性腫瘤,病死率較高[1]。胃癌發病率在全球呈現增長趨勢,同時其發病年齡逐漸年輕化[2]。盡管胃癌的診斷和治療有了較大發展,但胃癌患者的5年生存率依然較低[3]。長鏈非編碼RNA(Long non-coding RNA,lncRNA)在人體細胞中廣泛表達,通過直接或者間接與染色體、微小RNA(microRNA,miR)、蛋白結合,調控相應基因的轉錄和表達,在維持染色體穩定方面發揮重要作用[4]。相關文獻[5-6]證實,甲狀腺癌、胸腺癌、淋巴瘤以及胃癌等組織中存在lncRNA的異常表達,其通過影響各種分子信號通路轉導參與腫瘤的發生及進展。lncRNA C16orf89是一個由582個堿基組成的長鏈非編碼RNA,其在胃癌組織及細胞系中表達模式和功能尚不清楚。因此,本研究探討lncRNA C16orf89在胃癌中的表達模式,通過體外實驗分析過表達lncRNA C16orf89對胃癌細胞增殖和侵襲的作用,通過生物信息學技術進一步分析lncRNA C16orf89可能的下游機制。
1 材料與方法
1.1 實驗細胞 胃癌細胞系BGC823、AGS、NCI-N87細胞(購自美國ATCC公司)在含10%胎牛血清的RPMI-1640培養基中培養,胃癌細胞系SGC7901、HS-746T和永生化胃上皮細胞GES-1細胞(購自美國ATCC公司)在含10%胎牛血清的DMEM培養基中培養,在37 ℃、5% CO2條件下加濕培養。
1.2 主要試劑 胎牛血清(FBS)(批號:10100-147)購自美國Gibco公司;DMEM培養基和RPMI-1640培養基(批號:GT65-165、GT65-128)購自日本TOYOBO公司;lncRNA C16orf89過表達質粒pcDNA3-lncRNA C16orf89、陰性對照質粒pcDNA3-NC、miR-NC、miR-95-3p(批號:GNM25-113、GNM25-114、GNM25-115、GNM25-116)購自北京中杉金橋生物公司;噻唑藍(MTT)試劑盒、實時定量聚合酶鏈反應(qRT-PCR)試劑盒、雙熒光報告基因檢測試劑盒(批號:E6819、E1520、E1910)購自美國Promega公司;Lipofectamine 2000、雙熒光報告載體野生型pmirGLO-C16orf89-wt和突變型pmirGLO-C16orf89-mut(批號:11668019、17306001、17306002)購自美國Invitrogen公司;磷酸化磷脂酰肌醇3-激酶(p-PI3K)、磷酸化蛋白激酶B(p-AKT)、磷酸化雷帕霉素靶蛋白(p-mTOR)、細胞周期蛋白D1(CCDN1)、β-肌動蛋白(β-actin)、磷酸酯酶與張力蛋白同源物(PTEN)抗體(批號:ab278545、ab38449、ab109268、ab230947、ab8226、ab267787)購自美國Abcam公司。
1.3 研究方法
1.3.1 數據庫分析:應用基因表達譜交互分析(GEPIA)數據庫分析lncRNA C16orf89在胃癌組織及癌旁組織中的表達。應用Oncolnc數據庫在線分析胃癌患者總生存期和lncRNA C16orf89表達的相關性。通過檢索Starbase V3.0數據庫篩選可能與lncRNA C16orf89結合的miRNA。
1.3.2 質粒轉染:將生長狀態良好且處于對數生長期的AGS細胞接種于細胞板,在培養箱內常規培養,保證細胞匯合度達到90%。分別將陰性對照質粒pcDNA3-NC和lncRNA C16orf89過表達質粒pcDNA3-lncRNA C16orf89轉染至AGS細胞,根據Lipofectamine 2000試劑盒操作說明進行操作,定義為NC組和lncRNA C16orf89組。
1.3.3 實時定量聚合酶鏈反應(qRT-PCR)檢測lncRNA C16orf89及miR-95-3p表達:采用TRIzol試劑盒提取各個細胞系總RNA,反轉錄為cDNA。以U6或GAPDH作為內參照,采用qRT-PCR檢測lncRNA C16orf89及miR-95-3p表達。GAPDH正向引物序列為5’-TGCACCACCAACTGCTTAGC-3’,反向引物序列為5’-GGCATGCACTGTGGTCATGAG-3’。lncRNA C16orf89正向引物序列為5’-CCCTCCACTACCTCAAGCTG-3’, 反向引物序列為5’-TTTCCAGCAAATAGGGCAAG-3’。miR-95-3p正向引物序列為5’-ACACTCCAGCTGGGTTCAACGGGTATTTAT-3’, 反向引物序列為5’-TGGTGTCGTGGAGGAGTCG-3’。以2-ΔΔCt計算目的基因相對表達量。
1.3.4 MTT法檢測AGS細胞增殖:以每200 μl即4×103個AGS細胞接種于96孔板。在AGS細胞貼壁后1、2、3、4、5 d時,分別在每孔中加36 μl(400 mg/L)MTT試劑,在37 ℃、5% CO2條件下加濕培養160 min。應用酶標儀檢測各孔在波長490 nm處的吸光度值。
1.3.5 Transwell實驗檢測AGS細胞侵襲:培養箱內消化兩組AGS細胞,加入無血清培養基中和消化酶并調整細胞密度,以4×104個/孔接種于Transwell小室上腔。在Transwell小室下腔中加500 μl含20%胎牛血清的DMEM培養基,在37 ℃、5% CO2條件下加濕培養25 h。采用5%多聚甲醛固定,在0.2%結晶紫染液中染色。干燥處理后,在倒置顯微鏡選擇6個隨機視野計數。
1.3.6 雙熒光素酶報告基因分析lncRNA C16orf89靶基因:將雙熒光報告載體野生型pmirGLO-C16orf89-wt或突變型pmirGLO-C16orf89-mut和miR-NC或miR-95-3p共轉染AGS細胞,在37 ℃、5% CO2條件下加濕培養53 h。采用裂解液收集各組AGS細胞,通過雙熒光素酶報告基因檢測系統分析各組AGS細胞的相對熒光素酶活性,實驗重復4次。
1.3.7 Western blot檢測目的蛋白表達:采用細胞裂解液提取兩組AGS細胞總蛋白,測定蛋白濃度后采用十二烷基硫酸鈉聚丙烯酰胺凝膠電泳,電轉至硝酸纖維素膜上,通過4%牛血清白蛋白溶液封閉3 h,裁剪硝酸纖維素膜,加入一抗p-PI3K(1∶1000稀釋)、p-AKT(1∶2000稀釋)、β-actin(1∶5000稀釋)、p-mTOR(1∶2000稀釋)、PTEN(1∶3000稀釋)、CCDN1(1∶4000稀釋),低溫孵育13 h。加入二抗(1∶5000稀釋),室溫下反應3.5 h。加入化學發光液,通過凝膠成像儀拍照。
2 結 果
2.1 數據庫分析結果 GEPIA數據庫分析結果顯示,與癌旁組織相比,lncRNA C16orf89在胃癌組織中表達下調(P<0.01)。Oncolnc數據庫分析結果顯示,與lncRNA C16orf89低表達胃癌患者相比,lncRNA C16orf89高表達的胃癌患者總生存期較長(P<0.01)。
2.2 胃癌細胞系及永生化胃上皮細胞中lncRNA C16orf89表達量比較 見圖1。qRT-PCR結果顯示,永生化胃上皮細胞GES-1和胃癌細胞系SGC7901、AGS、BGC823、HS-746T、NCI-N87中lncRNA C16orf89的表達量分別為0.99±0.13、0.39±0.08、0.17±0.05、0.58±0.12、0.71±0.04、0.64±0.09,胃癌細胞系中lncRNA C16orf89表達量低于GES-1細胞,且AGS細胞中lncRNA C16orf89表達量最低(均P<0.01)。
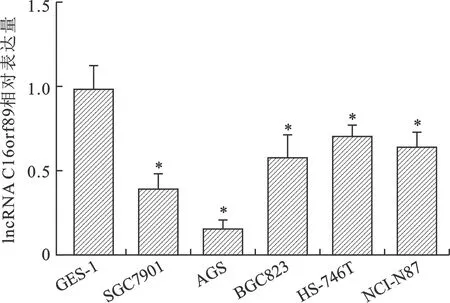
注:與GES-1細胞比較,*P<0.01
2.3 lncRNA C16orf89過表達質粒轉染效率 qRT-PCR檢測轉染效率顯示,NC組和lncRNA C16orf89組AGS細胞lncRNA C16orf89表達量分別為0.17±0.07和1.01±0.25,結果提示lncRNA C16orf89過表達質粒轉染后AGS細胞中lncRNA C16orf89表達量升高(P<0.01)。
2.4 過表達lncRNA C16orf89對AGS細胞增殖能力的影響 見圖2。MTT實驗結果顯示,與NC組比較,lncRNA C16orf89組AGS細胞從第2天起增殖能力明顯降低(均P<0.05),因此過表達lncRNA C16orf89可明顯降低AGS細胞的增殖能力。
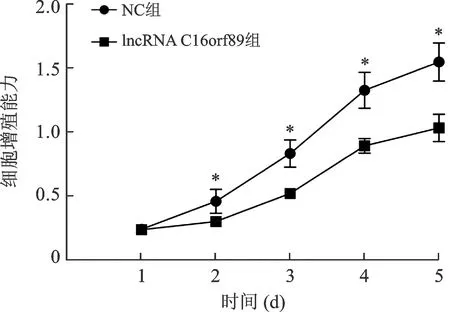
注:與NC組比較,*P<0.05
2.5 過表達lncRNA C16orf89對AGS細胞侵襲能力的影響 見圖3。Transwell侵襲實驗顯示,NC組和lncRNA C16orf89組AGS細胞侵襲數分別為(140.30±30.31)個和(49.48±19.07)個。與NC組比較,lncRNA C16orf89組AGS細胞侵襲能力明顯下降(P<0.01)。
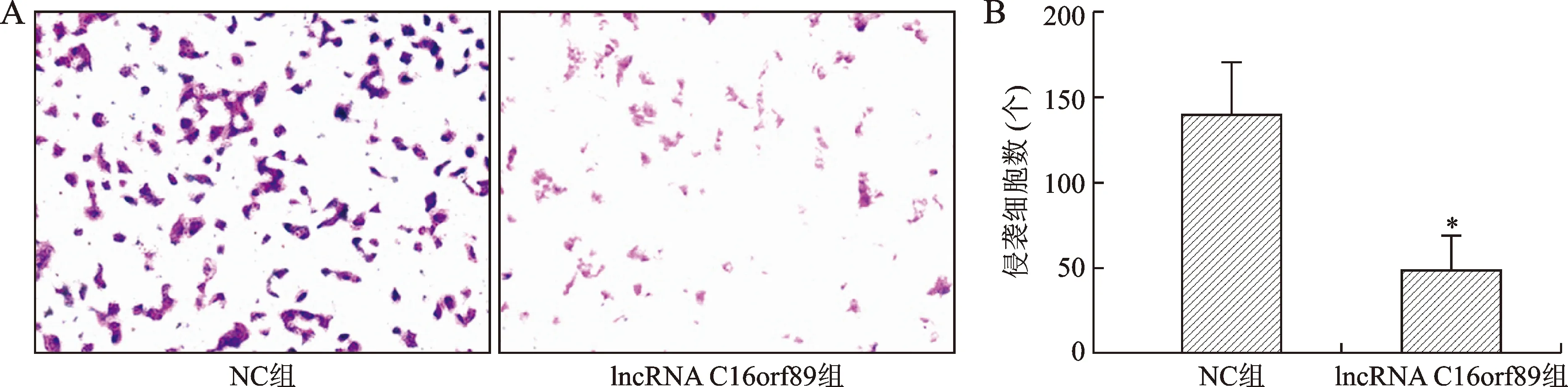
注:A圖為兩組細胞結晶紫染色結果(×100);B圖中,與NC組比較,*P<0.01
2.6 生物信息學數據庫Starbase V3.0預測結果 Starbase V3.0預測結果顯示,miR-95-3p可能是lncRNA C16orf89的潛在靶基因,野生序列為“CCGUUGAA”,突變序列為“GGCAACUU”,見圖4。
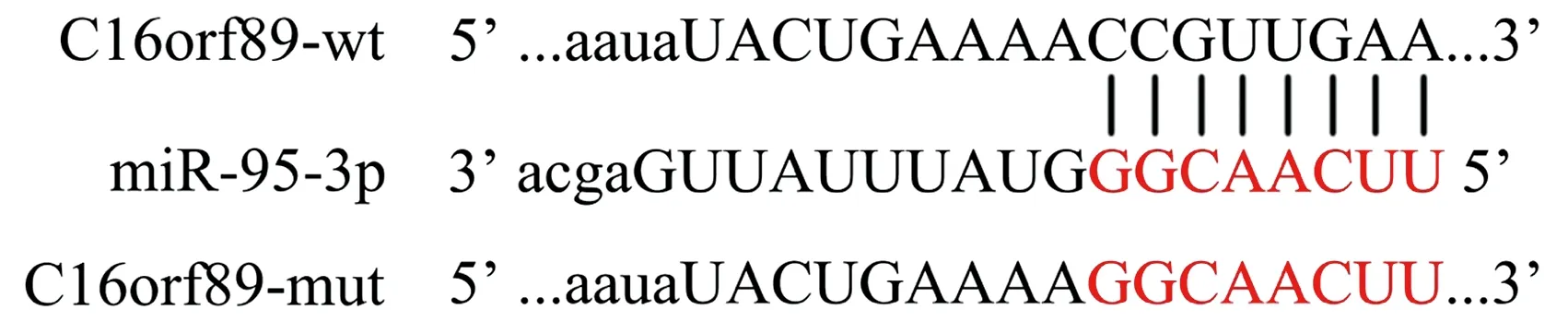
圖4 lncRNA C16orf89與miR-95-3p的結合位點
2.7 雙熒光素酶報告載體實驗結果 見圖5。在AGS細胞中,過表達miR-95-3p明顯降低野生型lncRNA C16orf89-wt載體的相對熒光素酶活性(P<0.01),對突變型lncRNA C16orf89-mut載體的相對熒光素酶活性無明顯影響(P>0.05)。
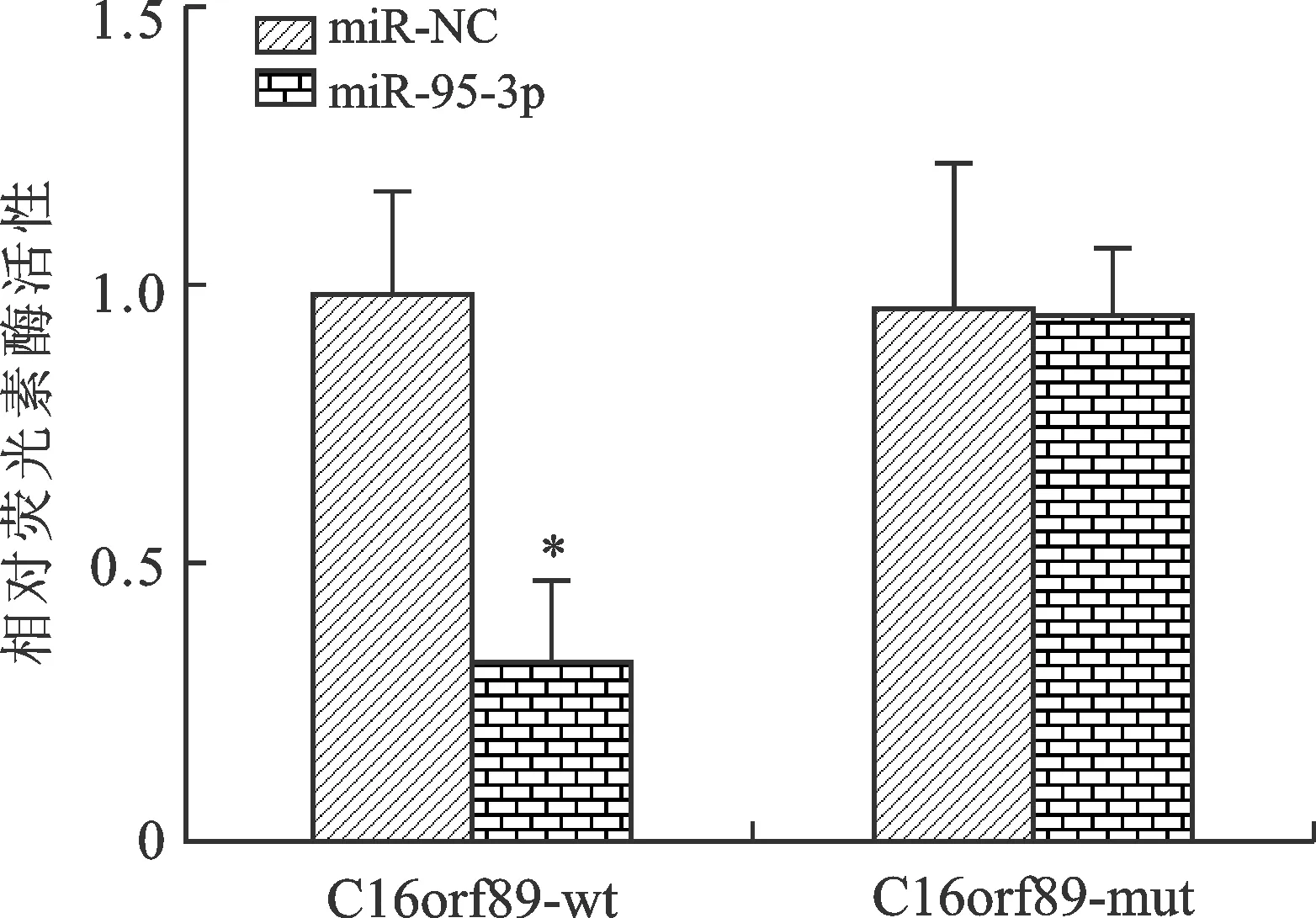
注:與miR-NC比較,*P<0.01
2.8 過表達lncRNA C16orf89對miR-95-3p的調控作用 qRT-PCR結果顯示,NC組和lncRNA C16orf89組AGS細胞miR-95-3p相對表達量分別為6.54±0.89和1.02±0.48,因此過表達lncRNA C16orf89可明顯降低AGS細胞中miR-95-3p的表達(P<0.01)。
2.9 過表達lncRNA C16orf89對PI3K/AKT信號通路蛋白表達的影響 見圖6。Western blot結果顯示,與NC組比較,lncRNA C16orf89組PI3K/AKT信號通路蛋白p-PI3K、p-AKT、p-mTOR、CCDN1表達量顯著降低,PTEN表達量顯著升高(均P<0.01)。
3 討 論
胃癌的發生和發展涉及多基因、多分子信號通路的調控,伴隨原癌基因的異常高表達和抑癌基因的異常低表達[7]。lncRNA在RNA的轉錄、加工和翻譯過程中具有重要功能,影響細胞的應激、增殖、凋亡、自噬等過程[8-9]。研究[10-12]表明,特定lncRNA表達改變與胃癌的發生、演進具有相關性,同時與胃癌的淋巴結轉移、大小、浸潤程度密切相關。文獻[13]報道,胃癌細胞系中lncRNA POT1-AS1高表達,其表達水平與胃癌患者臨床病理學特征以及較短的無病生存期和總生存期有關,lncRNA POT1-AS1通過海綿化miR-497-5p促進胃癌細胞的增殖、遷移。文獻[14]報道,lncRNA SNHG3在胃癌細胞系和組織中表達明顯增加,其表達上調與胃癌臨床分期、患者低生存率有關,敲低lncRNA SNHG3可在體內抑制異種移植胃癌的生長。lncRNA C16orf89基因定位于人16號染色體5060224-5065919區域,具有3個外顯子,但其在胃癌細胞中發揮作用的分子機制尚不清楚。
本研究發現,lncRNA C16orf89在胃癌組織及胃癌細胞系中的表達均顯著下調。與lncRNA C16orf89低表達的胃癌患者相比,lncRNA C16orf89高表達的胃癌患者總生存期較長。細胞功能學實驗顯示,過表達lncRNA C16orf89可在體外明顯降低AGS細胞的增殖和侵襲能力。以上結果提示,lncRNA C16orf89在胃癌的發生、演進過程中可能發揮抑癌基因功能。文獻[15]報道,lncRNA發揮功能的主要機制是通過海綿吸附miRNA,從而競爭性結合miRNA,引起miRNA的表達下調。例如,lncRNA LET通過海綿吸附miR-548k抑制胃癌細胞的增殖、侵襲和遷移,并促進細胞凋亡[16]。
本研究通過公共數據庫預測發現,lncRNA C16orf89與miR-95-3p有潛在的結合位點。miR-95-3p在前列腺癌、肝癌、膠質瘤等腫瘤組織和細胞系中高表達,其分布在細胞質中,可明顯促進腫瘤細胞增殖、侵襲,且在腫瘤進程中扮演原癌基因,與腫瘤患者的不良預后密切相關[17-19]。miR-95-3p在順鉑抗性的胃癌組織和細胞系中高度表達,其可有效促進胃癌細胞的增殖、侵襲、致瘤能力,在胃癌細胞中發揮促癌基因作用[20]。雙熒光素酶報告基因檢測證明lncRNA C16orf89與miR-95-3p間存在結合作用。同時,本研究表明lncRNA C16orf89過表達顯著降低AGS細胞中miR-95-3p的表達水平。以上結果證實lncRNA C16orf89可以通過海綿吸附miR-95-3p發揮作用。PI3K/AKT信號通路能夠促進胃癌細胞的增殖、轉移并抑制其分化,該信號通路的持續激活顯著促進胃癌的發生和演進。研究[20]證實,miR-95-3p能夠在胃癌細胞中直接靶向激活PI3K/AKT信號通路。本研究證明,lncRNA C16orf89競爭性結合miR-95-3p后,PI3K/AKT信號通路蛋白表達量降低,亦證實了lncRNA C16orf89/miR-95-3p調控軸的存在。
綜上所述,lncRNA C16orf89在胃癌組織和細胞系中表達下調,過表達lncRNA C16orf89能夠抑制胃癌AGS細胞增殖及侵襲,其分子機制是通過靶向抑制miR-95-3p表達干擾PI3K/AKT信號通路的持續激活。lncRNA C16orf89異常表達可能參與影響胃癌患者的惡性進程。

