海泡石改性制備磁性納米復合材料對Pb(II)去除的研究
于生慧, 王翼遠, 王 艷, 胡小敏, 姜銘峰
(陜西科技大學 環境科學與工程學院, 陜西 西安 710021)
0 引言
Pb作為一種在生產生活中重要的金屬元素,其常見于電池、金屬電鍍和精加工領域,并且也用作生產汽油的添加劑等[1],同時,Pb(II)的高毒性也會對人體健康和自然環境造成嚴重的威脅.根據世界衛生組織標準,飲用水中允許的Pb(II)濃度限制在0.01 mg/L以內,而根據美國環境保護署的調查顯示,即使在低濃度Pb(II)存在下,依然對人性會產生毒性[2].飲用水中Pb(II) 濃度過高可能導致多種疾病,包括腦病、貧血和肝炎.由于Pb(II)的不可降解性并會在生物體中積累,因而必須從水體和廢水中去除Pb(II)[3].目前,去除廢水中Pb(II)的方法主要有混凝-絮凝法[4]、膜過濾[5]、吸附[6]和離子交換[7].其中吸附法因有著方便、簡單、優異的去除能力和較低的經濟成本而被廣泛利用[8,9].生物炭和粘土礦物是常用的重金屬吸附劑受到廣泛研究[10].例如,Zhao等[11]制備出了一種綠色磁性生物炭用于吸附Pb(II),最大吸附容量可達196.91 mg/g;Yang等[12]通過熱解空心蓮子草合成了一種新型生物炭吸附劑(APB),結果也表明使用低成本的 APB 吸附劑處理重金屬污染水可能具有重要的生態和環境意義;Huang等[13]和Dinh等[14]則分別對凹凸棒石和膨潤土進行了改性,提高了粘土礦物對Pb(II)的吸附性能.
近些年來,由于納米材料特殊的性質,其開始在環境修復領域受到關注.特別是在水體中重金屬的處理方面,納米材料具有較大的比表面積和大量的表面活性位點,展現出巨大的應用潛力[15].納米水鎂石[Mg(OH)2]是一種優異的吸附劑,引發廣泛的研究興趣[16,17].例如,Liu等[18]探索了Mg(OH)2納米吸附劑在處理低濃度Cr(VI)時的循環回收方法;Liu等[19]研究表明Mg(OH)2負載納米級零價鐵后,對水溶液中Pb(II)的去除能力顯著增強;Zhang等[20]成功合成了磁性 Ni@Mg(OH)2納米復合材料,其對目標金屬的首次去除效率幾乎為100%,并且經過5次循環后,吸附容量仍保持在95%.
粘土礦物作為一種廣泛存在天然礦物,其主要為層狀硅酸鹽結構,由一個或兩個二氧化硅四面體圍繞八面體鋁片組成層狀結構單元[21],具備復雜多孔結構和較高比表面積,可與溶解物質發生強烈的物理、化學相互作用[22,23].通常情況下,粘土礦物去除水體中重金屬的方式一般有兩種:一是離子交換作用;二是與表面的硅氧基團和鋁氧基團與重金屬離子形成配合物[24,25].海泡石(Mg8Si12O30(OH)4(H2O)4·8H2O),是一種多孔纖維狀水合硅酸鎂,由兩個四面體二氧化硅中間夾著一個八面體氧化鎂組成的層鏈狀結構[26],從而具備較大的比表面積和孔體積,由于其特殊的納米棒狀形態,海泡石在環境修復中常被用作金屬離子的吸附劑[27,28].然而,天然海泡石對重金屬的去除容量較低,限制了其在重金屬去除中的應用,通過不同的物理、化學等手段對海泡石改性,能夠一定程度上提高其對重金屬處理的性能.
例如,Xu等[29]使用水熱反應改性海泡石,發現合成的海泡石/β-FeOOH催化劑在一定pH范圍內對Cr(VI)的光還原具有很好的催化性能;Xie等[30]利用羥基鐵結合酸堿改性海泡石去除水和土壤中的Cd,在298 K時,吸附量提升為220.9 mg/g.此外,由于海石體積小、密度低,從水溶液中難于分離.當外界環境發生改變時,吸附了重金屬的海泡石容易再次釋放重金屬造成二次污染.因此,如何有效分離環境中的吸附材料是促進納米吸附材料應用的重要課題.
近年來,磁性吸附劑由于使用后易于分離,其應用受到了廣泛的關注[31,32].在環境污染清理應用中,磁性吸附劑可以通過磁性過程從水溶液中分離和回收,且不會造成污染,目前粘土負載磁性材料的技術已有一定進展.Fayazi等[33]合成了海泡石-氧化鐵-二氧化錳 (Sep-Fe3O4-MnO2) 納米復合材料,并將其用于水中Pb(II)的去除,研究表明Sep-Fe3O4-MnO2可用作循環使用的吸附材料,并且被成功應用于工程實踐.Yu等[34]成功合成磁鐵礦/海泡石復合材料,其對Co(II)和Cd(II)的吸附容量分別為18.85 mg/g和14.15 mg/g.Zhou等[35]以表面聚吡咯(PPy)功能化海泡石纖維(SEP)為基礎,成功制備了一種具有磁性和浮選性能的新型吸附劑,在循環使用過程中,吸附劑的吸附能力保持在58.36~87.93 mg/g.Shen等[36]采用微波水熱法制備了新型尖晶石-NiFe2O4/天然礦物(海泡石、硅藻土和高嶺石)磁性復合材料,并用于催化降解有機物.
在本研究中,將通過將磁鐵礦負載到基于海泡石制備的SiO2-Mg(OH)2復合材料上,制備出一種新型的含鎂納米復合材料(SiO2-Mg(OH)2-Fe3O4).將制備出的SiO2-Mg(OH)2-Fe3O4用于去除水體中的Pb(II),并通過控制pH、反應時間、Pb(II)的初始濃度等單因素來研究其對吸附性能的影響.利用TEM、XPS、XRD、BET等技術分析復合材料的形貌結構和成分等特性以及對Pb(II)的吸附機理.研究表明基于海泡石改性制備的SiO2-Mg(OH)2-Fe3O4復合材料對水體中的Pb(II)具有良好吸附性能,有著較大的應用前景.
1 實驗部分
1.1 實驗試劑
本研究中所用的實驗藥品均為分析純(AR),海泡石購于西格瑪公司,水合三氯化鐵(FeCl3·6H2O)、氯化亞鐵 (FeCl2·4H2O)、氫氧化鈉 (NaOH)等藥品購于國藥集團.
1.2 材料的制備
首先采用Yao等[37]所報道的方法以海泡石為原料制備SiO2-Mg(OH)2納米復合材料,具體步驟如下:配置50 mL濃度為0.6 mol/L的HCI溶液,稱取2.0 g海泡石加入其中,在60 ℃下攪拌12 h,然后向溶液中緩慢滴加NH3·H2O,直至溶液pH到10.0左右,繼續攪拌2 h.反應結束后,將產物離心并用蒸餾水洗滌直至pH=7.0~8.0,最后將固體沉淀放入60 ℃干燥箱中,烘干后研磨、備用.
SiO2-Mg(OH)2-Fe3O4的制備:稱取0.27 g的FeCl3·6H2O和0.10 g的FeCl2·4H2O,加入到20 mL的乙二醇溶液中,再加入0.25 g SiO2-Mg(OH)2復合材料,在超聲機(額定功率100 W)99%功率下超聲30 min,然后將溶液轉移到100 mL的圓底燒瓶中并加入5 mL濃度為0.8 mol/L的NaOH溶液,使溶液充分混勻.將混合溶液置于微波反應器(額定功率650 W)中,在80%的功率條件下反應20 min.反應完成后將產物以8 000 r/min的速度離心,并用無水乙醇洗滌3~4次,然后將固體沉淀放入真空干燥箱中烘干,研磨、備用.
1.3 儀器與樣品表征
通過場發射掃描電鏡(SEM,型號:ZEISS Gemini 300)和透射電子顯微鏡(TEM,型號:H-800)分析復合材料的形貌特征;通過X射線衍射儀(XRD,型號:Rigaku Smartlab)對產物進行物相的分析;通過比表面積儀分析并計算出材料的比表面積和孔體積(BET,型號:Micromertics 2010);通過光電子能譜儀分析材料的元素及價態(XPS,型號:ESCALAB 250).
1.4 Pb(II)吸附實驗
通過溶解Pb(NO3)2制備含Pb(II)的貯備液,然后用去離子水稀釋到實驗所需的濃度.在Pb(II)的吸附實驗過程中,稱取50 mg所制備的吸附材料加入50 mL的含Pb(II)溶液中,調節到特定pH攪拌一定時間,在吸附劑加入前使用0.1 mol/L的HCI和NaOH溶液將溶液體系pH,吸附實驗結束后,靜置、磁分離,然后將上清液通過0.22 μm孔徑濾膜過濾.采用ICP-AES測量Pb(II)濃度,并用公式(1)、(2)計算吸附量qe(mg/g)和去除率U%:
(1)
(2)
式(1)、(2)中:Co(mg/L)是Pb(II)的初始濃度,Ct(mg/L)和Ce(mg/L)分別為任意時間和平衡時Pb(II)的濃度,V(mL)是溶液的體積,W(mg)是材料的投加量.
1.5 吸附動力學模擬和吸附熱力學模擬
本實驗中分別使用準一級模型(3)和準二級模型(4)對反應數據進行吸附動力學擬合;采用Freundlich模型(5)和Langmuir模型(6)對反應體系進行吸附熱力學擬合,線性方程如下所示:
ln(qe-qt)=lnqe-k1t
(3)
(4)
lnqe=lnKF+(1/n)lnCe
(5)
(6)
式(3)~(6)中:qe和qt分別為在平衡時間和任意時間復合材料對Pb(II)的吸附量,k1為準一級模型的速率常數,k2為準二級模型的速率常數,t是吸附時間,Ce是吸附達到平衡時Pb(II)的濃度,1/n是經驗常數,qm是Pb(II)的最大吸附量,KF是Freundlich方程常數,KL是Langmuir方程常數.
準一級模型根據t和ln(qe-qt)進行線性擬合,準二級模型根據t和t/qt進行線性擬合;Freundlich模型根據lnCe和lnqe進行線性擬合,Langmuir模型根據Ce和Ce/qe進行線性擬合.
2 結果和討論
2.1 復合材料的表征
對海泡石原樣和改性后所得的復合材料通過SEM和TEM觀察形貌結構.如圖1(a)、(b)所示,海泡石是納米級別的棒狀結構,4~5 μm長,50 nm寬.通過能譜分析可知海泡石中主要以Mg、Si、O三種元素為主.由圖1(c)、(d)可知,海泡石經過酸堿改性后,樣品出現團聚現象,納米棒狀結構依然存在,但與海泡石原樣相比,改性后海泡石表面更加粗糙,孔隙增多,表明海泡石原樣中的晶體結構中的O-Mg八面體遭到破壞,非晶SiO2作為更加穩定的結構出現,由于非晶SiO2為膠體,容易發生團聚.酸堿化的樣品經負載后,從宏觀來看,其結構特點與酸堿化樣品沒有特多差異(圖1 (e)),可以在團聚體中觀測到納米棒狀結構;然而,其高分辨掃描照片顯示,復合材料表面出現許多納米顆粒(圖1 (f)),表明通過微波輔助回流法,納米磁鐵礦成功地負載于復合材料表面.

圖1 材料的SEM和TEM圖
圖2是磁鐵礦負載后材料在TEM場景下的能譜分析.可以清晰地看到,樣品中除了Mg、Si、O元素外,出現了Fe元素,并且鐵元素均勻分布于復合材料表面,含量約為10.33%.結合SEM和Mapping分析可以推斷,納米級磁鐵礦通過微波輔助回流反應被成功負載到酸堿化海泡石所制備的SiO2-Mg(OH)2復合材料的表面.

圖2 SiO2-Mg(OH)2-Fe3O4的TEM和MAPPING分析圖
圖3是為以海泡石為原料制備的SiO2-Mg(OH)2和SiO2-Mg(OH)2-Fe3O4納米復合材料的XRD圖譜.從圖3可以看到,海泡石原材料經過酸堿改性后,已無明顯的海泡石特征峰,所得結果與Yao等[37]所報道相一致;在通過進一步負載磁鐵礦后,復合材料XRD圖譜在35.5°、56.9°和62.5°處出現了磁鐵礦的特征峰.
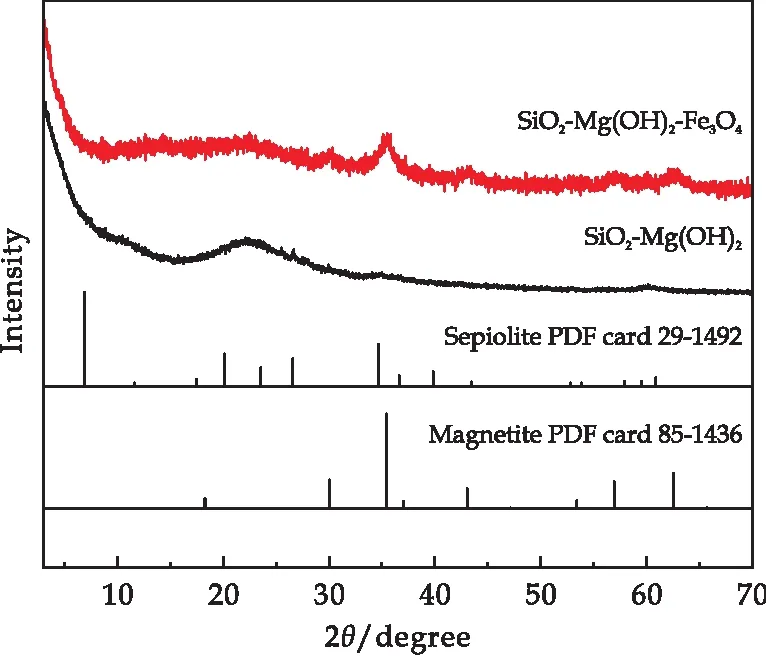
圖3 復合材料的XRD譜圖
由于Fe3O4和γ-Fe2O3兩者的XRD衍射圖近似,為進一步鑒別復合材料的組成,對材料進一步做了XPS光譜分析,結果如圖4所示.
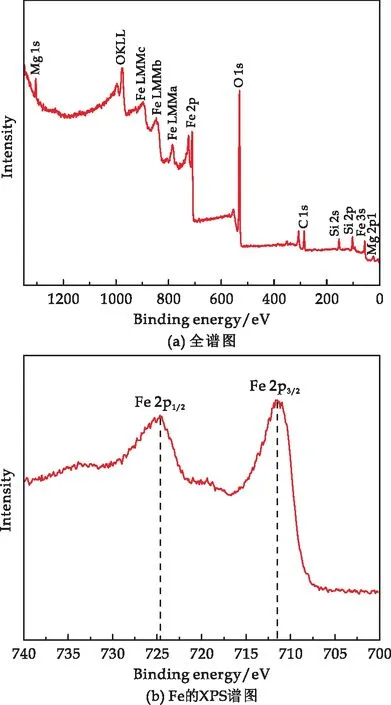
圖4 復合材料的XPS圖譜
復合材料的XPS全譜圖(圖4(a))顯示復合材料主要含有O、Mg、Si、Fe等元素,進一步證明了有含Fe化合物的存在,Fe的2p1/2和2p3/2的結合能(圖4(b))分別在724.7 eV和710.5 eV的位置,該結果與Fe3O4的XPS一致[38],且圖譜中未出現磁赤鐵礦所特有的衛星峰.樣品的XRD和XPS結果進一步證實,通過微波冷卻回流法,成功制備了SiO2-Mg(OH)2-Fe3O4磁性納米復合材料.
SiO2-Mg(OH)2-Fe3O4磁性納米復合材料的氮氣吸附等溫線和孔徑分布如圖5所示.由圖可以看到,復合材料的氮氣吸附解吸等溫線具有明顯的滯后回環,表現為IV類吸附型,說明樣品中存在介孔,材料的孔徑分布2~10 nm之間.所制備磁性復合材料的BET比表面積為544.9 m2/g,孔容積為0.52 cm3/g,其比表面積遠高于海泡石原樣(263.4 m2/g)和海泡石酸堿化處理所制備的SiO2-Mg(OH)2(364.3 m2/g)的比表面積[37].所制備復合材料比表面積的增大可歸結于納米磁鐵礦成功負載于SiO2-Mg(OH)2復合材料表面,使其具備更加復雜的空間結構.SiO2-Mg(OH)2-Fe3O4磁性納米復合材料具有大的比表面積和高的孔容積,有利于其對重金屬離子的吸附作用.
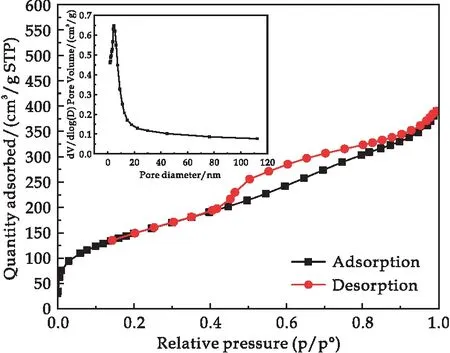
圖5 復合材料氮氣吸附等溫線及孔徑分布
2.2 磁性納米復合材料對Pb(II)的去除
所制備納米磁性復合材料對重金屬Pb(II)的吸附情況如圖6所示.反應體系的pH是影響吸附材料對重金屬吸附性能的重要因素,因此實驗中首先研究了溶液pH對Pb(II)的吸附影響.為了防止復合材料的溶解,同時避免Pb(II)沉淀的產生(Ksp[Pb(OH)2]=1.2×10-15),依據Pb(II)的初始濃度(300 mg/L),因此在本實驗中pH控制在2.0~6.0.溶液的初始pH在加入吸附劑之前通過0.1 mol/L的HCI和NaOH溶液調節,攪拌時間為12 h.
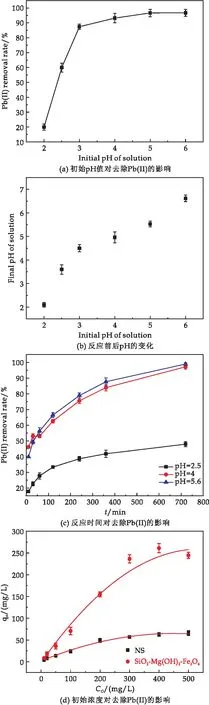
圖6 復合材料對Pb(II)的去除
圖6(a)是pH對吸附過程的影響.如圖所示,隨著溶液pH的升高,Pb(II)的去除率也逐漸提高.當pH在2~3范圍內時,去除率的上升非常顯著,pH超過3后,去除率的增加逐漸趨于平緩并在pH為5~6之間達到頂峰,約為96.7%.這是因為隨著溶液pH的升高,溶液中H+濃度降低,OH-濃度增加,SiO2-Mg(OH)2-Fe3O4表面的負電荷逐漸增加,使得重金屬離子與吸附劑之間的靜電吸引力增大,促進了材料對Pb(II)的吸附.結果表明當pH為5和6時,SiO2-Mg(OH)2-Fe3O4對Pb(II)的吸附效果基本一致,為模擬所合成材料對自然水體中重金屬去除情況,后續實驗選用5.6作為pH設定條件之一.同時,由圖6(b)可知,不同初始pH條件下的溶液在反應結束后,溶液的pH值都略微上升,這是由于復合材料中的水鎂石(Mg(OH)2)溶解所致,水鎂石溶解導致體系pH升高,使復合材料表面帶有更多的負電荷,有利于吸附材料對重金屬陽離子的吸附[37].
為了進一步研究反應時間對Pb(II)的去除效果的影響,將體系的pH值分別調節至2.5、4.0和5.6,在反應進行到10 min、30 min、60 min、120 min、240 min、360 min、720 min時取樣分析,Pb(II)的初始濃度為300 mg/L.如圖6(c)所示,在pH=2.5,反應時間為12 h時,SiO2-Mg(OH)2-Fe3O4對Pb(II)的去除率只有47.91%;在pH=4.0時,反應1 h后,溶液中Pb(II)的濃度下降了約53%,并在12 h后Pb(II)的去除率達到97.15%;在pH=5.6時,體系反應1 h后也能去除約56.2%的Pb(II),12 h后溶液中只殘留了約1%的Pb(II).這表明實驗所制備的SiO2-Mg(OH)2-Fe3O4納米復合材料在廣泛的pH條件下對Pb(II)有著較優異的去除效果;在pH=4~6下,反應時間為60 min時即可達到50%以上的去除率,并且隨著反應時間的增加,Pb(II)的去除率進一步提高,當pH=4和5.6,反應12 h后,去除率基本可達95%以上.劉崇敏等[39]和周佳松等[40]研究發現,天然海泡石、硝酸鈉改性海泡石、巰基乙酸改性海泡石、硫酸亞鐵改性海泡石和熱處理改性海泡石對Pb(II)的吸附平衡時間基本要在24 h 達到平衡,通過海泡石改性制備的SiO2-Mg(OH)2-Fe3O4復合材料提高了對Pb(II)的吸附效率.
圖6(d)反映了Pb(II)的初始濃度對去除效果的影響,Pb(II)的初始濃度分別為10 mg/L、20 mg/L、50 mg/L、100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L,體系pH為5.6,作用時間為12 h.結果顯示,海泡石改性制備的磁性復合材料對Pb(II)的最大吸附量約為257.6 mg/g.比較而言,天然海泡石(NS)對Pb(II)的最大吸附量為65.6 mg/g,所制備的磁性復合材料SiO2-Mg(OH)2-Fe3O4對Pb(II)的去容量相較于海泡石對Pb(II)的去除容量大幅度提升.
2.3 SiO2-Mg(OH)2-Fe3O4磁性納米復合材料對Pb(II)的吸附動力學模擬
分別使用準一級動力學(公式(3))和準二級動力學模型(公式(4))對數據進行擬合,線性擬合結果如圖7所示,表1為擬合的相關參數.擬合結果及相關參數表明,準一級動力學的R2為0.995,準二級動力學的R2為0.988,這說明磁性納米復合材料對Pb(II)的吸附更符合準一級動力學,表明該吸附過程以物理吸附為主.

表1 復合材料對Pb(II)吸附的準一級、準二級擬合參數
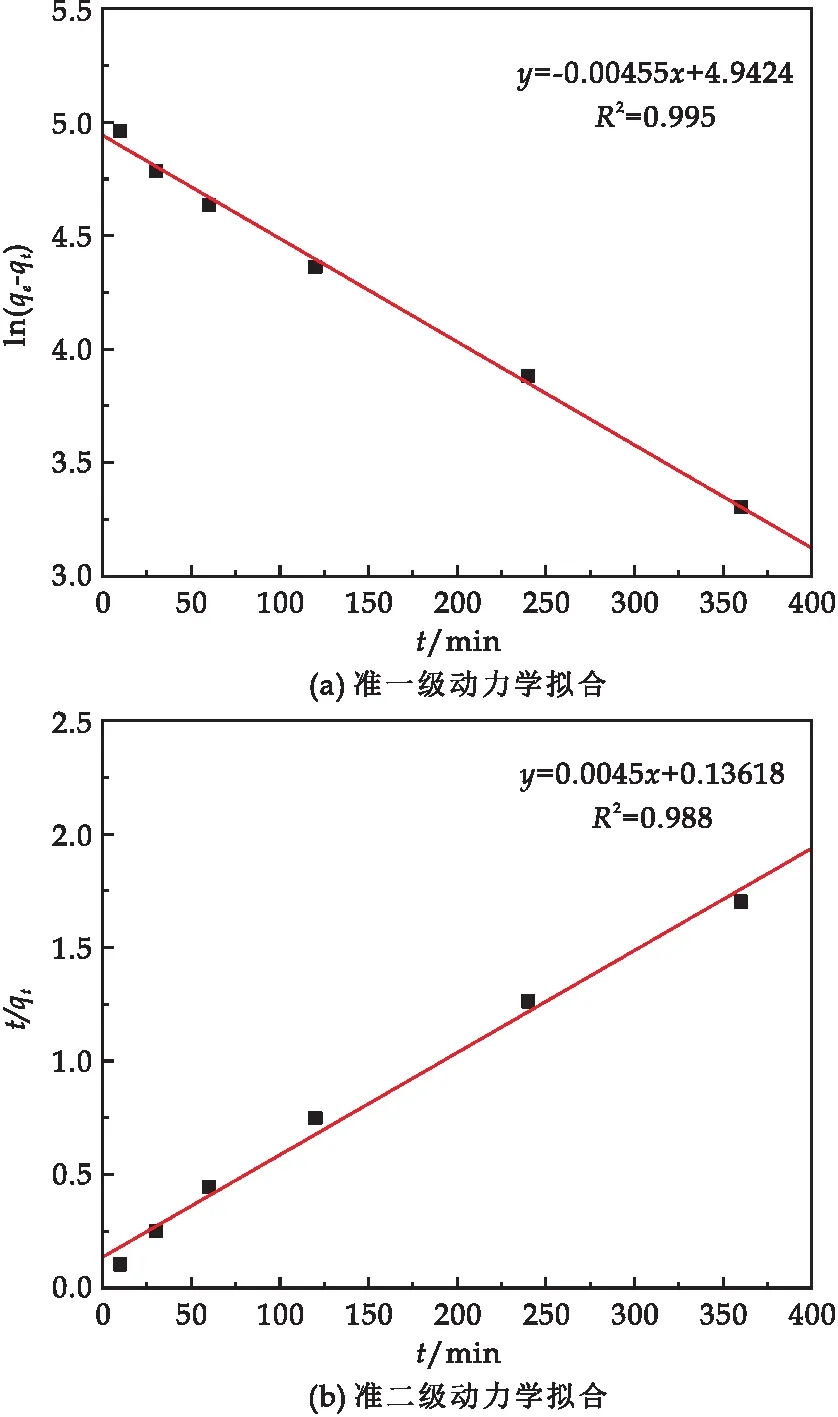
圖7 復合材料對Pb(II)吸附的動力學擬合
2.4 SiO2-Mg(OH)2-Fe3O4磁性納米復合材料對Pb(II)的吸附熱力學模擬
分別使用Freundlich模型(公式(5))和Langmuir模型(公式(6))對數據進行擬合,線性擬合結果如圖8所示.擬合結果及相關參數(表2)顯示, Freundlich模型的R2為0.997 9,而Langmuir模型的R2僅為0.579 5,因此SiO2-Mg(OH)2-Fe3O4對Pb(II)的吸附更符合Freundlich模型,表明該吸附過程以多分子層吸附為主.

表2 Freundlich和 Langmuir擬合參數
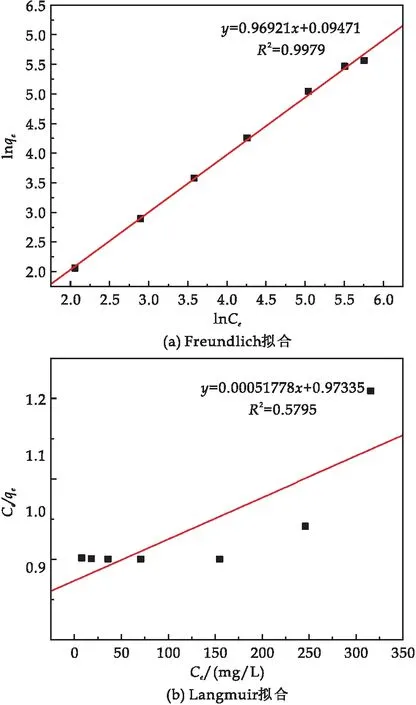
圖8 復合材料對Pb(II)吸附的熱力學擬合
2.5 吸附后材料的表征
對吸附Pb(II)之后的復合材料進行XRD和SEM分析.如圖9所示,吸附前后材料的XRD譜圖并無明顯變化,并沒有檢測到Pb(OH)2和Pb的化合物的相關特征峰, SEM結果顯示(圖10(a)),吸附后材料仍為棒狀結構,吸附并不會對材料的微觀結構產生顯著影響.Mapping分析結果表明,Pb元素富集于材料表面,證實海泡石改性制備的磁性復合材料對Pb的良好吸附性.
以上結果顯示,海泡石制備的磁性納米復合材料主要通過吸附對Pb(II)進行去除.其對Pb(II)優異的吸附效果可歸結為: (1) 納米級別的磁鐵礦被負載到材料表面,增大了材料的比表面積,促進其對Pb(II)的吸附;(2)通過酸堿改性,海泡石中結晶態的Mg變成了Mg(OH)2,而Mg(OH)2在水中會釋放OH-,增加溶液的pH值,提高SiO2-Mg(OH)2-Fe3O4對Pb(II)的去除率[37].
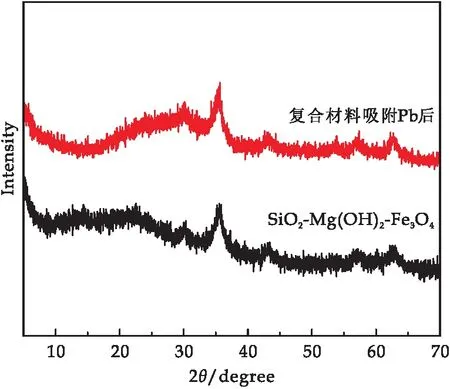
圖9 復合材料吸附Pb后的XRD譜圖

圖10 復合材料吸附Pb后的SEM和Mapping分析
3 結論
本研究中,以海泡石為原料,首先通過酸堿改性制備SiO2-Mg(OH)2,在此基礎上負載磁鐵礦,制備出具有更大比表面積的SiO2-Mg(OH)2-Fe3O4含鎂納米磁性復合材料.所制備的材料SiO2-Mg(OH)2-Fe3O4在廣泛的pH條件下對Pb(II)展現出良好的吸附效果,最大吸附量可達257.6 mg/g.同時,磁性納米復合材料對低濃度的Pb(II)處理后,Pb(II)的殘留濃度低于美國環保局(EPA)飲用水標準.吸附過程動力學中符合準一級動力學模型,在吸附熱力學過程更符合Freundlich吸附模型,納米磁性復合材料對Pb(II)的吸附過程以物理吸附為主.
由于所制備納米磁性復合材料對重金屬Pb(II)有著較為優秀的去除性能,同時天然粘土礦物來源豐富,改性方法簡捷,并且吸附劑容易通過磁分離技術與溶液分離,由海泡石改性制備的磁性納米復合材料在水體重金屬處理領域將有著較大的應用潛力.

