9735例舒血寧注射液安全性醫院集中監測研究
曲 陽,馬玄靜,李清華,李和林,趙曉晨,孫興華,張 淼,陳 宏
9735例舒血寧注射液安全性醫院集中監測研究
曲 陽1,馬玄靜2,李清華3,李和林4,趙曉晨5,孫興華1,張 淼1,陳 宏6*
1. 黑龍江中醫藥大學附屬第二醫院 臨床研究部,黑龍江 哈爾濱 150001 2. 石家莊高新區太行社區衛生服務中心 全科醫療科,河北 石家莊 050000 3. 河北省承德市隆化縣中醫醫院 心血管內科,河北 承德 067000 4. 中國中藥協會 中藥注射劑安全性再評價研究課題組,北京 100101 5. 北京康派星醫藥科技開發有限公司 項目部,北京 100000 6. 黑龍江省中醫藥科學院(黑龍江省中醫醫院)中醫臨床研究所,黑龍江 哈爾濱 150036
通過安全性醫院集中監測研究,探索舒血寧注射液在真實世界使用過程中可能存在的不良反應及其影響因素,并發現未知或罕見的不良反應。采用藥品安全性醫院集中監測方法,觀察2016年8月—2020年10月注冊登記的39家醫療機構所有使用舒血寧注射液9735例患者,用藥期間不良事件/反應發生情況,采用單因素和多因素方法分析舒血寧注射液藥物不良反應發生率及其影響因素。9735例患者在使用舒血寧注射液過程中共有256例發生不良事件,不良事件發生率為2.63%,其中23例患者發生的36例次不良反應經三級專家判定與舒血寧注射液有關,舒血寧注射液藥物不良反應發生率0.236%,總體不良反應發生率屬于偶見范圍。所有不良反應均為一般不良反應,無嚴重不良反應及非預期不良反應發生。36例次不良反應按照系統分類依次為全身性疾病及給藥部位各種反應8例次、胃腸系統損傷7例次、各類神經系統損害6例次、心血管系統疾病6例次、皮膚及皮下組織類疾病5例次,咳嗽、咳痰、肢體疼痛、靜脈炎各1例次。單因素及多因素Logistic回歸分析,用藥3~5 d和6 d及以上發生不良反應的風險分別較用藥3 d以下降低86%、99.6%;合并高同型半胱氨酸血癥、首次使用舒血寧注射液、用藥時長、單次注射持續時間及合并使用川芎嗪類、氨茶堿類注射液對不良反應發生的影響均有統計學意義(<0.05),提示為危險因素。舒血寧注射液在臨床使用中不良反應發生率低,安全性良好,并提示合并高同型半胱氨酸血癥、首次使用舒血寧注射液、用藥時長、單次注射持續時間及合并使用川芎嗪類、氨茶堿類注射劑時應特別注意安全風險。
舒血寧注射液;中藥注射劑;醫院集中監測;不良反應;安全風險
中藥注射劑是在中醫藥理論指導下,應用現代科學技術和方法,從中藥、天然藥物的單方或復方中提取的有效物質制成的可供注入人體內的滅菌制劑,以及供臨用前配制成溶液的無菌粉末或濃溶液[1-2]。中藥注射劑是我國特有的藥品劑型,生物利用度高、起效快、作用強,在心腦血管、惡性腫瘤等疾病的臨床治療中表現出一定的療效優勢[3-4]。特別是在發生新型冠狀病毒感染疫情以來,多種中藥注射劑被收入國家《新型冠狀病毒感染的肺炎診療方案》,中藥注射劑對新冠病毒感染的治療價值得到認可。近年來,隨著我國藥品不良反應監測技術和監測體系的發展與完善,藥品不良事件的報告數量明顯增加,行業內、患者和公眾對中藥注射劑安全性問題的關注成為近年來的熱點之一[5-6]。從2001年11月—2020年6月,國家藥品不良反應監測中心發布的77期《藥品不良反應信息通報》中有29種中成藥被通報,其中中藥注射劑就有15種[7]。國家藥品監督管理局報告指出,2020年全國藥品不良反應監測網絡收到《藥品不良反應/事件報告表》167.6萬份,其中化學藥和生物制品占84.1%、中藥占13.4%。化學藥不良反應中注射劑占88.1%,中藥中注射劑占7.8%[8]。針對中藥注射劑的安全性進行監測和評價,獲得藥品“真實世界”應用情況下的安全性信息,將有助于進一步指導臨床合理用藥,有利于理性看待中藥注射劑臨床應用和不良反應事件,便于制藥企業采取風險控制措施,使用藥風險最小化。
舒血寧注射液是由石藥銀湖制藥有限公司生產的銀杏葉提取物的滅菌水溶液,主要成分為總黃酮醇苷、銀杏內酯,功能主治為擴張血管、改善微循環,主要用于缺血性心腦血管疾病、腦血管痙攣等[9-12]。一些研究團隊對舒血寧注射液有效性進行研究[13-16],并探討了其作用機制[17-19],但舒血寧注射液上市后在廣泛應用下的安全性尚缺乏研究數據支撐。為集中監測舒血寧注射液上市后臨床大規模人群使用時的不良反應發生率及不良反應表現特征,綜合評價其安全性,本研究收集了39家醫療機構使用舒血寧注射液9735例患者的臨床資料,通過巢式病例對照研究,探索舒血寧注射液不良反應的發生特征,分析其臨床使用安全性的影響因素,進而指導臨床合理用藥,為進一步研究舒血寧注射液的安全性提供參考依據,為其臨床合理處方提供理論依據。
1 資料與方法
1.1 監測方法
采用多中心、大樣本、醫院集中監測的方式。
1.2 監測機構
全國共設39家監測機構,其中黑龍江中醫藥大學附屬第二醫院為組長單位,承德市隆化縣中醫院、哈爾濱市道里區太平人民醫院、臨沂市費縣人民醫院、昆明仁華醫院、保定市蘭池區蘭園社區衛生服務站、哈爾濱市道外區巨源衛生院、哈爾濱市道外區民主鄉衛生院、蘭西縣平山鎮中心衛生院等機構共同參與本次安全性醫院集中監測。
1.3 監測對象
監測對象為2016年8月—2020年10月在39家監測機構使用舒血寧注射液的所有患者。
1.4 樣本量
根據國際通用“三例原則”[20]分步實施,本次監測樣本量為10 000例。
1.5 監測周期
監測每例患者從開始用藥至用藥結束的全過程,即用藥期間全程觀察。
1.6 監測形式和內容
本研究監測的形式分為2種,一是由臨床醫師觀察并由臨床醫師填寫監測表;二是由臨床醫師觀察,繼而將觀察結果上報藥師,由藥師填寫監測表。監測表分為A、B表。A表包括一般信息、診斷信息、用藥信息、聯合用藥信息,每個病例均需填寫;B表是不良事件相關信息,由發生不良事件的患者填寫。A、B表具體內容包括①一般信息:性別、年齡、生命體征、個人過敏史、家族過敏史等;②診斷信息:西醫診斷、中醫診斷、合并疾病;③用藥信息:舒血寧注射液的使用方式、用藥天數、藥物劑量、溶媒、溶媒用量、注射室溫、配液放置時間、注射持續時間、滴速:④聯合用藥信息:合并用藥名稱,注射前、注射期間及注射后使用的注射劑名稱,注射前后是否沖管及更換輸液器:⑤不良反應/ 事件信息:不良反應/事件名稱、發生時間、癥狀/體征、臨床檢驗,不良反應/事件結果、轉歸、預后,懷疑藥品、溶媒、輸液器、合并用藥品的名稱及其批準文號、通用名、生產廠家、批號、用法用量、室溫等,關聯性評價結果等。
1.7 質量控制
質量控制主要從以下7個方面實施:監測中心、監測人員、監測進度、原始文件、電子數據、檔案管理、質量管理。其中,原始文件和電子數據是質量控制的重要內容。原始文件方面,主要是防止漏報病例及監測表的填寫質量檢查。通過調取醫院信息系統數據中研究時間范圍內使用舒血寧的病例數,與實際登記例數進行對照,檢查是否有漏報情況。原始文件質量方面,通過與原始病歷進行溯源檢查,要求具備規范性、及時性、準確性、真實性。電子數據要求與紙質監測表內容一致。
1.8 數據管理
本研究的數據采集工具是監測表,并建立專有網絡平臺數據庫。采用獨立雙人雙份數據錄入的形式,并由計算機執行差異校驗功能,解決錄入間的不一致。數據的現場核查主要指核對源數據(住院病歷)與監測表或電子數據的一致性。在收集數據結束之后,對所有數據進行整體核查與清理,包括清除重復數據、修改錯誤數據和疾病或藥物名稱不標準的數據,繼而鎖定數據庫,用于統計分析。
1.9 不良反應因果關系判定
按照國家藥品不良反應監測中心2011年公布的《藥品不良反應報告和監測管理辦法》(衛生部第81號令),不良事件的判定采用三級判定方式:一級判定由主管醫生判斷;二級判定在一級判定結果存在異議時,由監測單位專家委員會對一級判定的結果進行復核;三級判定除一級判定結果和二級判定結果為“可能無關”的不良事件外,其余不良事件由課題組不良反應判定專家委員會進行判定。采用6級不良事件關聯性評價對不良事件與舒血寧注射液的關聯性進行評價,包括肯定、很可能、可能、可能無關、待評價、無法評價。
1.10 數據標準化
參照西醫ICD-10疾病分類對西醫診斷進行規范化;參照《中華人民共和國國家標準—中醫病證分類與代碼》(GB/T15657-1995)[4]對中醫診斷標準化;采用ATC編碼對藥品名稱進行標準化;采用MedDAR(24.0版本)對不良反應/事件名稱及所屬系統進行標準化。
1.11 數據統計分析方法
2 結果
2.1 監測完成情況及患者人口學特征
39家醫療機構共監測使用舒血寧注射液的患者9735例,其中男性4346例,占比44.64%,女性5389例,占比55.36%。患者平均年齡(63.72±10.88)歲。
2.2 舒血寧注射液使用情況
監測的9735例首次使用舒血寧注射液患者比例和非首次使用的基本相當,分別為49.92%和50.08%,平均用藥時間(7.02±3.19)d。從用法用量來看,基本上都是每天連續給藥,選擇的溶媒主要是5%葡萄糖(69.46%)或0.9%生理鹽水(29.58%)。單次給藥劑量絕大多數在15或20 mL(89.73%),其次是10 mL(7.64%),其他單次給藥劑量很少。每次靜滴時間平均(1.18±0.44)h。見表1。
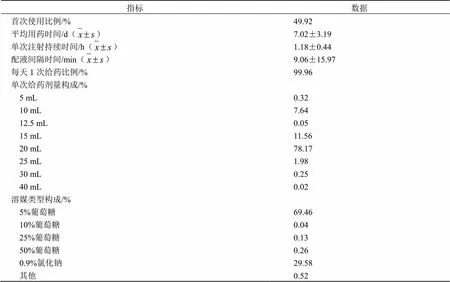
表1 被監測患者治療期間舒血寧注射液的使用情況
2.3 不良事件和不良反應發生率
本次監測的9735例患者中,共有256例發生不良事件,不良事件發生率為2.63%。其中23例共36例次不良事件與舒血寧注射液使用有關,舒血寧注射液藥物不良反應發生率為0.236%。所有不良反應均為已知的一般不良反應,未發現新的或嚴重不良反應。721例單獨使用舒血寧注射液的患者中,發生不良事件的患者24例,不良事件發生率為3.33%,未見相關不良反應。
2.4 不良反應表現及系統分類
23例患者共發生36例次不良反應,不良反應表現涉及心血管、神經、肌肉骨骼及結締組織、損傷、中毒及操作并發癥、呼吸、皮膚及皮下組織、全身性反應及給藥部位、胃腸系統等。不良反應表現及分類見表2。
2.5 不良反應類型、發生時間及轉歸
根據不良反應分型,36例次不良反應中屬于A型反應9例次(包括頭暈、皮膚潮紅各2例次,靜脈炎、皮疹、惡心、胸部不適、嘔吐各1例次),B型反應17例次(包括瘙癢癥、皮疹、心悸、頭暈各2例次,胸部不適、腹脹、咳痰、咳嗽、肢體疼痛、頭痛、腫脹、惡心、嘔吐各1例次),C型反應10例次(包括心悸3例次、胸部不適2例次,惡心、干嘔、寒戰、頭暈、心悸、血壓升高各1例次)。其中判定為肯定有關3例次,很可能有關17例次,可能有關15例次,無法判定1例次。36例次不良反應發生時間均在24 h內,其中主要在使用舒血寧注射液0.5~24 h發生(表3)。所有患者不良反應均痊愈和好轉,未出現后遺癥和死亡。
2.6 不良反應人群特點及用藥特征
2.6.1 年齡和性別 23例不良反應患者中,男性10例,女性13例;平均年齡63.14歲,60歲以上患者15例,60歲以下患者8例。
2.6.2 西醫診斷和合并疾病 23例不良反應患者用藥適應證主要是心腦血管疾病,包括腦血管病后遺癥(3例)、腦梗死(1例)、腦血管痙攣(5例)、隱匿性冠心病(3例)、心律失常冠心病(1例)、心絞痛(4例)及腦神經衰弱、腦萎縮、頸椎病可能、3級極高危高血壓、頭顱多發性腦梗死、腦供血不足(各1例)。有18例患者合并有除第一疾病診斷以外的其他疾病診斷,主要是高血壓、冠心病和糖尿病。
2.6.3 中醫診斷 不良反應患者中9例患者有中醫診斷,分別是胸痹4例、中風2例、頭暈頭痛3例。2.6.4 既往不良反應史 23例不良反應患者中,僅3例患者有既往不良反應史,包括皮疹2例,瘙癢1例。
2.6.5 舒血寧注射液用藥特征及合并用藥 23例不良反應患者使用舒血寧注射液均采用靜脈滴注的方式,其中21例為首次使用;單次給藥劑量以20 mL為主(14例),15 mL 6例,25 mL 2例,5 mL 1例;溶媒方面,18例使用5%葡萄糖,5例使用0.5%生理鹽水;配液后放置時間在10 min以內11例,10~30 min 3例,30 min以上9例。23例不良反應患者均合并使用其他注射液,其中有3例同時注射,合并使用其他注射劑情況見表4。
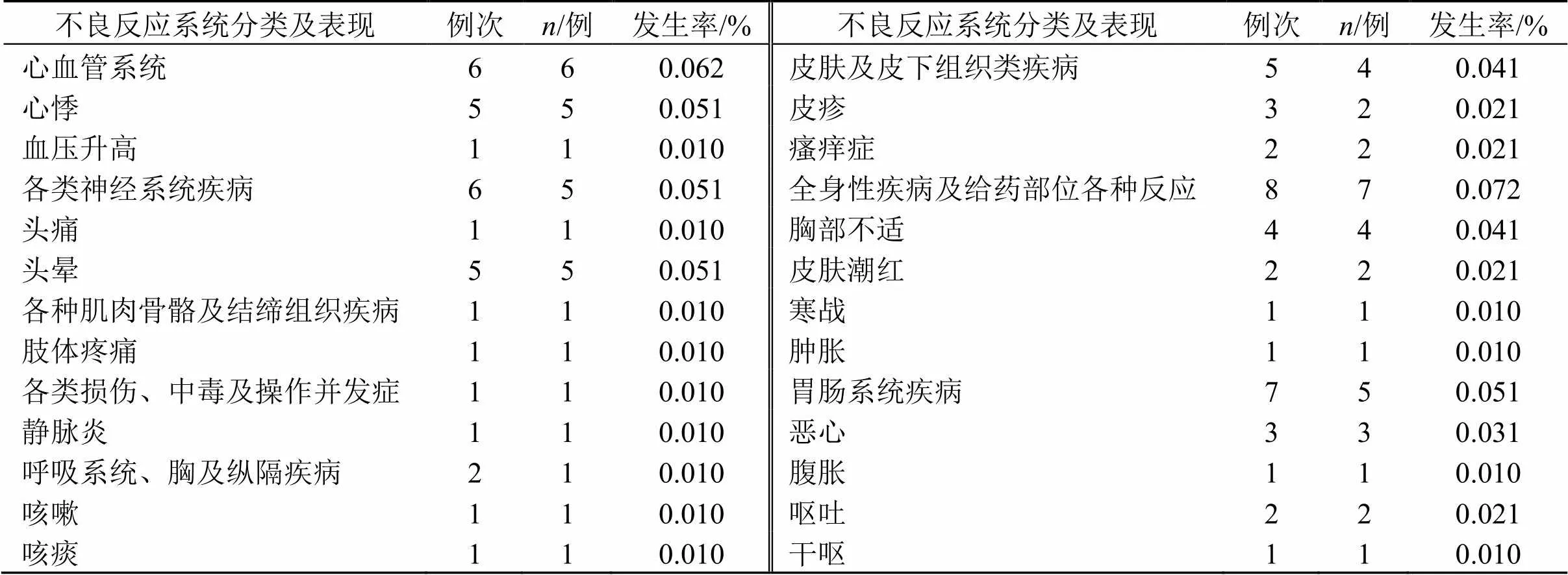
表2 不良反應系統分類及表現

表3 不良反應發生時間分布
2.6.6 出現不良反應距離最近一次用藥時間 23例不良反應中,11例發生在舒血寧注射液靜脈點滴過程中,11例發生在舒血寧注射液靜滴結束后使用其他注射液靜滴過程中,1例無法確定和舒血寧注射液使用時間的關系。

表4 不良反應患者合并使用其他注射劑情況
2.6.7 不良反應轉歸處理 36例次不良反應中,原劑量繼續使用的有7例次(19.44%),完全停用的有29例次(80.56%)。采取對癥處理的21例次(58.33%),不良反應最終轉歸痊愈的19例次(52.78%),好轉17例次(47.22%),未出現后遺癥和死亡。所有不良反應對原患疾病的影響均不明顯。
2.7 舒血寧注射液不良反應影響因素分析
對患者的基本信息包括性別、年齡、體質量指數、就診醫院信息、既往病史、既往過敏信息、合并疾病等信息進行單因素分析,最終得出≤0.20的影響因素有(1)人口學信息:體質量、體質量指數分級、既往是否有不良反應、既往不良反應表現為皮疹或瘙癢;(2)本次使用舒血寧注射液原因:西醫診斷腦栓塞、中醫診斷眩暈;(3)合并疾病:頸椎病、支氣管炎、腦血管供血不足、高原性心臟病、高同型半胱氨酸血癥;(4)舒血寧注射液的使用情況:首次使用舒血寧注射液、用藥天數、單次注射持續時間、配液間隔時間、單次給藥劑量、是否推薦劑量、是否推薦溶媒劑量、給藥濃度;(5)是否有順序合并使用其他注射液:合并其他注射液;(6)順序合并使用注射液類型:合并活血祛瘀劑;(7)合并使用藥物:天麻素注射劑、血塞通注射劑、川芎嗪注射劑、氨茶堿注射劑。為探索影響舒血寧注射液藥物不良反應的影響因素,選擇患者人口統計學特征、既往不良反應表現、適應證、合并疾病、舒血寧注射液使用情況、合并使用注射液等相關變量為自變量,以患者是否發生不良反應為因變量建立Logistic逐步回歸模型(模型自變量進入水準0.1,剔除水準0.2),模型變量及其編碼見表5。逐步回歸多因素分析結果顯示,合并高同型半胱氨酸血癥、首次使用舒血寧注射液、用藥時間、單次注射持續時間及使用舒血寧注射液時合并使用川芎嗪類注射液、氨茶堿類注射液對不良反應發生的影響均有統計學意義,提示為危險因素。回歸結果見表6。
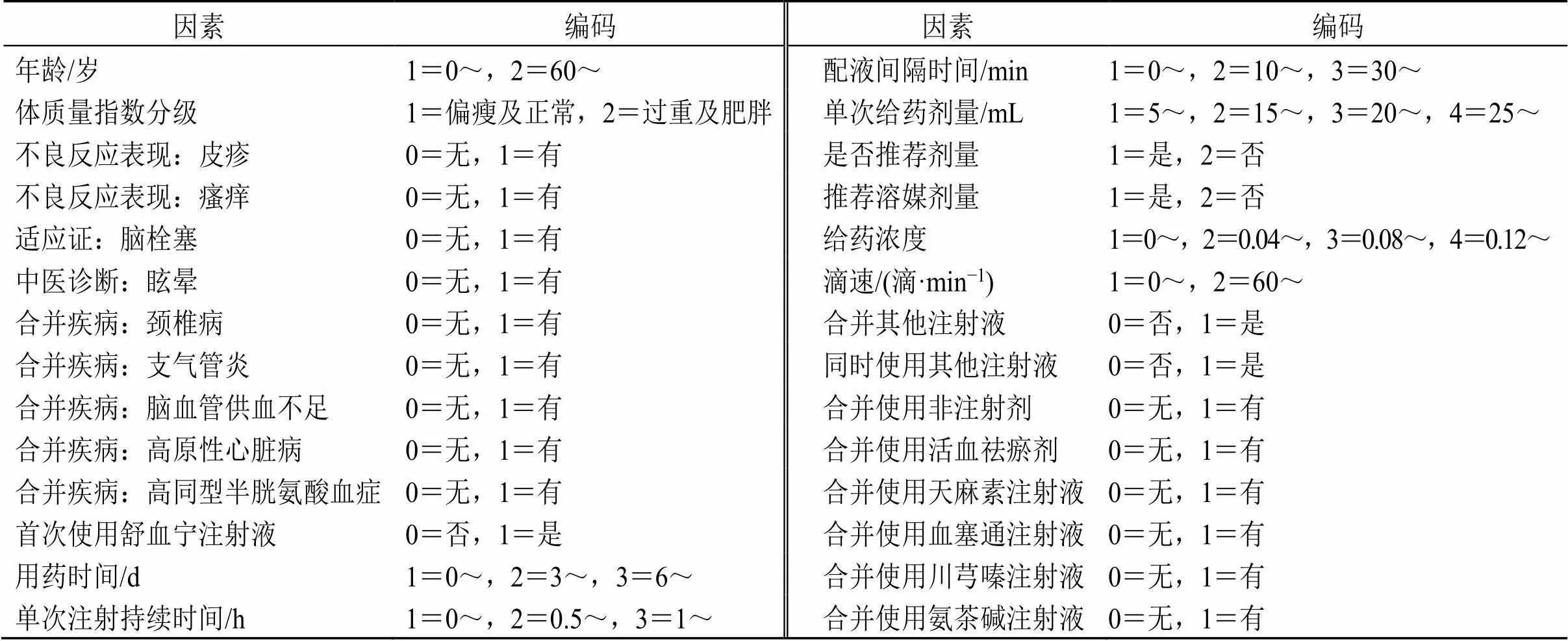
表5 Logistic回歸納入變量及其編碼
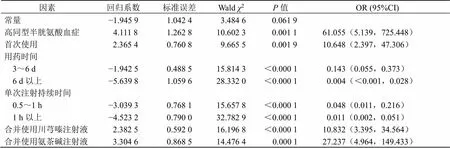
表6 Logistic回歸分析結果
*模型擬合信息:赤池信息準則(AIC)=195.275、2=88.683 1,<0.000 1
*model fitting information: akaike information criterion (AIC) = 195.275,2= 88.683 1,< 0.000 1
3 討論
近年來,中藥注射劑不良反應的相關報道引起社會的廣泛關注,其適應證相對寬泛,臨床應用常把控不嚴,對于辨證還是辨病給藥,臨床存在較大爭議,且伴隨中藥注射劑臨床使用率的提高,其不良反應發生率也明顯升高,其安全性遭到社會質疑[21-22]。因此,中藥注射劑臨床合理應用的監管尤為重要,提高臨床用藥合理性、保障患者安全、完善中藥注射劑用藥安全性監測體系、提高臨床中藥注射劑的規范使用率是當今需要考慮的臨床實際問題[23-24]。
本次監測的9735例患者中,共256例患者發生不良事件,不良事件發生率為2.63%;共23例患者發生不良反應36例次,均為已知的一般不良反應,不良反應發生率為0.236%,屬于偶見不良反應,且均發生在合并順序使用其他注射液的人群中,無嚴重不良反應及非預期不良反應發生,說明舒血寧注射液的安全性良好。與吳婷婷[25]研究結果不同,其研究中嚴重不良反應發生率為2.4%,但由于其納入患者較少(208例),考慮主要受到個體因素影響,仍需進一步論證。監測中涉及最多的系統為全身性疾病及給藥部位各種反應發生8例次,包括胸部不適、皮膚潮紅、腫脹、寒戰;其次,胃腸系統損傷7例次,包括惡心、腹脹、嘔吐、干嘔;各類神經系統損害6例次,包括頭痛、頭暈;心血管系統6例次,分別為心悸、血壓升高;皮膚及皮下組織類疾病5例次,包括皮疹、瘙癢癥;另外,咳嗽、咳痰、肢體疼痛、靜脈炎各1例次。主要在使用舒血寧注射液0.5~24 h發生。這與姜俊杰等[26]研究結果有一定差異,其研究報道中使用舒血寧注射液2 h時不良反應發生率較高,時間范圍更小,考慮可能與本研究不良反應時間取值范圍有關,仍待后續研究進一步論證。本研究提示舒血寧注射液誘發的不良反應出現時間較快,臨床使用時需要醫護人員做好用藥30 min至24 h的觀察。本次監測中發現,皮膚及皮下組織類損傷均發生于舒血寧注射液靜注過程,多持續0.5~1 h;全身性疾病及給藥部位各種反應多發生于注射結束后的2 h內;胃腸系統損傷多發生在舒血寧注射液靜注結束后的2~3 h。所有不良反應對原患疾病的影響均不明顯,且轉歸為痊愈和好轉。說明書提示需著重關注出血風險及加強肝功能監測,但本次監測中未收集到相關的不良反應,可能與樣本量較少有關。
通過單因素及多因素Logistic回歸提示,用藥3~5 d和6 d及以上發生不良反應的風險分別較用藥3 d以下降低86%、99.6%;考慮在23例不良反應患者中,11例(45.8%)只接受1 d治療,3例(12.5%)接受2 d治療,4例(16.6%)接受4 d治療,1例(4.1%)接受6 d治療。用藥時長越長發生不良反應的風險越低,可能與治療過程中部分受試者因出現不良反應而停止接受治療有關。本研究無法獲得用藥時長的相關結論。根據結果中多因素分析提示,合并高同型半胱氨酸血癥、首次使用舒血寧注射液、用藥時長、單次注射持續時間及使用舒血寧時合并使用川芎嗪類注射液、氨茶堿類注射液為不良反應發生的危險因素。可能與合并高同型半胱氨酸血癥的患者發生心腦血管和神經系統疾病、糖尿病、慢性腎臟疾病、骨質疏松癥、不良妊娠的概率更高有關,尤其對于老年人群來說,其身體對于疾病耐受力更低,合并糖尿病、腎病等基礎疾病會增加不良反應的發生風險[27-28];既往使用過舒血寧注射液的患者若發生不良反應,可能不會二次使用,這也是為何首次使用舒血寧注射液可能不良反應發生風險更高的原因,首次用藥更應嚴格控制輸注速度和用藥指征,加強監護[29];單次注射持續時間越短,顯示安全性風險越高,但既往研究中未見相關報道,其作用機制尚不明確,有待后續進一步證實;合并使用川芎嗪類、氨茶堿類注射液不排除藥物間相互作用產生的不良反應,既往研究中也曾提出舒血寧注射液與氨茶堿類藥物存在配伍禁忌[30],但合并川芎嗪類、氨茶堿類注射液不良反應發生的作用機制并不明確。總體分析結果與舒血寧注射液說明書注意事項一致,但本研究不良反應數量較少,仍需進一步驗證。
根據上述分析結果制定相關風險管理措施,如加強對臨床醫護合理用藥方面的培訓,規范記錄患者合并疾病信息,對合并糖尿病、腎病等基礎疾病人群進行限定,使用藥風險降到最小,保證臨床用藥安全。
本研究按照多階段抽樣選擇樣本醫療機構,采用全院監測方法,樣本人群有很好的代表性,且隨訪周期足以觀察不良反應的全部轉歸過程,對風險管控措施的完善具有指導意義。對舒血寧注射液不良反應的相關危險因素進行分析,進一步明確使用風險,指導臨床應用。但由于各種原因,本研究存在一定局限性:首先真實世界數據質量控制較難,可能存在患者不良反應漏報情況,或由于研究者水平有限,影響結果準確性,故臨床診療規范性記錄尤為重要;其次,一級醫院納入患者比例較高或住院患者比例較高,都可能導致研究結果的偏倚;最后,由于安全性較好,未觀察到嚴重不良反應,沒有進行巢式病例-對照研究,后續可以開展更大樣本量研究。
通過本次集中監測證實舒血寧注射液在臨床使用中不良反應少,不良反應發生率低,安全性良好,并提示合并高同型半胱氨酸血癥、首次使用舒血寧注射液、用藥時長、單次注射持續時間及合并使用川芎嗪類、氨茶堿類注射液時應特別注意使用風險。
參研中心:黑龍江中醫藥大學附屬第二醫院、保定市蘭池區蘭園社區衛生服務站、保定市淶源縣白石山鎮衛生院、保定市淶源縣南馬莊衛生院、保定市淶源縣南屯鄉衛生院、承德市隆化縣中醫院、哈爾濱市道里區太平人民醫院、哈爾濱市道里區新農鎮衛生院、哈爾濱市道外區巨源衛生院、哈爾濱市道外區民主鄉衛生院、哈爾濱市道外區團結鎮衛生院、哈爾濱市木蘭鎮衛生院、哈爾濱市南崗區紅旗滿族鄉衛生院、哈爾濱市南崗區王崗鎮衛生院、哈爾濱市松北區萬寶鎮衛生院、河津市城區社區服務中心、河津小梁鄉衛生院、槐中路社區衛生服務站、昆明仁華醫院、蘭西縣平山鎮中心衛生院、臨沂市費縣人民醫院、石家莊高新區宋營鎮衛生院、石家莊市長安區桃園社區衛生服務中心、辛集市王口鎮衛生院、新絳縣店頭鄉衛生院、新絳縣橫橋鎮衛生院、新絳縣柳泉鄉衛生院、宣威云峰醫院、云南省開遠工人醫院、運城市鹽湖區大渠衛生服務院、運城市鹽湖區南城社區服務中心內西姚分中心、運城市鹽湖區西城辦事處社區衛生服務中心、運城市鹽湖區席張鄉衛生院、運城市鹽湖區泓芝驛衛生院、運城市稷山縣蔡村鄉衛生院、棗莊市永安鎮衛生院、淶源縣王安鎮中心衛生院、滕州市西崗中心衛生院、稷山縣太陽鄉衛生院、稷山縣稷峰鎮衛生院管村分院。
利益沖突 所有作者均聲明不存在利益沖突
[1] 張兆旺. 中藥藥劑學 [M]. 北京: 中國中醫藥出版社, 2003: 228.
[2] 翟宇瑤, 段萬里, 薛小榮, 等. 基于德爾菲法構建中藥注射劑臨床應用評價指標體系的研究 [J]. 藥物流行病學雜志, 2021, 30(2): 110-115.
[3] 鄒鳳丹, 李永林, 紀亞明, 等. 中藥注射劑不良反應/事件回顧性分析 [J]. 中成藥, 2021, 43(1): 285-288.
[4] 吳志瑋. 醫院中藥注射劑的管理對策研究 [J]. 中醫藥管理雜志, 2021, 29(19): 87-89.
[5] 夏旭東, 程偉高, 周明, 等. 基于真實世界數據的清開靈注射液不良反應信號挖掘與分析[J]. 中草藥, 2023, 54(4): 1220-1227.
[6] 翟靜波, 張俊華, 閻小妍, 等. 中藥注射劑安全性醫院集中監測研究的統計分析相關問題及對策 [J]. 世界科學技術—中醫藥現代化, 2017, 19(1): 166-170.
[7] 國家藥品不良反應監測中心. 藥品不良反應信息通報 [EB/OL]. (2020-06-09) [2021-11-16]. https://www.nmpa. gov.cn/so/s?qt=%E8%8D%AF%E5%93%81%E4%B8%8D%E8%89%AF%E5%8F%8D%E5%BA%94%E4%BF%A1%E6%81%AF%E9%80%9A%E6%8A%A5%EF%BC%88%E7%AC%AC&siteCode=bm35000001&tab=all&toolsStatus=1.
[8] 國家藥品不良反應監測年度報告(2020年) [EB/OL]. (2021-03-06) [2021-09-17]. https://www.nmpa.gov.cn/ xxgk/fgwj/gzwj/gzwjyp/20210325170127199.html.
[9] 彭杰, 李潔瓊, 熊元元. 舒血寧注射液對急性腦梗死病人血液流變學及生活質量的影響 [J]. 中西醫結合心腦血管病雜志, 2021, 19(11): 1914-1916.
[10] 李佳娜, 艾世宜, 李星. 舒血寧注射液輔助治療對冠心病心絞痛患者預后及血清結締組織生長因子、轉化生長因子的影響 [J]. 山西醫藥雜志, 2021, 50(9): 1506-1508.
[11] 徐明昌, 徐錦錦, 邵艷敏. 舒血寧注射液治療對急性腦梗死后神經功能缺損及認知功能的影響 [J]. 新中醫, 2021, 53(5): 63-65.
[12] 甄永生. 舒血寧注射液聯合長春西汀治療突發性耳聾的療效及對血管內皮功能的影響 [J]. 現代診斷與治療, 2020, 31(19): 3030-3032.
[13] 黃涯, 何天麥, 韓松潔, 等. 舒血寧注射液臨床證據評價及其效應特點 [J]. 世界科學技術—中醫藥現代化, 2018, 20(10): 1754-1760.
[14] 王俊依. 舒血寧注射液聯合早期作業治療腦卒中恢復期臨床研究 [J]. 新中醫, 2022, 54(16): 65-68.
[15] 高亞, 劉明, 施樹珍, 等. 舒血寧注射液的系統評價再評價 [J]. 中國中藥雜志, 2021, 46(14): 3712-3721.
[16] 顧瑩. 舒血寧注射液聯合無創正壓通氣對老年慢性阻塞性肺疾病合并呼吸衰竭患者的影響 [J]. 血栓與止血學, 2022, 28(3): 429-430.
[17] 郭春英, 寧召臣, 董鵬志, 等. 無標記細胞檢測方法揭示舒血寧注射液對血栓素A2受體亞型的選擇性抑制作用 [J]. 中藥藥理與臨床, 2017, 33(2): 86-91.
[18] 蔡松泉, 蔡予. 舒血寧注射液治療急性腦梗死的療效及其作用機制 [J]. 吉林醫學, 2017, 38(8): 1527-1528.
[19] 焦光美, 單海雷, 張曉璇, 等. 舒血寧注射液對急性腦梗死大鼠腦組織的保護作用及其機制 [J]. 吉林大學學報: 醫學版, 2020, 46(3): 557-562.
[20] Strom B L, Kimmel S E.[M]. New York: John Wiley & Sons (Asia) Pte Ltd., 2008: 28.
[21] 譚喜瑩, 任發燕, 王超. 合理用藥監測系統在中藥注射劑使用中的作用分析 [J]. 藥學與臨床研究, 2020, 28(6): 470-472.
[22] 王珂欣, 高麗, 秦雪梅, 等. 中藥注射劑色差與安全性研究進展 [J]. 中草藥, 2019, 50(9): 2219-2223.
[23] 何曉其. 用藥合理性與安全性監測在中藥注射劑監管中的應用 [J]. 中醫藥管理雜志, 2021, 29(13): 132-133.
[24] 于瑞, 王建茹, 彭廣操, 等. 中藥注射液防治蒽環類藥物所致心臟毒性的系統評價[J]. 中草藥, 2021, 52(10): 3051-3060.
[25] 吳婷婷. 西安市2013—2017年舒血寧注射液藥品不良反應報告回顧分析 [J]. 醫藥導報, 2019, 38(1): 49-53.
[26] 姜俊杰, 謝雁鳴, 張寅, 等. 30209例舒血寧注射液安全性醫院集中監測研究 [J]. 中國中藥雜志, 2017, 42(15): 2883-2888.
[27] 李乃謙. 活血化瘀中藥臨床應用不良反應分析 [J]. 海峽藥學, 2019, 31(3): 272-273.
[28] 張國領, 張林, 劉桂萍. 高同型半胱氨酸血癥的臨床研究進展 [J]. 中國醫藥導報, 2018, 15(20): 29-32.
[29] 張曉娟, 劉娟. 鹽酸莫西沙星注射液致靜脈炎不良反應分析 [J]. 北方藥學, 2019, 16(9): 187-189.
[30] 李艷玲, 韓玉娥, 魏云英. 舒血寧與氨茶堿存在配伍反應 [J]. 河北職工醫學院學報, 2005, 22(4): 21.
Intensive hospital monitoring study on safety of 9735 cases of Shuxuening Injection
QU Yang1, MA Xuan-jing2, LI Qing-hua3, LI He-lin4, ZHAO Xiao-chen5, SUN Xing-hua1, ZHANG Miao1, CHEN Hong6
1. Department of Clinical Research, the Second Affiliated Hospital of Heilongjiang Traditional Chinese Medicine University, Harbin 150001, China 2. Department of General Practice, Taihang Community Health Service Center, High-tech Zone, Shijiazhuang 050000, China 3. Department of Cardiovascular Medicine, Chengde Longhua Hospital of Traditional Chinese Medicine, Chengde 067000, China 4. Research Group of Chinese Medicine Injection Safety Reevaluation of China Association of Chinese Materia Medica, Beijing 100101, China 5. Project Department, Beijing Kangpaixing Pharmaceutical Technology Development Co., Ltd., Beijing 100000, China 6. Institute of Clinical Chinese Medicine, Heilongjiang Academy of Traditional Chinese Medicine (Heilongjiang Provincial Hospital of Traditional Chinese Medicine, Harbin 150036, China
To explore the possible adverse reactions and influencing factors of Shuxuening Injection (舒血寧注射液) in the real world, and to find unknown or rare adverse reactions through safety hospital centralized monitoring study.From August 2016 to October 2020, 9735 patients who used Shuxuening Injection in 39 medical institutions were registered by hospital centralized monitoring method of drug safety. Adverse events/reactions during medication were observed and recorded. Univariate and multivariate methods were used to analyze the incidence and influencing factors of adverse drug reactions in Shuxuening Injection.A total of 256 adverse events occurred in 9735 patients during the use of Shuxuening Injection, and the incidence of adverse events was 2.63%. Among them, 36 adverse events occurred in 23 patients were judged to be related to Shuxuening Injection by third-level experts, and the incidence of adverse drug reactions of Shuxuening Injection was 0.236%. The overall incidence of adverse reactions was in the occasional range. All ADRs were general adverse reactions, and no serious adverse reactions and unexpected adverse reactions occurred. According to the systematic analysis, the 36 adverse reactions were systemic diseases and various reactions at the administration site (eight cases), gastrointestinal system injury (seven cases), nervous system damage (six cases), cardiovascular system diseases (six cases), skin and subcutaneous tissue diseases (five cases), cough, expectoration, limb pain, and phlebitis (one case each). Univariate and multivariate logistic regression analysis showed that the risk of adverse reactions for 3—5 d and more than 6 d were reduced by 86% and 99.6%, respectively, compared with those for less than 3 d. The effects of combined hyperhomocysteinemia, first use of Shuxuening Injection, duration of medication, duration of single injection, combined use of Ligustrazine and Aminophylline injections on the occurrence of adverse reactions were statistically significant (< 0.05), suggesting that they were risk factors.Shuxuening Injection has few adverse reactions, low incidence of adverse reactions and good safety in clinical use. It is suggested that special attention should be paid to the risk of combined hyperhomocysteinemia, first use of Shuxuening Injection, duration of medication, duration of single injection, combined use of Ligustrazine and Aminophylline injections.
Shuxuening Injection; traditional Chinese medicine injection; hospital centralized monitoring; adverse reaction; safety risk
R285.64
A
0253 - 2670(2023)10 - 3253 - 08
10.7501/j.issn.0253-2670.2023.10.022
2022-11-23
科技部科技重大專項—示范性新藥臨床評價技術平臺建設(2018ZX09734-002-004);黑龍江中醫藥大學中藥臨床療效與安全性評價工程中心資助項目(2017SEC01)
曲 陽,碩士,主治醫師,研究方向為中醫藥治療心腦血管疾病的臨床與基礎研究。E-mail: 328681236@qq.com
陳 宏,博士,主任醫師,從事中醫臨床與中藥臨床藥理學研究。E-mail: zyykxych@163.com
[責任編輯 潘明佳]

