外周血淋巴細胞與單核細胞比值在初診多發性骨髓瘤患者中的預后價值
朱亭郡,何芳,趙彩芳,胡慧仙
浙江大學醫學院附屬金華醫院血液科,浙江金華 321000
多發性骨髓瘤(multiple myeloma,MM)屬于漿細胞惡性腫瘤,是第二常見的血液系統惡性腫瘤。隨著蛋白酶體抑制劑和(或)免疫調節藥物與自體造血干細胞移植的聯合使用,MM 的總生存(overall survival,OS)得到顯著提高[1]。然而,幾乎所有的MM 患者最終均會復發。早期識別高危人群和適當的治療方案可提高緩解率并延長生存時間[2]。目前,評估MM 的預后多采用Durie-Salmon(D-S)分期體系、國際分期體系(international staging system,ISS)和修訂的國際分期體系(revised-international staging system,R-ISS),但這些分期系統多基于腫瘤負荷,未涉及宿主免疫相關因素。而熒光原位雜交評估MM患者預后的價格昂貴,成本和非便利性限制其在臨床上的應用。研究證實,MM 的進展與免疫功能障礙有關[3]。因此迫切需要方便易得的免疫相關預后指標以評價患者的風險并指導治療,從而延緩疾病進展。外周血的免疫相關指標易獲得,近年來研究發現,淋巴細胞與單核細胞比值(lymphocyte-to-monocyte ratio,LMR)是一種潛在的可反映宿主免疫狀態的生物標志物,可能與多種腫瘤預后相關[4-6]。Shi 等[7]報道LMR 升高是初診MM 患者的良好預后指標,是OS的獨立預測因素。為探討LMR 對初診MM 患者的預后預測價值,本研究對初診MM 患者進行回顧性分析,現將結果報道如下。
1 資料與方法
1.1 研究對象
回顧性收集2016 年2 月至2022 年1 月浙江大學醫學院附屬金華醫院收治的156 例MM 患者的臨床資料。納入標準:①初診為MM;②接受以硼替佐米為基礎的化療;③符合《中國多發性骨髓瘤診治指南(2022 年修訂)》[8]的診斷標準;④無免疫藥物治療史。排除標準:①復發難治性MM;②確診前有化療、免疫治療相關病史;③合并自身免疫疾病。本研究經浙江大學醫學院附屬金華醫院倫理委員會批準(倫理審批號:2022 倫審第95 號),并取得患者知情同意。
1.2 方法
1.2.1 研究方法 收集所有患者入院時的相關臨床資料,包括外周血淋巴細胞和單核細胞計數、年齡、性別、血紅蛋白(hemoglobin,Hb)、白蛋白、乳酸脫氫酶(lactate dehydrogenase,LDH)、肌酐、血鈣、D-S 分期、ISS 分期、β2 微球蛋白、M 蛋白類型等。
1.2.2 隨訪方法 采取查閱患者的住院資料及電話聯系進行隨訪,截止時間為2022 年5 月。156 例患者中無失訪,隨訪率100%。OS 時間指從疾病診斷至任何原因導致的死亡或隨訪結束的時間;無進展生存(progression free survival,PFS)時間指從疾病診斷至首次出現疾病進展、任何原因導致死亡或隨訪結束的時間。
1.3 統計學方法
本研究采用SPSS 26.0 軟件進行統計學分析。計數資料以例數(百分率)[n(%)]表示,比較采用χ2檢驗或連續校正χ2檢驗。采用受試者操作特征曲線(receiver operator characteristic curve,ROC 曲線)對LMR 的最佳臨界值進行評估,并記錄曲線下面積(area under the curve,AUC)。生存分析采用Kaplan-Meier 法,并進行Log-rank 檢驗。單因素和多因素Cox 回歸分析初診MM 患者的預后影響因素。P<0.05為差異有統計學意義。
2 結果
2.1 LMR 預測MM 患者預后的ROC 曲線
外周血LMR 臨界值為3.01 時,預測患者是否存活的敏感度為69.7%,特異性為78.9%,AUC 為0.813(95%CI:0.733~0.893),見圖1。
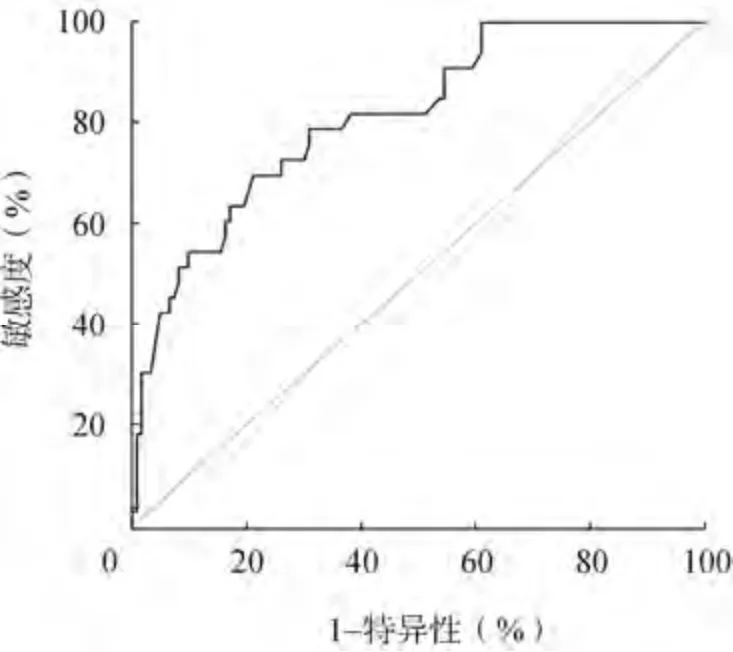
圖1 LMR 預測MM 患者預后的ROC 曲線
2.2 MM 患者臨床特征與LMR 的關系
根據ROC 曲線確定的最佳臨界值,將患者分為低LMR 組(LMR<3.01,n=49)和高LMR 組(LMR≥3.01,n=107)。兩組患者的年齡、性別、Hb、血清白蛋白、LDH、血清肌酐、血鈣、D-S 分期、ISS分期、M 蛋白類型、β2 微球蛋白水平比較,差異均無統計學意義(P>0.05),見表1。
2.3 通過LMR 預后分層的MM 患者生存分析
MM 患者的中位隨訪時間為30.5(3~75)個月。低LMR 組患者的中位OS 時間(55 個月vs.未達到)和中位PFS 時間(21 個月vs.39 個月)均顯著短于高LMR 組(P<0.05)。低LMR 組患者的OS 率和PFS 率均顯著低于高LMR 組(P<0.05),見圖2。
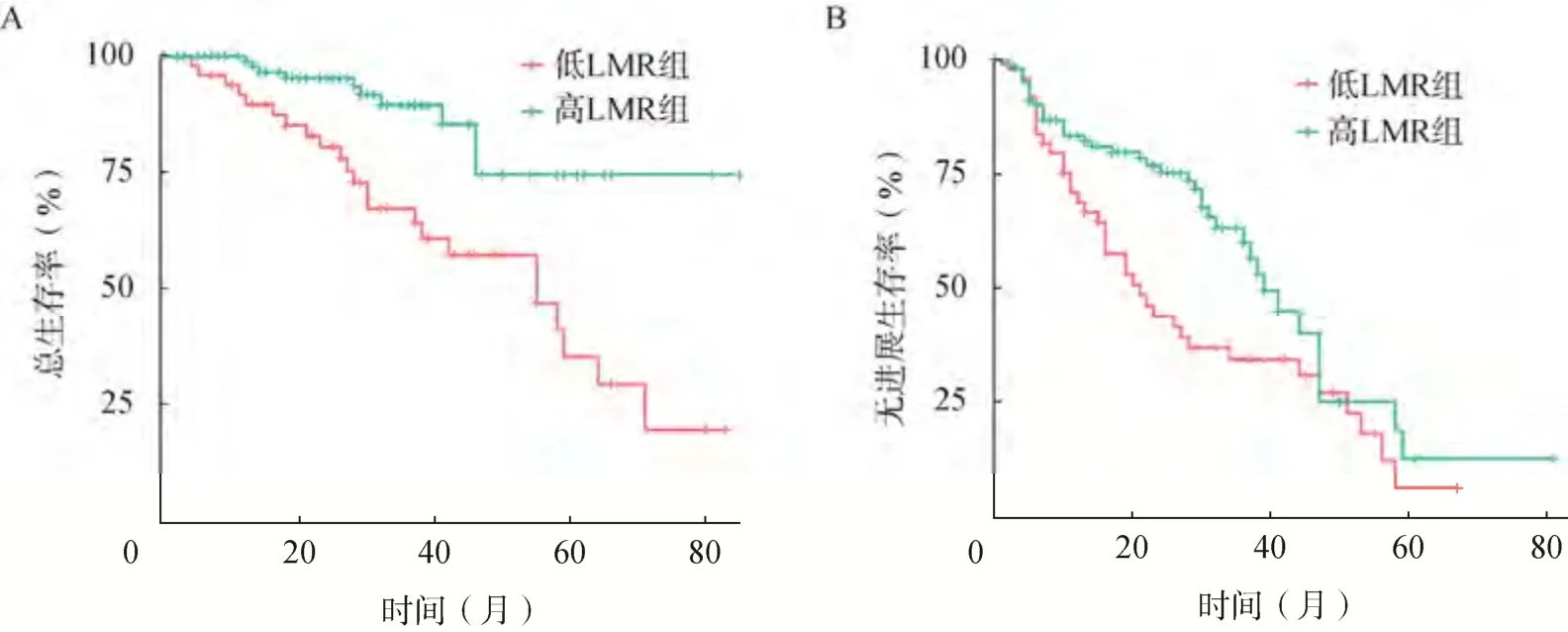
圖2 兩組患者的生存曲線比較
2.4 影響MM 患者預后的單因素和多因素分析
單因素Cox 回歸分析結果顯示,LMR、Hb、LDH、D-S 分期、ISS 分期、β2 微球蛋白均是MM 患者OS的影響因素(P<0.05),LMR、Hb、D-S 分期、ISS分期、β2 微球蛋白均是MM 患者PFS 的影響因素(P<0.05),見表2。多因素Cox 回歸分析結果顯示,LMR 是影響MM 患者OS 及PFS 的獨立危險因素(P<0.05),見表3。
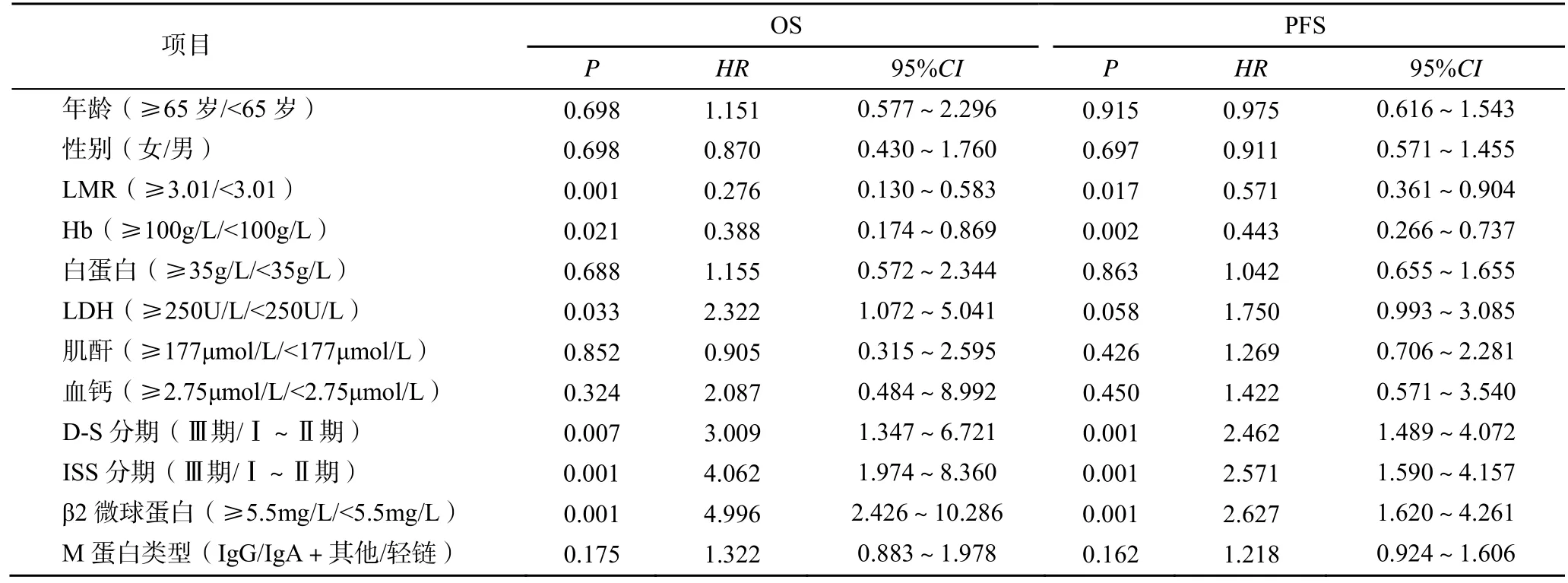
表2 影響MM 患者OS 及PFS 的單因素分析
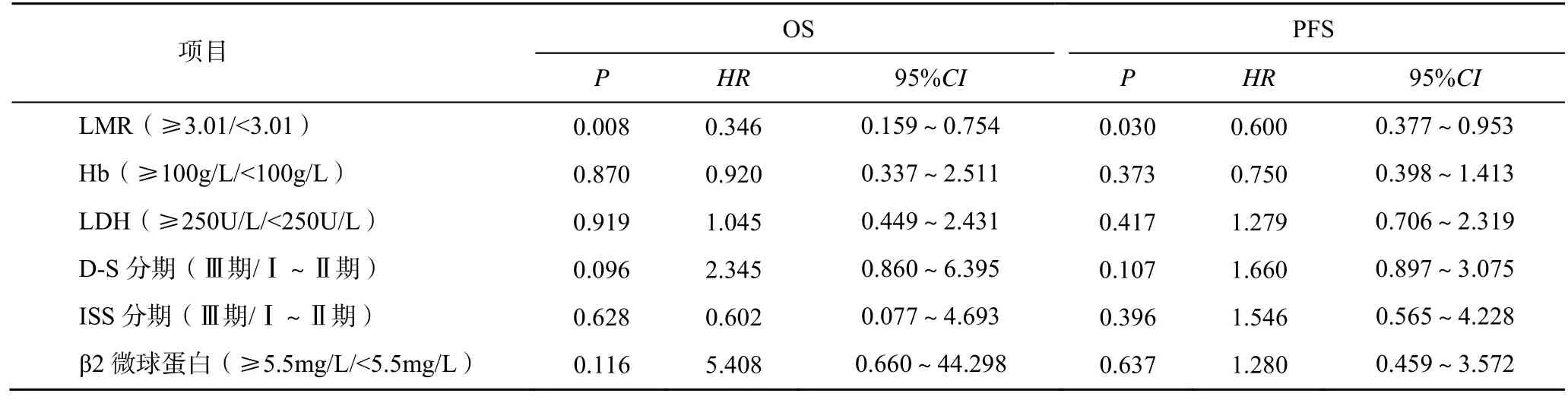
表3 影響MM 患者OS 及PFS 的多因素分析
3 討論
雖然MM 患者的預后近年來得到明顯改善,但MM 仍然是一種無法治愈的疾病,多數患者在緩解后常出現疾病復發或進展。MM 喪失免疫監視的關鍵介質,并形成促進疾病進展和對治療抵抗耐受的免疫環境[8]。骨髓微環境在MM 的發生發展中起重要作用,骨髓微環境不僅可支持骨髓瘤細胞增殖與存活,且與其耐藥性有關[9]。炎癥細胞是骨髓微環境的主要組成部分,研究發現,炎癥細胞在腫瘤的發生、生長和發育中起重要作用[10]。外周血淋巴細胞計數可反映宿主免疫功能,淋巴細胞計數降低被認為是腫瘤預后不良因素,已被證實與多種腫瘤患者的預后不良相關[11-14]。腫瘤相關巨噬細胞來源于單核細胞,是構成腫瘤相關炎癥細胞的重要組成部分,在多種腫瘤細胞的生長、血管生成和轉移中起重要作用[15]。腫瘤相關巨噬細胞通過腫瘤來源的趨化因子招募至腫瘤部位,從而影響外周血單核細胞的數量,故外周血單核細胞計數可作為腫瘤相關巨噬細胞的重要替代標志物[16]。單核細胞分泌的相關細胞因子會增加腫瘤的負荷量,并參與構建有利于MM細胞存活的免疫抑制微環境[17]。因此,LMR 可能代表宿主免疫系統和腫瘤誘導的免疫功能障礙的相對強度,可作為反映基線宿主免疫狀態的免疫生物標志物,用于預測初診MM 患者的預后。研究表明,低LMR 與血液系統惡性腫瘤和多種實體瘤的不良預后相關[18-20]。
本研究證實,低LMR初診MM患者生存期縮短,預后較差,LMR 是初診MM 患者OS 和PFS 的獨立危險因素,該結果與既往研究一致[21-24],提示LMR在預測初診MM 患者的遠期生存方面具有重要的臨床指導價值。Tian 等[25]研究發現,低LMR 的MM患者其血清LDH、肌酐、血鈣和β2 微球蛋白水平較高LMR 患者顯著升高,提示低LMR 患者有更高的基礎腫瘤負荷,但在本研究中,雖然低LMR 組患者的血清LDH、肌酐、血鈣和β2 微球蛋白升高比例均高于高LMR 組,但差異并無統計學意義,這可能與不同研究人群之間的個體差異有關,也可能與所選的不同最佳臨界值有關。
綜上所述,LMR 作為一種易測的免疫生物標志物,初診MM 患者低LMR 則生存期縮短,預后較差,這為臨床醫生對初診MM 患者的預后評估提供新的思路和參考依據。

