白蕓豆中α-淀粉酶抑制劑活性的測定*
張雪嬌,劉春葉,成 昭
(西安醫學院 藥學院,陜西 西安 710021)
α-淀粉酶抑制劑(α-AI)屬于糖苷水解酶,是一種糖苷酶抑制劑,在禾谷類作物和豆類作物的種子中含量較為豐富[1]。近年的研究發現,糖尿病患者長時間的高血糖是導致病人多系統多臟器損害的最主要原因[2-4]。α-AI不但能特異性抑制α-淀粉酶活性,如胃腸道內唾液淀粉酶和胰淀粉酶等,使人體對糖分的吸收受到阻礙或延緩。同時,α-AI還可減少人體內糖向脂肪的轉化,用來防治糖尿病、動脈硬化癥、高血脂、脂肪過多癥及肥胖癥[5],在醫學上有很好的應用發展前景。
1 實驗部分
1.1 試劑與儀器
碘化鉀、碘、磷酸二氫鈉:天津市科密歐化學試劑有限公司;檸檬酸:無錫第二制藥廠;氯化銅:北京市東風化學試劑有限公司;可溶性淀粉:天津市風船化學試劑有限公司;α-淀粉酶:邢臺萬達生物化學試劑有限公司;以上試劑均為分析純;鹽酸:優級純,開封東大化工(集團)有限公司;α-淀粉酶抑制劑:自制,從白蕓豆中提取;實驗用水為蒸餾水。
紫外-可見分光光度計:UV-757,上海尤尼柯有限公司;電子天平:ALC-210.4,賽多利斯科學儀器(北京)有限公司; 離心機:AnkeTGL-16C,上海安亭儀器廠;酸度計:PB-10,德國Accula公司;電熱恒溫水浴鍋:DZKW-6-9,北京市永光明醫療廠。
1.2 實驗方法
1.2.1ρ(淀粉)的確定
配制一定質量濃度的碘溶液、淀粉溶液和碘-淀粉復合物溶液,分別以相應溶劑為試劑空白,測定其吸光度,確定碘-淀粉復合物的最大吸收波長。
淀粉溶液:精密稱取一定量烘干之后的可溶性淀粉,以緩沖溶液為溶劑配制ρ(淀粉)=0.001~0.008 g/mL溶液。碘液:參考文獻[8],精密稱取一定質量的碘化鉀和碘,以蒸餾水為溶劑配制而成。緩沖溶液:在pH 計調控下,用0.2 mol/L的磷酸氫二鈉溶液和0.1 mol/L的檸檬酸溶液配制pH =6.5的緩沖溶液。酶解反應終止液:參考文獻[8]中的配制方法,精密稱取一定質量的氯化銅和一定體積的質量分數37% 鹽酸,用蒸餾水稀釋配制而成。
上述淀粉溶液分別移取5.00 mL置于8只比色管中,t=37 ℃水浴鍋中恒溫10 min,依次加入同樣在37 ℃水浴鍋中恒溫10 min的緩沖溶液和反應終止液各1.00 mL,搖勻,放至室溫后,精確移取0.20 mL混合溶液于干燥試管中,再分別加入7.00 mL的碘液,充分混勻后在最大吸收波長處測定吸光度,根據不同質量濃度淀粉水解后吸光度的值確定實驗所需淀粉的最佳質量濃度。
1.2.2 α-淀粉酶加入量的確定
為了考察α-AI對α-淀粉酶活性的抑制作用,實驗中根據等量α-淀粉酶在不等量α-AI 的作用下對等量淀粉的水解促進作用不同,借助碘比色法確定不同條件下吸光度的變化,進而確定α-AI對α-淀粉酶活性的抑制效果。根據前期的實驗結果[9],考慮到吸光度測量值和計算結果的準確性,實驗采用5.00 mLρ(淀粉)=0.008 g/mL溶液、1.00 mLρ(α-淀粉酶)=0.03 mg/mL溶液。
1.2.3 α-AI抑制活性的測定
α-AI的制備:參考文獻[10]中的方法,稱取適量的白蕓豆干燥粉末于蒸餾燒瓶中,加入去離子水,調整 pH 值和溫度后浸提一段時間,離心、過濾上清液得 α-AI 粗提液。粗提液在酸性條件下進行沉降,取上清液用堿中和后通過醇沉法得到初步純化的 α-AI。最后經超濾、透析及濃縮凍干后得到純化的 α-AI。
樣品管:在一系列試管中分別加入1.00 mLρ(α-淀粉酶)=0.03 mg/mL溶液,再分別加入1.00、2.00、3.00、4.00、5.00、6.00 mLρ(α-AI)=0.03 mg/mL溶液,用緩沖溶液定容至10.00 mL,搖勻后各取1.00 mL置于編號為1~6的樣品管中;標準管 1:用緩沖溶液代替 α-淀粉酶溶液和α-AI,其他條件同上;標準管2:用緩沖溶液代替α-AI,其他條件同上。將所有試管置于37 ℃ 水浴加熱2 min,依次加入同溫度預熱的5.00 mLρ(淀粉)=0.008 g/mL溶液,立即混勻。37 ℃準確反應10 min,立即加入1.00 mL的終止液。搖勻后冷卻至室溫,參考1.2.1方法取樣與碘液充分顯色,在最大吸收處測定其吸光度,根據樣品管、標準管1及標準管2的吸光度值確定α-AI 對α-淀粉酶的活性抑制率。
α-AI對α-淀粉酶的活性抑制率參照文獻[11]的方法,計算方法見公式(1)。
(1)
式中:As、Ab1、Ab2分別為樣品管、標準管1和標準管2的吸光度值。
1.2.4 方法學考察
對實驗中所建立起來的關于 α-AI抑制 α-淀粉酶活性的測定方法進行方法學考察。穩定性實驗:隨機抽取3號樣為檢測對象,在上述實驗條件下測定其吸光度,間隔10 min測定1次,連續測定6次,根據測定結果計算RSD值。精密度實驗:以3號樣為檢測對象,同時配制6份3號樣品溶液,在上述實驗條件下測定其吸光度,根據6次的測定結果計算RSD值。重現性實驗:以3號樣為檢測對象,每天配制1份3號樣品溶液,在上述實驗條件下測定其吸光度,連續測定6次,根據測定結果計算RSD值。
2 結果與討論
2.1 ρ(淀粉)的測定
碘溶液、淀粉溶液和碘-淀粉絡合物溶液在可見光區的掃描結果見圖1。
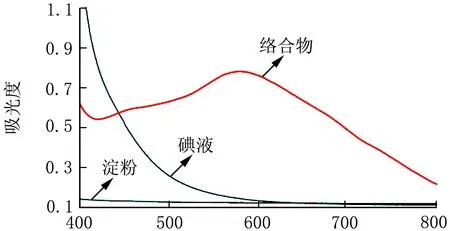
λ/nm圖1 碘-淀粉絡合物的紫外可見吸收曲線
由圖1可知,碘-淀粉絡合物在580 nm處產生明顯的特征吸收。所以選擇580 nm作為測定波長。
按照1.2.1方法進行操作,以ρ(淀粉)為橫坐標,以吸光度為縱坐標,進行線性擬合,見圖2。
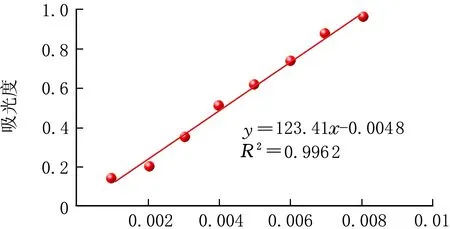
ρ(淀粉)/(g·mL-1)圖2 ρ(淀粉)與吸光度的關系
由圖2可知,碘與淀粉絡合后在580 nm處產生特征吸收,并且在一定質量濃度范圍內,該特征吸收與ρ(淀粉)呈正相關性,該法可用于測定淀粉含量。
2.2 α-AI抑制活性的測定
2.2.1 α-AI抑制活性的測定
按照1.2.3方法進行操作,并按照公式(1)計算α-AI對α-淀粉酶的活性抑制率,將α-AI的加入量與α-AI的抑制活性進行線性擬合,見圖3。
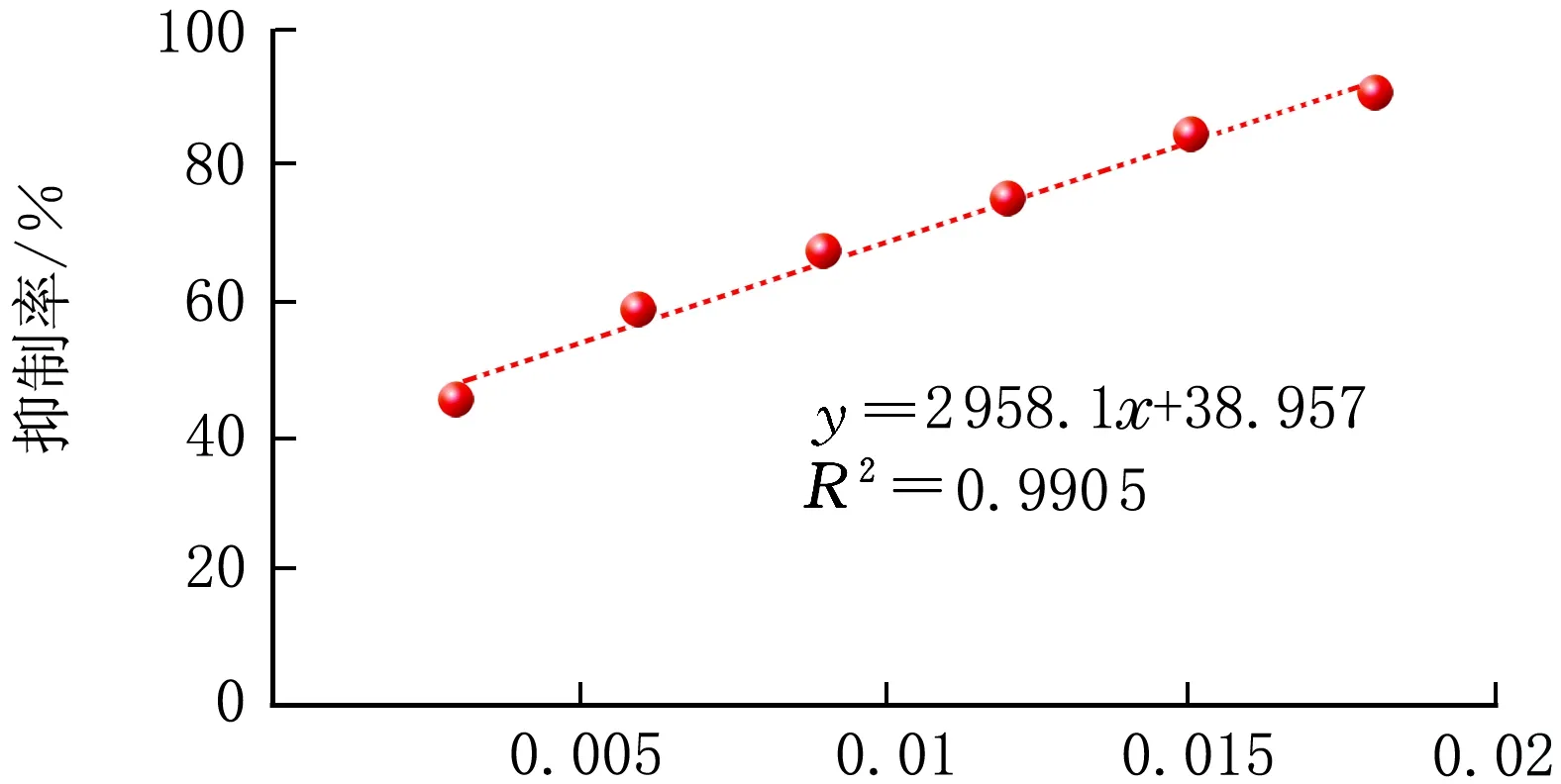
ρ(α-AI)/(mg·mL-1)圖3 ρ(α-AI)對抑制率的變化曲線
由圖3可知,ρ(α-AI)=0.003~0.018 mg/mL,對α-淀粉酶的活性抑制作用與ρ(α-AI)呈正相關性,可以利用碘與淀粉的顯色反應對α-AI的抑制活性進行測定。
2.2.2 方法學考察
按照1.2.4方法隨機抽取3號樣為檢測對象,分別對實驗結果的穩定性、精密度及重現性進行考察,結果見表1。
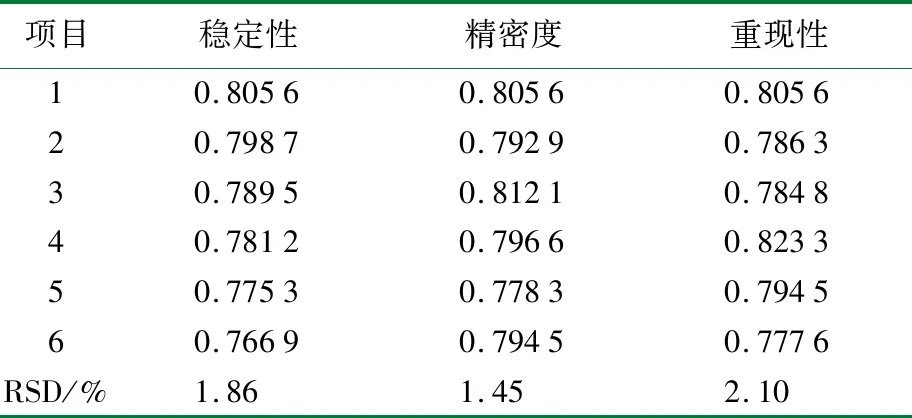
表1 測定結果的穩定性、精密度和重現性 n=6
由表1可知,采用碘比色法測定α-AI抑制活性,t<1 h,RSD=1.86%,穩定性良好。精密度和重現性實驗結果的RSD值分別為1.45%和2.10%,均小于5%。說明采用實驗方法對α-AI抑制活性進行測定,結果準確,方法可靠。
3 結 論
(1)碘比色法測定α-AI對α-淀粉酶抑制率,實驗條件為在pH =6.5的緩沖體系中,等量淀粉和等量淀粉酶的混合溶液中加入不等量α-AI,顯色后根據其在580 nm處的測定結果計算α-AI對α-淀粉酶的活性抑制率,ρ(α-AI)=0.003~0.018 mg/mL,α-AI對α-淀粉酶的抑制率與ρ(α-AI)呈正相關性,線性相關系數r2=0.990 5。
(2)穩定性、精密度及重現性的實驗結果表明,該實驗方法在1h內穩定性良好,精密度和重現性的RSD值也均小于5%,說明結果準確可靠。
(3)實驗條件易于控制、操作簡單,為α-AI抑制α-淀粉酶活性強弱的研究提供可借鑒的參考依據。