BMP2重組慢病毒轉染兔BMSCs后細胞礦化的實驗研究
寧寅寬,劉林志,陳賢平
目前在組織工程研究領域,骨髓間充質干細胞(bone mesenchymal stem cells,BMSCs)是比較理想的種子細胞之一,骨形態發生蛋白(bone morphogenic proteins,BMP)已被證實能調控BMSCs 向成骨方向分化,BMP2 是目前研究最為廣泛、誘導成骨活性最強的BMP[1-2]。天然BMP2 在體內無法實現緩釋,不能持續誘導BMSCs 的成骨分化,如何獲得持續、高效及穩定表達的內源性BMP2是目前研究的熱點[3]。細胞礦化與普通的地質礦化的最大區別是無機相結晶嚴格受生物體分泌的有機質控制,骨骼中的羥基磷灰石形成作為細胞礦化最普遍的表現形式,亦受到廣泛關注[4-5]。既往學者們缺乏對BMSCs 生物礦化現象的深入研究。本研究通過將BMP2重組慢病毒載體導入兔BMSCs,觀察BMP2 重組慢病毒轉染細胞向成骨方向分化后細胞礦化的能力,初步嘗試使用掃描電鏡能譜分析技術研究BMSCs 生物礦化現象,為干細胞基因治療和臨床轉化提供理論依據。
1 材料與方法
1.1 試劑與儀器 低糖DMEM、胰蛋白酶、胎牛血清(美國HyClone 公司);流式一抗小鼠抗兔CD44、CD45、CD29(美國Antigenix公司),同型對照小鼠抗兔IgG1(eBioscien公司),流式二抗PerCP 標記(Jackson 公司);BMP2 單克隆抗體(美國Bioworld 公司),山羊抗小鼠IgG/辣根過氧化物酶標記、DAB顯色試劑盒、二抗FITC 標記IgG(北京中杉金橋公司),Ⅰ型膠原單克隆抗體(武漢博士德),茜素紅(美國Sigma);堿性磷酸酶(ALP)測試盒(南京建成生物工程研究所),總RNA提取試劑盒(北京天根生化科技有限公司),HiFi-MMLV 逆轉錄cDNA 合成試劑盒(上海英俊生物技術有限公司),2×Es Taq MasterMix PCR 試劑盒(北京康為世紀生物技術公司),DNA Marker、2×Tap PCR Mix(北京艾德萊生物科技有限公司),倒置熒光顯微鏡(日本Olympus公司),場發射掃描電鏡(荷蘭飛利浦公司),X 射線能譜分析儀(英國牛津公司),BMP2 重組慢病毒構建和鑒定(上海吉凱基因化學技術有限公司)。
1.2 方法
1.2.1 兔BMSCs 的獲取及鑒定 清潔級雄性6 月齡新西蘭大白兔1 只,體質量1.2 kg,購自桂林醫學院動物實驗中心,實驗動物生產許可證號:SCXK(桂)2013-0001,按照實驗動物倫理學標準執行。采用密度梯度離心及貼壁培養法獲取第5代兔BMSCs,無菌條件下穿刺兔雙側股骨干骺端,獲取骨髓約5 mL,離心后棄上清液(1 500 r/min,5 min),用比重為1.073 g/mL 的percoll 分離(2 500 r/min,20 min)兔BMSCs,取界面處細胞層,離心后洗滌,以2×105個/cm2的密度接種于25 cm2塑料培養瓶,72 h后更換培養液,棄掉未貼壁細胞,以后每1 d 更換細胞培養液1 次。細胞生長到80%匯合時1∶2傳代培養,傳至第5 代進行后續實驗研究。取第5 代細胞制成細胞懸液,按操作說明分別標記CD44/CD45、CD29-PerCP,流式細胞儀上機檢測,實驗重復3次。
1.2.2 兔BMSCs的分組及轉染 實驗分為3組:空白對照組(未轉染);Lv-EGFP組[陰性對照組,轉染僅攜帶增強綠色熒光蛋白(enhanced green fluorescent protein,EGFP)基因的慢病毒);Lv-BMP2/EGFP 組(實驗組,轉染攜帶BMP2 和EGFP 基因的慢病毒)。第5代兔BMSCs以5×104個/孔接種于6孔板,細胞培養匯合至80%左右,根據前期實驗數據以感染復數(MOI=100)轉染細胞,轉染24 h后換液,48 h后在倒置熒光顯微鏡下觀察細胞形態并計算細胞轉染效率(綠色熒光蛋白細胞數/視野內細胞總數×100%),實驗重復3次。
1.2.3 免疫組織化學染色檢測BMP2表達 分別隨機取轉染72 h后細胞,胰酶消化細胞爬片,浸入40 g/L多聚甲醛,按SP免疫組織化學染色法操作,DAB 顯色,封固,在倒置顯微鏡觀察。
1.2.4 RT-PCR 檢測BMP2 基因的表達 轉染后72 h 提取3×106個細胞總RNA,根據RNA 提取試劑盒操作步驟,通過凝膠電泳進行質量檢測,使用分光光度計進行純度濃度測定。按照MMLV逆轉錄cDNA合成試劑盒說明書合成第1條鏈cDNA。設計引物:GAPDH 引物(正義鏈5'-CCAGAA?CATCCCTGCCTC-3' ,反 義 鏈5'-TAGCCAAATTCGTTGT?CATACCA-3'),BMP2 引物(正義鏈5'-ACTACCAGAAAC?GAGTGGGAA-3',反義鏈5'-GCATCTGTTCGGAAAACCT-3')。按照2×Taq PCR MasterMix 試劑盒說明書進行PCR 擴增。PCR產物通過瓊脂糖凝膠電泳鑒定,調電泳儀各參數進行電泳(U:220 V;I:140 mA;T:30 min),電泳結束,凝膠成像系統分析目的基因與對應內參光密度比值確定基因相對表達量,相對表達量=目的基因條帶OD 值/對應內參照基因條帶OD 值。反應條件:95 ℃預變性10 min,94 ℃變性30 s,60 ℃退火30 s,72 ℃延伸30 s,進行35 個循環,72 ℃終延伸5 min。測量結果重復3次。
1.2.5 Western blot 檢測BMP2 蛋白表達 轉染后48 h,根據實驗分組分別取2×106個細胞,裂解液提取細胞總蛋白,按BCA 蛋白定量試劑盒檢測樣品蛋白含量。取30 μg 上樣,10%SDS-PAGE 電泳后轉模,5%脫脂奶粉4 ℃封閉過夜,加一抗BMP2 單克隆抗體室溫下搖床震蕩孵育1 h,與辣根過氧化物酶標記二抗孵育1 h 進行抗體雜交,ECL 發光孵育1 min,曝光5 min,暗室內壓片,顯影定影,凝膠成像儀對蛋白印跡進行成像,以內參光密度值為標準,計算每組蛋白相對表達量,測量結果重復3次。
1.2.6 兔BMSCs的成骨分化檢測 6孔板內預先放置消毒好的塑料蓋玻片,按實驗分組,以1×105個/孔接種6孔板進行塑料細胞爬片培養。分別于第14、21天,隨機取爬片,按試劑盒說明書,行SP法檢測Ⅰ型膠原蛋白表達、茜素紅染色檢測礦化結節形成。分別于第7、14、21天,各組隨機取3孔,按ALP試劑盒說明操作,實驗重復3次,計算ALP含量。
1.2.7 掃描電鏡和能譜分析觀測礦化結節表面微觀形貌及其元素構成 第21天隨機取實驗組塑料細胞爬片,固定后梯度丙酮逐級脫水,臨界點干燥,表面進行噴鍍,在Quanta 200 FEG場發射環境行掃描電鏡觀察和主要元素能譜分析。X射線能譜分析儀測定微區主要元素(碳、氮、氧、鈣、硫、磷)的質量百分比和原子個數百分比,測定結果重復3次。計算鈣磷比(Ca/P)=鈣元素質量百分比∶磷元素質量百分比,并打印出能譜分析圖。
1.3 統計學方法 采用SPSS 25.0軟件進行數據分析。計量資料以±s表示,多組之間比較采用單因素方差分析,組間多重比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
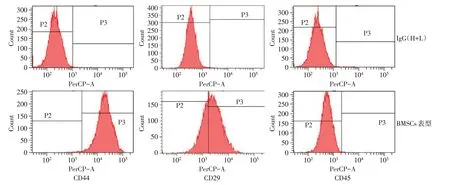
Fig.1 The characteristics of cell surface markers in BMSCs圖1 BMSCs細胞表面標志物表達特征
2 結果
2.1 BMSCs 細胞表面標志物表達特征 流式細胞儀分析顯示第5 代兔BMSCs 的CD44、CD29 表達呈陽性,CD45 表達呈陰性,CD44、CD29、CD45 陽性細胞分別占92.20%±1.12%,76.30%±0.78%,0.26%±0.11%,BMSCs 的細胞表面標志物符合BMSCs 的特征,見圖1。
2.2 BMSCs 轉染后細胞形態 轉染48 h 后,Lv-BMP2/EGFP組、Lv-EGFP 組細胞在倒置熒光顯微鏡下觀察到熒光,目的基因BMP2和EGFP報告基因成功修飾入細胞基因組,轉染效率分別為95.32%±1.05%和95.18%±0.82%。空白對照組未觀察到熒光。各組BMSCs 細胞生長呈長梭形,形態均一,單個細胞輪廓較清楚,胞漿豐富,核仁明顯,細胞呈渦旋狀、放射狀密集排列,見圖2。
2.3 BMP2 免疫組織化學染色 Lv-BMP2/EGFP 組BMSCs 細胞胞漿呈陽性表達,可見棕黃色染色,而Lv-EGFP組及空白對照組細胞呈陰性,見圖3。
2.4 BMP2 mRNA 表達情況 Lv-BMP2/EGFP 組、Lv-EGFP 組及空白對照組BMP2 mRNA 相對表達量分別為0.474±0.008,0.126±0.027 和0.095±0.007(n=3,F=458.641,P<0.01),Lv-BMP2/EGFP 組BMP2 mRNA 水平高于Lv-EGFP 組及空白對照組(P<0.05),且基因條帶結果符合擴增片段長度,見圖4。
2.5 BMP2 蛋白表達情況 Lv-BMP2/EGFP 組、Lv-EGFP 組及空白對照組BMP2 蛋白相對表達量分別為0.751±0.057,0.272±0.013,0.305±0.007(n=3,F=186.426,P<0.01),Lv-BMP2/EGFP 組BMP2 蛋白表達量高于Lv-EGFP 組及空白對照組(P<0.05),見圖5。
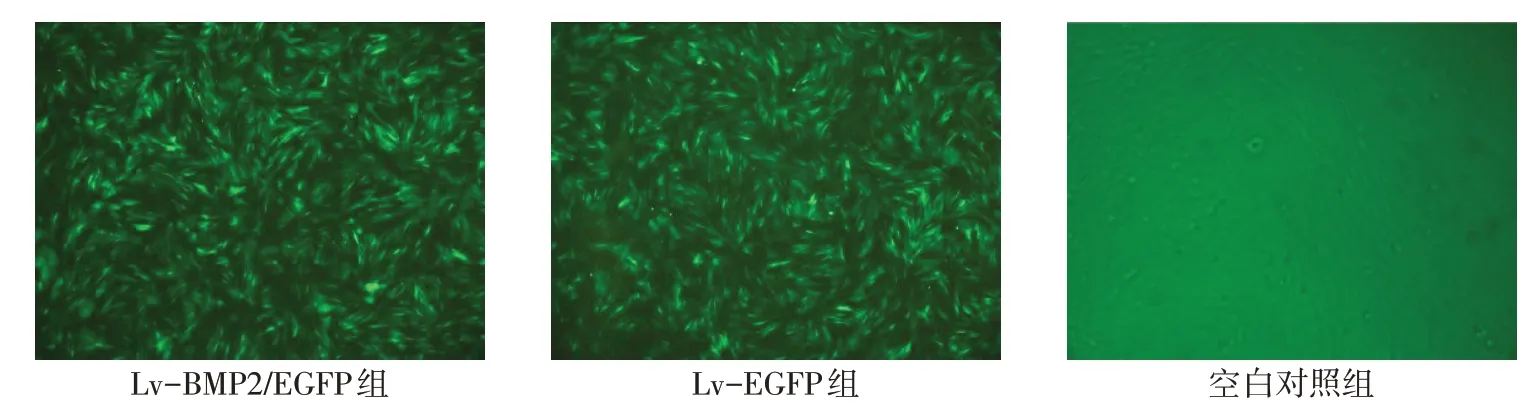
Fig.2 The cell morphology of BMSCs under fluorescence microscope(×100)圖2 BMSCs在倒置熒光顯微鏡下細胞形態(×100)
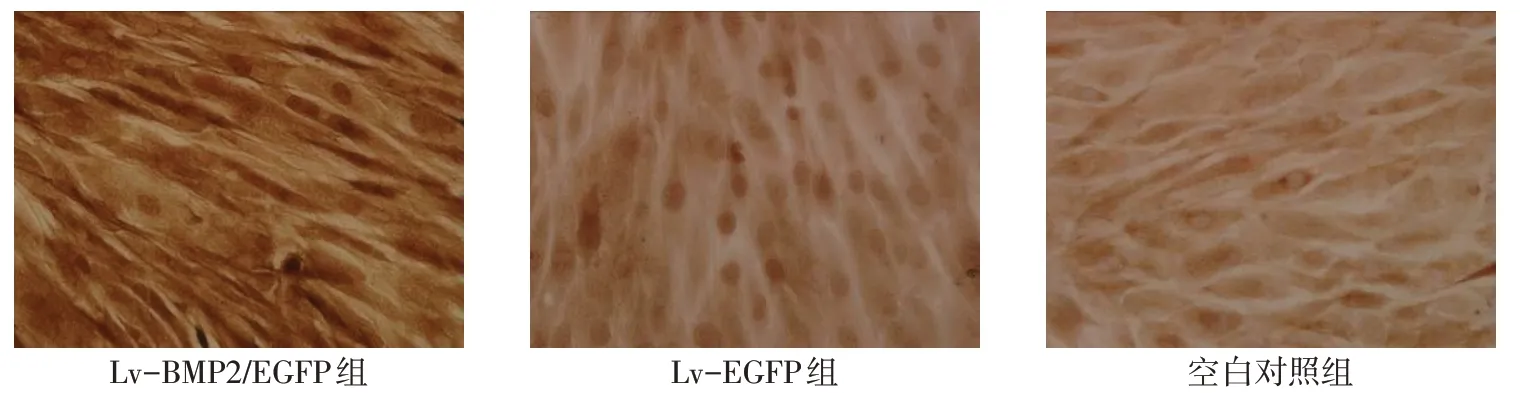
Fig.3 The SP immunochemical staining of BMP2 expression(DAB stanining,×200)圖3 免疫組織化學染色SP法檢測BMP2表達(DAB染色,×200)
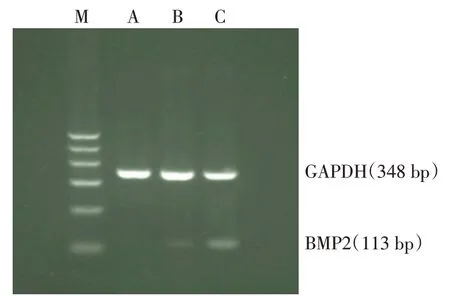
Fig.4 The BMP2 gene expression in BMSCs measured by RT-PCR圖4 RT-PCR檢測BMSCs中BMP2基因表達水平

Fig.5 The protein expression of BMP2 measured by Western blot assay圖5 Western blot檢測BMP2蛋白表達
2.6 BMSCs的成骨方向分化 Lv-BMP2/EGFP組第14 天塑料細胞爬片在顯微鏡下觀察顯示細胞胞漿出現棕黃色染色顆粒,Ⅰ型膠原SP法免疫組織化學染色呈陽性表達。第21天茜素紅染色呈現陽性,見形貌各不相同的礦化結節,礦化結節染色后呈現紅色。而Lv-EGFP 組及空白對照組Ⅰ型膠原染色和茜素紅礦化結節染色均呈現陰性。見圖6、7。細胞經轉染第7、14、21天,Lv-BMP2/EGFP組ALP水平較Lv-EGFP組及空白對照組升高,見表1。

Fig.6 The I collagen immunohistochemical staining of BMSCs(×100)圖6 BMSCsⅠ型膠原免疫組織化學染色(×100)
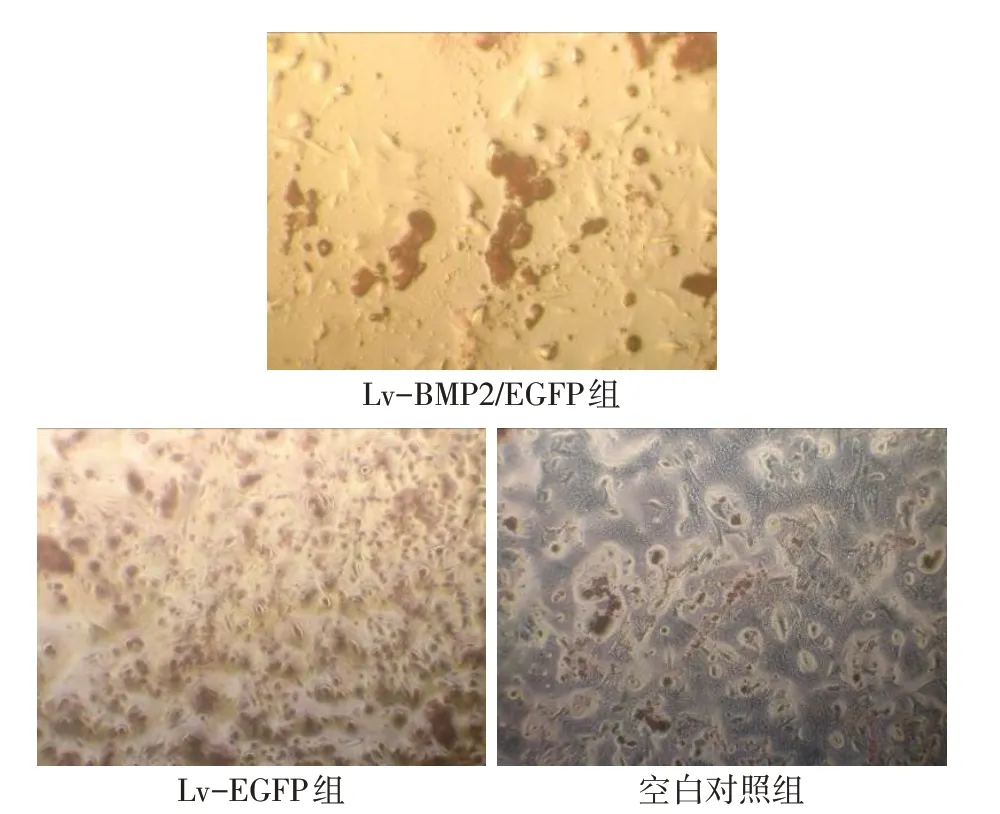
Fig.7 The alizarin red S staining of BMSCs(×50)圖7 BMSCs茜素紅染色(×50)
Tab.1 Comparison of ALP levels at different time points between the three groups表1 各組不同時間點ALP水平比較(n=9,U/gprot,±s)

Tab.1 Comparison of ALP levels at different time points between the three groups表1 各組不同時間點ALP水平比較(n=9,U/gprot,±s)
**P<0.01;a與空白對照組比較,b與Lv-EGFP組比較,P<0.05。
組別空白對照組Lv-EGFP組Lv-BMP2/EGFP組F第7天2.88±0.57 2.76±0.50 6.76±0.91ab 98.659**第14天4.99±0.47 4.76±0.50 16.42±2.22ab 222.143**第21天5.76±0.50 5.71±0.44 24.39±2.54ab 452.715**
2.7 礦化結節觀察和元素能譜分析 在掃描電鏡下可見礦化結節相互連接成片狀,細胞重疊生長,基質分泌旺盛,礦化結節散布在重疊細胞中并稍凸出于細胞層之上,形貌似含沙漿較多的水泥,結構呈現疏松、粗糙特點,見圖8。電鏡掃描微區得出能譜分析圖譜,見圖9,對應主要元素見表2。礦化結節微區Ca/P為1.52±0.13。
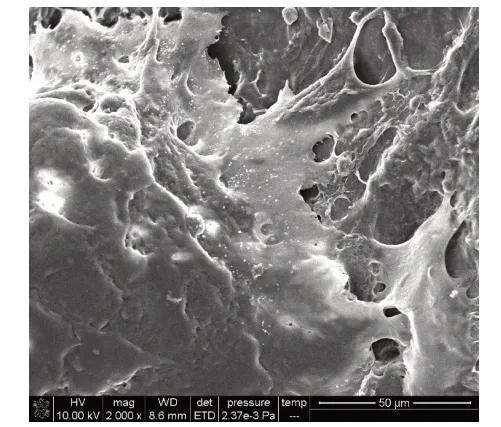
Fig.8 The microscopic morphology of the mineralized nodule surface observed by SEM圖8 掃描電鏡觀察礦化結節表面微觀形貌
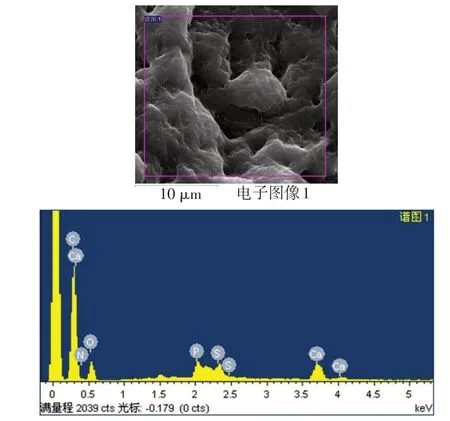
Fig.9 The energy spectrum analysis of the scanned area on the surface of the mineralized nodule圖9 礦化結節表面掃描區域能譜分析圖
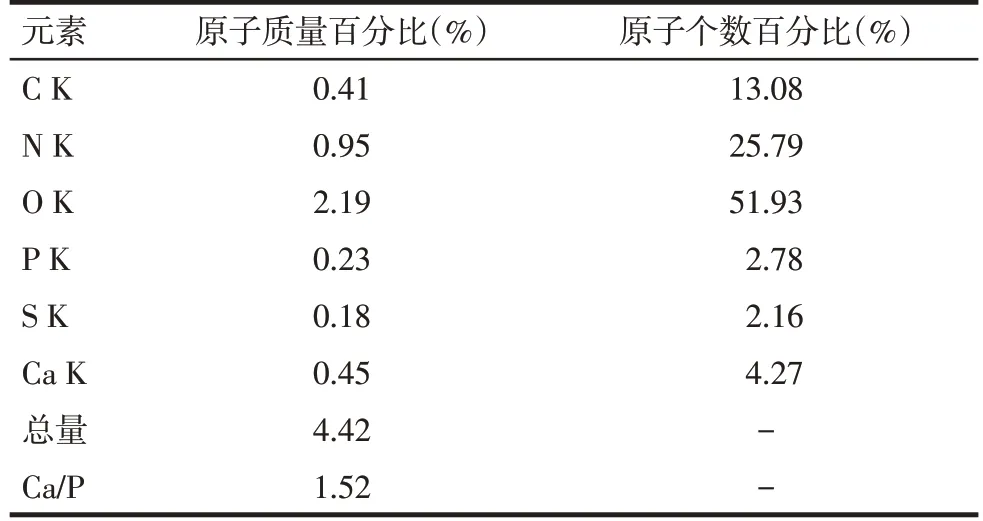
Tab.2 The elemental analysis of the scanned area on the surface of the mineralized nodule表2 礦化結節表面掃描區域元素分析
3 討論
BMSC 由于其能較穩定地保持干細胞生物學特征,為多種病毒載體導入目的基因進行基因治療奠定了基礎[6]。BMP2 已被證實能單獨誘導BMSCs 向成骨方向分化,但天然BMP2 獲取困難,價格昂貴,且局部發揮生物作用有限,因此利用病毒載體導入目的基因,持續穩定的表達功能蛋白是解決該問題的有效方法[7]。現有研究發現,腺病毒載體系統在導入目的基因后會因病毒載體導入時間的持續延長,出現外源基因丟失的現象,從而降低了目的基因表達效果[8]。慢病毒載體系統彌補了該缺陷,在目的基因表達持續時間上更具有優勢。Milone 等[9-10]研究發現慢病毒可高效感染分裂中的BMSCs,成功把攜帶的目的基因導入細胞,使目的基因在細胞中持續、穩定、高效表達,從而進行基因治療。本課題組前期研究也表明慢病毒載體系統介導的BMP2基因相對于腺病毒載體系統,在表達持續時間上更具有優越性[11]。本研究以慢病毒為載體系統,通過基因轉染技術,將攜帶BMP2基因和EGFP基因載體整合進入BMSCs 中,使其在細胞內能夠持續穩定地表達。EGFP作為一種示蹤標記的報告基因,其成功表達不僅示蹤標記了攜帶BMP2 基因細胞的準確位置,還可直接體現出細胞的轉染效率[12]。本研究通過檢測BMP2 mRNA和蛋白的表達,證實了BMP2重組慢病毒載體轉染BMSCs 并誘導細胞成骨方向分化的可行性。
目前,病毒的轉染和BMSCs 成骨分化及其觀察的相關技術在國內外已較為成熟,現被普遍認可的主要有ALP、Ⅰ型膠原蛋白、成骨特異性蛋白(骨形態生發蛋白、骨橋蛋白等)、相關成骨分化調控因子(骨鈣素泌量、成骨轉錄因子等)為成骨早期的標志物,而礦化結節形成可作為成骨晚期的標志物[13-14]。本研究通過檢測骨化標志性產物ALP、Ⅰ型膠原及礦化結節驗證BMSCs 的成骨分化能力,但這些生物化學檢測方法只能間接反映細胞的成骨方向分化。因此,本研究同時利用掃描電鏡和能譜分析技術,直接對細胞成骨分化晚期的礦化結節進行觀察,對其鈣、磷等元素含量進行測定,結果顯示礦化結節微區Ca/P為1.52±0.13,接近羥基磷灰石的鈣磷比1.67,說明礦化結節表面有鈣、磷沉積物產生,可能為磷酸鈣鹽。而硫、氮、氧、碳元素為有機物主要元素,可能為細胞基質產生的細胞膠原成分及細胞蛋白復合物的有機成分。
BMSCs向成骨分化后的細胞礦化是其主導骨形成的前提與基礎[4]。在細胞礦化過程中,其最基本的生物學特征是骨基質合成、分泌及成熟,而礦化結節是成骨細胞分化的成熟標志,同時也是成骨細胞行使成骨功能的主要形態學表現[15]。細胞礦化的表現是細胞外基質的礦化及無機鈣、磷鹽的沉積,在整個BMSCs 礦化結節形成過程中,細胞和基質起著非常重要的作用[16]。本研究在電鏡下觀察發現BMSCs成骨分化晚期,細胞會重疊生長,分泌大量細胞基質,礦化結節則凸出于細胞層之上,出現磷酸鈣鹽堆積,結構呈現疏松、粗糙,說明BMSCs 成骨分化后細胞和細胞基質在細胞礦化過程中發揮重要作用。發生細胞礦化的細胞通過大量分泌細胞基質,被自身大量分泌的細胞基質包裹圍繞,從而使局部細胞基質濃縮集中成沉淀的磷酸鈣鹽離子,使磷酸鈣鹽離子結晶導致礦化結節形成。其形成機制可能為礦化后的BMSCs 細胞內高表達ALP,從而促進細胞基質的礦化,且其分泌的Ⅰ型膠原蛋白是構成礦化結節的蛋白支架,Ⅰ型膠原蛋白支架與鈣、磷無機鹽親和,形成磷酸鈣鹽礦化結節。BMSCs 發生細胞礦化的分子調控機制可能是由于細胞礦化過程中編碼細胞外基質成熟的基因表達增加,而與細胞增殖相關的基因表達下降,且與細胞內ALP活性、骨鈣素合成及細胞外基質促進羥基磷灰石沉積的基因表達相關[17]。BMSCs成骨方向分化后的礦化過程實質上為鈣、磷無機鹽在細胞基質內沉積的過程,整個礦化過程始終伴隨著鈣、磷等元素的動態變化[18]。
綜上所述,BMP2重組慢病毒轉染兔BMSCs 后,BMP2基因整合入細胞基因組中,高效表達BMP2功能蛋白,誘導細胞向成骨方向分化并發生細胞礦化,在細胞礦化過程中通過細胞基質對無機鹽離子的濃集、沉淀,最終形成無機磷酸鈣鹽的礦化結節,其鈣磷比值非常接近人和動脈骨骼中的主要無機磷酸鈣鹽羥基磷灰石的成分比值,說明其存在一定聯系,需要后續深入研究。

