蘆薈大黃素通過激活Caspase-3/GSDME焦亡通路發揮抗膠質瘤作用
方興剛,汪嫚,陳卓,張思思,羅杰*(. 湖北中醫藥大學中醫臨床學院,武漢 40065;. 胚胎干細胞研究湖北省重點實驗室,湖北醫藥學附屬太和醫院,湖北 十堰 44000;. 湖北醫藥學院藥護學院,湖北 十堰 44000)
神經膠質細胞瘤,簡稱膠質瘤,是顱內最常見的惡性腫瘤,約占全部顱內惡性腫瘤的 80%[1]。其中膠質母細胞瘤(glioblastoma,GBM)為第Ⅳ級膠質瘤,約占膠質瘤總數的54%,具有高發病率、高復發率、高病死率和低治愈率的特點[1]。GBM的浸潤性生長方式決定其惡性生物學行為,手術難以完全切除。由于血腦屏障(bloodbrain barrier,BBB)以及腦-腫瘤細胞屏障(brain tumor cell barrier,BTB)的存在以及化療抗性,化療的療效也不盡理想[2-5],且因GBM免疫抑制的微環境,目前蓬勃發展的PD-1等免疫檢查點抑制劑效果欠佳[6-8]。因此,從治療的角度來看,需要其他治療途徑和治療靶點來改善預后。
焦亡是由GSDM家族(GSDMs)介導的具有免疫原性的程序性的細胞死亡,在活化的Caspase家族及顆粒酶B的作用下,GSDMs被活化,釋放具有細胞膜成孔功能的N端結構域,誘導細胞內外滲透壓失衡,導致細胞腫脹、死亡[9]。由于GSDME途徑的焦亡會誘導乳酸脫氫酶(LDH)和HMGB1細胞外釋放而和適應性免疫相聯系,在抗腫瘤治療中日益受到重視。GSDME途徑的焦亡依賴于GSDME在組織中的表達水平,TCGA數據庫(http://ualcan.path.uab.edu/analysis.html)顯示,GBM特異性高表達GSDME,故我們認為GSDME是抗GBM治療的良好靶點。而激活GBM高表達的GSDME,促進GSDME途徑的焦亡進而激活適應性免疫,可能為GBM治療提供新的策略。
蘆薈大黃素(aloe-emodin,AE)是一種蒽醌衍生物,是從大黃、虎杖、何首烏、蘆薈、決明子等傳統中藥中提取的有效成分,具有較好的血腦屏障通透性。近年來,AE已被證明具有廣泛的藥理作用,如抗病毒、抗菌、抗過敏、抗骨質疏松、抗糖尿病、免疫抑制、神經保護和肝保護活性以及抗腫瘤作用[10]。既往研究顯示AE通過多種機制作用于腫瘤細胞,如誘導DNA損傷[11],阻滯細胞周期[12-14],抑制腫瘤細胞遷徙[15]。AE可以通過誘導線粒體功能障礙及激活Caspase-9/3/GSDME軸誘導Hela細胞焦亡,顯示AE具有誘導腫瘤細胞焦亡的潛力[16]。本研究以AE作為候選藥物,應用于GSDME特異性高表達的GBM細胞(U87MG、GL261),以明確AE對GBM細胞的抑制作用及焦亡誘導作用。目前,AE通過激活CASP3/GSDME通路促進GBM細胞焦亡發揮抗膠質瘤作用的研究尚未見任何報道。本研究可能為臨床膠質瘤的治療提供一種新的選擇。
1 材料和方法
1.1 細胞株與試藥
U87MG、GL261細胞均來源于本實驗室(胚胎干細胞湖北省重點實驗室,凍存細胞);蘆薈大黃素(規格:100 mg,純度:98%,成都埃法生物科技有限公司,結構式見圖1);重組Anti-Cleaved Caspase-3抗體、重組Anti-DFNA5/GSDME抗體[EPR19859]-N-terminal、重組Anti-cleavedN-terminal GSDMD抗體(Abcam公司);ABScriptⅡReverse Transcriptase(ABclonal);蛋白酶和磷酸酶抑制劑混合液、高敏ECL化學發光試劑盒(新賽美);MTT細胞增殖及細胞毒性檢測試劑盒、2×PCR Master Mix、SDSPAGE凝膠配制試劑盒、LDH釋放檢測試劑盒、β-Tubulin Rabbit Monoclonal Antibody、辣根過氧化物酶標記山羊抗兔IgG(H+L)、FITC標記山羊抗兔IgG(H+L)、順鉑(Cisplatin)、NAC、Caspase抑制劑Z-VAD-FMK(碧云天);PageRuler 預染蛋白Marker(賽默飛);DCFHDA 活性氧(ROS)熒光探針細胞檢測試劑盒(索萊寶);Taq-HS Probe qPCR Premix、線粒體膜電位檢測試劑盒(JC-1)(蘭博利德)。
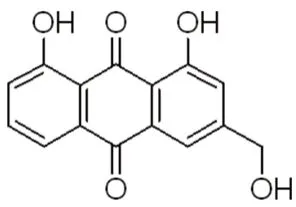
圖1 蘆薈大黃素分子結構式Fig 1 Molecular formula of aloe-emodin
1.2 儀器
生物安全柜、CO2恒溫培養箱、多功能酶標儀(美國Thermo Fisher 公司);倒置顯微鏡(德國Leica 公司);超速低溫離心機(德國Eppendorf公司);熒光定量PCR儀(美國BIO-RAD公司);流式細胞分析儀(美國Beckman公司)。
2 方法和結果
2.1 AE對GBM細胞活力的影響
選擇GBM細胞系U87MG(人)、GL261(鼠)作為實驗對象,以濃度梯度的AE作用于膠質瘤細胞系48 h,MTT實驗檢測細胞存活率:復蘇U87MG、GL261細胞,傳代至96孔板中,預設每個梯度濃度5孔重復,每孔4000個/100 μL,12 h后給予包含梯度濃度(6.25、12.5、25、50、75、100 μmol·L-1)AE的培養基共培養,其中0.2%DMSO作為對照組(Con),48 h后每孔加入10 μL MTT 液(5 mg·mL-1)避光孵育 4 h,離心,棄上清液,每孔加入100 μL Formazan(甲瓚)溶解液,適當混勻,在細胞培養箱內再繼續孵育3 h。光學顯微鏡下觀察發現甲瓚全部溶解。用酶標儀于 490 nm波長處測量各孔的光密度(OD)并計算細胞增殖抑制率,使用Graphpad軟件統計細胞存活率。結果顯示:AE以濃度依賴的方式抑制U87MG(見圖 2A)及GL261(見圖2B)的活性,其對U87MG細胞的半抑制濃度(IC50)為24.76 μmol·L-1,對GL261細胞的IC50為43.38μmol·L-1,提示AE對膠質瘤細胞有明確的抑制作用。
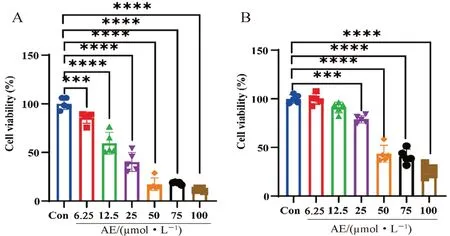
圖2 AE對U87MG細胞(A)和GL261細胞(B)活性的影響( ±s,n=5)Fig 2 Effect of AE on the viability of U87MG cell(A)and GL261 cell(B)detected( ±s,n=5)
2.2 AE對GBM細胞焦亡的影響
為明確AE對GBM細胞的作用方式,對AE處理的U87MG、GL261細胞在倒置顯微鏡下進行形態學動態觀察:U87MG、GL261細胞鋪至24孔板中,每孔4000個/100 μL,細胞貼壁后給予50μmol·L-1的AE共孵育,分別于2、6、12、24、36、48、60 h時間點進行細胞拍照,記錄細胞形態。60 h后AE處理的U87MG及GL261(見圖 3)細胞出現細胞腫脹、吐泡等焦亡特異性細胞外觀(藍色箭頭標識),提示AE可以促進膠質瘤細胞焦亡。
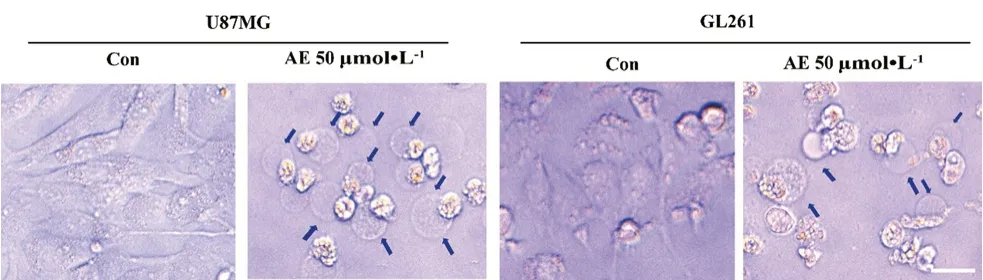
圖3 AE處理的U87MG和GL261細胞外觀(藍色箭頭指向焦亡細胞,比例尺:×200)Fig 3 Appearance of U87MG and GL261 cells treat with AE(The blue arrows pointed to pyroptosis cells,scale bar:×200)
焦亡的另一特征是細胞膜成孔,細胞內容物如LDH從細胞內釋放,為此我們開展了LDH釋放實驗。U87MG細胞鋪至96孔板中,每孔4000 個/100μL,待其密度生長至90%左右,加入梯度濃度AE共孵育24 h,收集各孔上清至新的96孔板中,采用通過乳酸脫氫酶釋放檢測試劑盒(LDH Release Assay Kit,碧云天)對LDH含量進行檢測,采用SpectraMax 190酶標儀檢測上清液在490 nm的吸光度進而計算LDH釋放水平。結果顯示,LDH以濃度依賴的方式實現細胞外釋放(見圖 4)。結果顯示AE對膠質瘤細胞具有明確的抑制作用,這種抑制作用是通過介導膠質瘤細胞焦亡實現的。
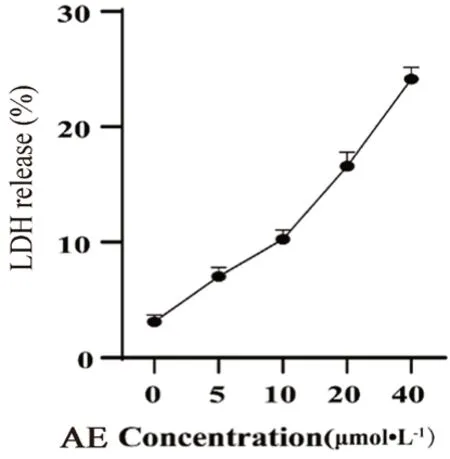
圖4 AE對U87MG細胞中LDH釋放的影響( ±s,n=3)Fig 4 Effect of AE on the LDH release of U87MG cells( ±s,n=3)
2.3 AE對CASP3/GSDME焦亡通路活化的影響
焦亡的發生主要是通過經典的CASP1/GSDMD通路及非經典的CASP3/GSDME通路,為了明確AE通過哪種通路介導GBM細胞焦亡,我們開展了Western blot實驗檢驗了這兩條通路的關鍵蛋白GSDME-N和GSDMD-N:U87MG細胞在6孔板中與濃度梯度AE(按實驗需求合用或單用caspase抑制劑Z-VAD-FMK,CASP3途徑焦亡陽性對照藥物順鉑,抗氧化劑NAC)共孵育48 h,以包含1%PMSF的RIPA裂解液裂解后提取蛋白,BCA法分析蛋白濃度,通過SDS-PAGE凝膠電泳,轉膜至PVDF膜上,以5%脫脂奶粉封閉2 h,裁膜后分別給予CASP3、GSDMD-N、GSDME-N、β-tubulin一抗4℃孵育過夜,TBST洗膜3次,每次10 min,加入對應二抗,室溫孵育1 h,TBST洗膜3次,每次10 min,ECL顯影液顯影,運用Image J軟件對條帶進行灰度分析。結果顯示:AE處理的U87MG細胞出現了CASP3、GSDME蛋白活化(C-CASP3、GSDME-N)表達水平上升,而GSDMD蛋白未受影響(未見GSDMD-N表達)(見圖5A),這提示AE活化了CASP3/GSDME焦亡通路而非GSDMD通路。為進一步驗證這一結果,我們給予CASP3/GSDME焦亡通路陽性對照藥順鉑和caspase阻斷劑(Z-VAD-FMK)進行處理,結果顯示,AE處理組出現和順鉑組類似的GSDME-N的表達,而AE處理組(100 μmol·L-1AE)給予Z-VAD-FMK共處理,GSDME-N的表達明顯減少(見圖5B),這進一步證明AE可以引起焦亡關鍵蛋白GSDME的活化,且這種活化依賴于caspase的表達。

圖5 AE激活U87MG細胞CASP3/GSDME焦亡通路( ±s,n=3)Fig 5 AE activate CASP3/GSDME pyroptosis pathway on U87MG cells( ±s,n=3)
蛋白免疫熒光是檢測蛋白表達水平的另一種手段,為了進一步證實AE對GSDME活化的影響,我們開展了GSDME-N免疫熒光實驗:細胞鋪至12孔板中,梯度濃度AE共孵育48 h,去上清,PBS清洗后加入免疫熒光固定液,室溫固定30 min,去固定液,PBS清洗三次,每次5 min,加入免疫熒光封閉液,室溫封閉30 min,清洗三次。加入1∶200 GSDME-N一抗,4℃搖床過夜,回收一抗,清洗三次;加入FIFC標記山羊抗兔IgG(H+L)二抗,室溫避光孵育2 h,回收二抗,清洗3遍;加入DAPI染色液,室溫孵育10 min,去染色液,PBS清洗三次,于熒光顯微鏡下檢測GSDME-N的表達。結果顯示,AE增強了GSDME-N在U87MG細胞的熒光強度(見圖6),這進一步證明AE能增強GSDME蛋白的活化。
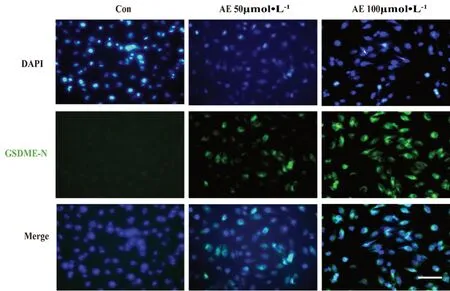
圖6 AE對U87MG細胞GSDME-N蛋白表達的影響(比例尺:×200)Fig 6 Effect of AE on the expression of GSDME-N in U87MG cells(scale bar:×200)
2.4 AE對GSDME在膠質瘤細胞mRNA水平的影響
為明確AE對GSDME mRNA表達水平的影響,我們進行了qPCR實驗:梯度濃度AE處理U87MG、GL261 細胞48 h,Trizol提取總RNA,測定總RNA濃度及純度,使用ABScript Ⅱ Reverse Transcriptase(RK21400)試劑盒反轉錄合成cDNA,使用Taq-HS Probe qPCR Premix預混液進行qPCR實驗。條件如下:95℃:2 min,94℃:20 s,58℃:20 s,72℃:20 s,40個循環,最后在72℃下延伸4 min。以β-actin作為內參計算GSDME的相對表達水平,實驗相關引物列表如表1,結果采用2-ΔΔCt法進行統計分析。

表1 引物序列Tab 1 Primers used in the experiment
結果顯示,無論是在U87MG細胞,還是在GL261細胞中,AE均可促進GSDME在mRNA水平的表達,在U87MG細胞中其差異有統計學意義(P<0.05)(見圖7)。
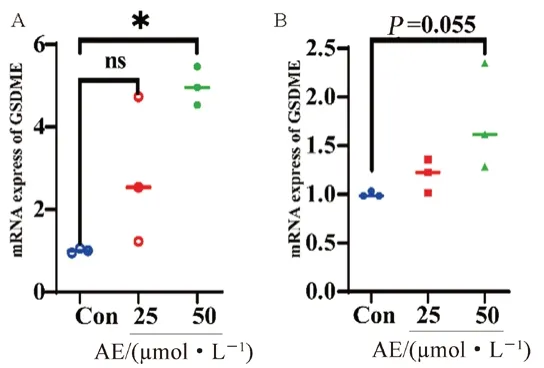
圖7 AE對U87MG(A)、GL261(B)細胞GSDME在mRNA水平的表達影響( ±s,n=3)Fig 7 Effect of AE on the expression of GSDME in U87MG(A)and GL261(B)cells at the mRNA level(x±s,n=3)
2.5 AE對膠質瘤細胞線粒體功能及ROS的影響
有研究顯示線粒體功能障礙及ROS和CASP3/GSDME 途徑的焦亡密切相關[17-18],為了明確AE介導GBM過程中是否發生線粒體功能障礙,我們對AE處理的U87細胞線粒體膜電位和ROS水平進行檢測。U87細胞鋪入6孔板中,細胞生長至70%~80%分別給予含0.2%DMSO,50 μmol·L-1和100 μmol·L-1AE 的培養液共孵育24 h,除去培養液,PBS洗滌細胞一次,加入1 mL含血清細胞培養液。再加入1 mL JC-1 染色工作液,充分混勻,細胞培養箱中37℃孵育20 min。在孵育期間,按照每 1 mL JC-1 染色緩沖液(5×)加入4 mL蒸餾水的比例,配制適量的JC-1染色緩沖液(1×),并放置于冰浴。37℃孵育結束后,吸除上清,用JC-1染色緩沖液(1×)洗滌2次。再加入2 mL含血清細胞培養液,用熒光顯微鏡進行觀察。結果顯示(見圖8):未經AE處理的U87MG細胞線粒體膜電位處于正常高電位(紅色熒光標識),而經AE處理的線粒體膜電位降低(綠色熒光標識)。熒光顯微鏡活性氧檢測顯示(見圖9A):經AE處理后U87MG細胞ROS熒光明顯增強;應用DCFH-DA 活性氧ROS熒光探針對細胞ROS標記,通過熒光顯微鏡及流式細胞術檢測ROS水平。U87細胞鋪入6孔板中,細胞生長至70%分別給予含0.2%DMSO,50 μmol·L-1和100 μmol·L-1的培養基共孵育24 h,除去培養基,加入DCFH-DA濃度為5 μmol·L-1的培養基1 mL,37℃培養箱孵育30 min,除去含探針培養基,PBS清洗三次,分別進行熒光拍照及流式細胞分析。結果顯示(見圖9B),DCFH-DA標識的陽性細胞數量明顯增多,這說明AE可提高U87細胞ROS水平。為進一步明確ROS的表達是否會影響GSDME的活化,AE處理的U87MG細胞與抗氧化劑NAC共孵育,顯示NAC可以顯著減輕AE(100μmol·L-1)所誘導的GSDME的活化(P<0.0001)(見圖9C),這提示AE誘導ROS介導了GSDME的活化及細胞焦亡。

圖8 線粒體膜電位檢測(比例尺:×200)Fig 8 Detection of mitochondrial membrane potential(scale bar:×200)

圖9 AE誘導U87MG細胞ROS產生及抗氧化劑NAC對GSDME活化的影響Fig 9 AE induced ROS production in GBM cells and the effect of antioxidants NAC on GSDME activation
2.6 統計學方法
所有定量數據均以算術平均值±標準差(±s)表示。采用雙尾獨立樣本t檢驗比較兩組平均值,使用單因素方差分析與Bonferroni的事后分析比較兩組以上的平均值。其余數據均采用非參數單向Kruskal-Wallis檢驗,再進行Dunnett多重比較。P<0.05為差異具有統計學意義。
3 討論
膠質瘤是中樞神經系統最常見、惡性程度最高、預后最差的惡性腫瘤[2]。Westphal等[19]認為,癌癥相關凋亡誘導和執行缺陷是治療失敗的重要原因[20-21]。AE作為一種從天然中草藥中提取的單體化合物,可通過多種途徑發揮抗腫瘤作用,而AE應用于抗GBM的治療尚不多見。我們的研究首次發現AE通過激活CASP3/GSDME通路誘導GBM焦亡發揮抗膠質瘤作用,可能為膠質瘤的治療提供新的策略。
焦亡是新發現的程序性細胞死亡方式,而GSDME途徑的焦亡被認為具有良好的抗腫瘤應用前景,是GBM的一個重要的預后預測因子[22]。化療藥物被認為是誘導焦亡發生的重要途徑之一,其誘發焦亡是通過激活凋亡關鍵蛋白CASP3來實現的[23-24]。CASP3是天冬氨酸特異酶切的半胱氨酸蛋白酶,正常狀況下以無活性的酶原形式存在于細胞質中,既往研究認為CASP3是凋亡相關關鍵蛋白,CASP3激活后,細胞進入凋亡途徑,近年研究表明CASP3的剪切和活化,可進一步剪切和活化焦亡關鍵蛋白GSDME,釋放的GSDME-N端片段具有細胞膜及線粒體成孔功能,細胞膜的成孔會導致細胞內容物如LDH、HMGB1的釋放,細胞內外滲透壓失衡,誘導細胞焦亡[25-27]。而HMGB1等抗原物質的釋放能激活抗原遞呈細胞,進而激活殺傷性T細胞,同時引起腫瘤相關巨噬細胞的活化及浸潤,起到免疫放大作用,擴大抗腫瘤效應[28-29]。故GSDME途徑的焦亡發揮抗腫瘤效應受到直接的細胞成孔及間接的免疫激活雙重作用。目前的研究顯示乳腺癌、黑色素瘤、胃癌細胞的焦亡有明顯的腫瘤抑制作用[30-31]。
GSDME的表達可促使細胞從凋亡向焦亡轉變[23],GSDME在GBM中高表達,使其成為誘導焦亡抗GBM治療的天然靶點,故篩選合適的焦亡激活藥物尤為重要。目前的研究顯示多種化學藥物如順鉑、阿霉素等具有GSDME途徑焦亡誘導作用[29],但血腦屏障的存在及其毒副作用限制了其顱內應用。AE具有血腦屏障能力[32],本研究顯示AE具有確切的CASP3、GSDME活化作用及GBM細胞抑制作用,故AE可以作為誘導GBM焦亡抗腫瘤的良好候選藥物。中等濃度的AE可明顯抑制GBM活性,但未見明顯的CASP3與GSDME的活化,這提示誘導焦亡是AE抑制GBM細胞的途徑之一,目前有文獻顯示AE可抑制DNA合成、阻滯細胞周期[11-12],故認為AE抗GBM的機制為包括誘導焦亡在內的多種途徑滲入,其焦亡誘導作用也是有限的。GSDME在正常腦組織及機體器官有表達,GSDME的完全激活會引起正常組織損傷,這也被認為與多種化療藥物的毒副反應相關[26],而AE有限的焦亡誘導作用既有利于其發揮對腫瘤的抑制作用,又可避免焦亡過度激活所引起的正常組織損傷,是一種適合臨床應用的理想的焦亡誘導藥物,當然其更明確的抗GBM作用及安全性有待體內實驗進一步明確。
焦亡的發生與線粒體的功能障礙以及ROS產生密切相關[17],Yang等[33]研究顯示:ROS產生可激活JNK/Cytochrome C/CASP9/CASP3通路,而誘導高表達GSDME的細胞出現焦亡;An等[18]研究顯示:線粒體ROS的產生可激活CASP3/GSDME,進而誘導乳腺癌細胞焦亡。以上研究顯示,線粒體功能障礙和ROS產生是CASP3/GSDME 途徑焦亡的啟動因素之一,我們的研究也顯示AE處理的GBM細胞在晚期(60 h)出現細胞焦亡,而在早期(24 h)檢測ROS水平,顯示ROS表達水平明顯升高,而用抗氧化劑阻斷ROS可抑制AE所誘導的GSDME的活化,說明AE介導GBM細胞焦亡和誘發線粒體功能障礙和ROS產生相關。
綜上,本文以膠質瘤細胞為研究對象,通過體外實驗證明AE以濃度依賴的方式抑制GBM細胞活性,誘導GBM細胞出現焦亡特異性外觀及LDH釋放,介導CASP3、GSDME蛋白水平的剪切活化,上調GSDME在mRNA的表達,誘導線粒體功能障礙和ROS的產生。證實激活CASP3/GSDME通路是AE抗GBM的機制之一,可為膠質瘤的治療提供一種新的選擇。