山東省藥品質量風險監測工作機制分析與建議
趙艷霞,孫 銅,周維利,王 坤,宗鳳玉,程春雷△
(1.山東省食品藥品檢驗研究院,山東 濟南 250101;2.山東省藥品監督管理局,山東 濟南 250014)
藥品質量安全與人民生命健康息息相關[1]。為貫徹落實習總書記“四個最嚴”的要求,我省藥品監管系統以問題為導向,堅持風險管理、突出全程管控、提升社會共治,強化抽檢、檢查、監測“三結合”,持續加強藥品監管。藥品抽檢作為藥品上市后監管的重要技術手段,在評價質量狀況、服務科學監管,發現質量風險、消除安全隱患,查控假劣藥品、震懾不法企業,提升藥品質量、促進高質量發展等方面有不可替代的作用。2014 年,原國家食品藥品監督管理總局印發《國家藥品計劃抽驗質量分析指導原則》,要求藥品抽驗工作要以問題為導向,結合當前藥品監管中的突出矛盾和問題,從可能影響藥品質量的關鍵因素和風險點入手,關口前移,著力排查和揭示潛在質量隱患[2]。參照國家藥品監管相關部門及中國食品藥品檢定研究院的要求,結合日常的省級藥品評價抽檢和監督抽檢工作,我省藥品監督管理局(以下簡稱省局)自2016年起針對風險隱患大的項目品種啟動全省藥品質量風險監測(以下簡稱省藥品風險監測),經過6年的摸索研究,已形成較完善的工作機制,成為常規抽檢的重要補充,有力防控了藥品質量風險。在此,梳理并分析6 年間我省藥品風險監測工作情況,探討工作機制對提升藥品質量管理水平的作用,進一步提出完善藥品風險監測工作的建議,為促進藥品監管提供參考。
1 基本抽檢情況
我省藥品質量抽檢包括省級藥品抽檢和省藥品風險監測。省級藥品抽檢包括評價抽檢和監督抽檢,其中評價抽檢的主要目的是全面掌握我省藥品質量安全總體狀況,客觀評價各地藥品質量安全狀況及藥品屬地監管責任落實情況;監督抽檢以發現問題、防控風險為原則,提高藥品質量、凈化藥品市場、打擊制售假劣藥品違法行為、保障人民群眾用藥安全有效為目的。而藥品風險監測基于藥品風險管理,包括一系列藥物警戒行動和干預,以識別、預防和減少藥品相關風險,是全面和持續降低整個產品周期風險的過程,旨在實現效益風險最優化[3]。
省藥品風險監測是由省局委托省食品藥品檢驗研究院(以下簡稱省院)組織全省各市級藥品檢驗機構共同承擔,主要以不良反應發生率高、質量風險大、市場占有率高的品種為目標,通過標準檢驗、探索性研究和質量分析,從而挖掘產品潛在的質量風險,查找企業違法違規行為,深入分析存在問題的原因,并提出切實可行的監管建議。對有關風險隱患,力爭做到早發現、早預警、早處置,切實防范系統性、區域性風險。6 年間,共完成180 個項目、9 877 批次(品種)藥品的風險監測,累計發現風險點186個。詳見表1。
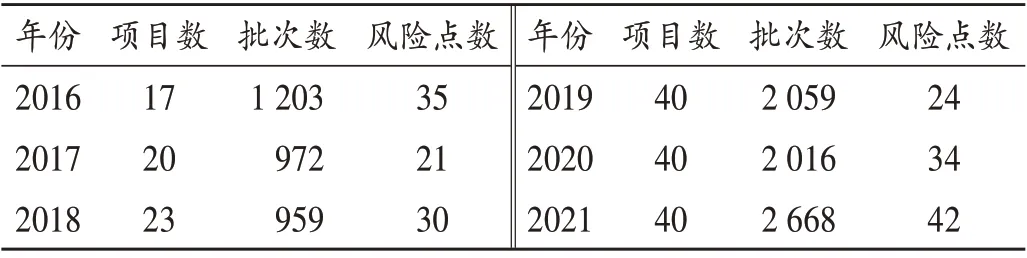
表1 2016年至2021年山東省藥品風險監測結果Tab.1 Results of drug risk monitoring in Shandong Province from 2016 to 2021
2 工作流程
2.1 遴選品種
每年年初,省院向各市級檢驗研究機構征求品種遴選意見,經初步確定后上報省局,省局征求相關處室單位意見后,邀請高校科研院所、臨床藥學方面專家進行論證,最終確定本年度項目品種。遴選品種主要包括,藥品不良反應監測發現問題較嚴重的品種,中西藥復方制劑及個別中藥制劑中可能存在未按規定處方投料、未按標準工藝生產、涉嫌使用非法提取物以及低限投料等違法違規行為的品種,可能在不符合無菌生產條件下生產的品種,以及質量標準不完善的品種。各檢驗研究機構結合各自工作實際,以問題為導向,從監管需要出發,推薦年度全省藥品質量風險監測品種。推薦品種應為本省企業生產品種,且在市場上流通,原則上近3 年國家藥品抽檢品種及近3 年我省藥品質量風險監測品種不納入本年度省藥品風險監測任務。
2.2 前期調研
各承檢機構通過采用現場、電話或視頻等方式對本省生產企業展開調研,提前做好檢驗和探索性研究所需的人員、設備、耗材、試劑、文獻、技術方案等準備。此外,省局結合日常注冊生產檢查、認證檢查、飛行檢查、藥品抽檢等方面,組織省院聯系省不良反應監測中心,將相關項目(品種)不良反應監測數據提供給承檢單位,充分提高探索性研究的靶向性和有效性。
2.3 啟動會
會議首先總結上年度全省質量風險監測工作,講解本年度全省藥品風險監測實施方案內容,同時對工作提出具體要求。承擔藥品風險監測項目的各檢驗研究機構,就承擔項目的研究背景、檢驗內容、探索性研究方向等進行現場報告,與會專家針對各項目提出建議和意見,對交流報告提出建設性意見。啟動會可很好地交流藥品質量研究的新思路和新方法,開闊研究思路,對于做好省藥品風險監測工作具有很強的指導性和實際操作意義。
2.4 抽樣與送檢、保存
抽樣:抽樣地點覆蓋全省16地市,包括生產、經營、使用環節。樣品重點采集我省產品,同時兼顧采樣地點所在市企業、本省其他市企業及外省企業產品。生產環節,每品種每家生產企業原則不得少于5 批次。如果企業未生產或生產批次未達到5 批次,要求企業開具證明。抽樣工作結束后1周內,提交抽樣工作總結(包括整體情況、發現問題及工作建議等內容)并報省院。
樣品送檢與保存:采樣單位人員應確保樣品在送檢運輸過程中的完好性和原始性,并確保樣品運輸過程有適宜的運輸條件。樣品采集后應盡快送檢(一般由抽樣人員直接送達或寄送至相應檢驗研究機構),樣品檢驗研究機構應設專人與樣品抽樣單位保持聯系,確認送交的時間、地點、方式。同時,承檢單位收到樣品后,應按藥品存貯條件做好樣品管理并安排專人負責,以備樣品復檢、方法驗證等調樣使用。
2.5 標準檢驗
各承檢機構應根據抽檢計劃安排,按現行法定檢驗標準對所承接的品種進行全項目(品種)或部分項目(品種)檢驗,及時出具報告書或檢測結果總結,抽檢結果錄入山東省藥品監督管理局抽樣檢驗與風險分析系統。對于膠囊劑品種,應檢測膠囊殼中鉻含量,如超標,需出具檢驗報告書。對有摻雜、摻假嫌疑的藥品,應依據已有的補充檢驗方法進行檢驗,并出具檢驗報告[4]。
探索性研究:人民群眾對安全有效藥品需求的不斷提高與當前市場上存在的假劣藥品之間的矛盾,為藥品科學監管帶來挑戰,尤其是隨著科學技術的發展,不法分子制假制劣手段不斷翻新,使假劣藥品更加隱蔽,藥品檢驗符合法定檢驗標準已不能客觀真實反映藥品質量,開展探索性研究工作顯得尤為重要。各承檢機構應根據調研掌握的項目(品種)的風險點和問題,針對性地對承檢項目(品種)開展探索性研究和質量分析工作,從可能影響藥品質量的關鍵因素和高風險因素入手,全面考察藥品質量的穩定性、現行標準的可行性,揭示潛在的質量風險或違法違規問題,分析問題原因,并提出切實可行的監管建議,為提升藥品質量標準,提高監管效能提供技術支撐[5]。探索性研究工作主要從合理性、合法性、安全性、可控性及規范性5個方面開展,詳見圖1。
二是強化調配。不斷加強流域水量調度配置管理,調節豐枯季水量配置。如實施三峽為中心的上游水庫群水量聯合調度,南水北調中線、東線工程水量調度,以及漢江、嘉陵江、岷江、沱江、赤水河、金沙江、牛欄江、瀾滄江、烏江等水量調度。
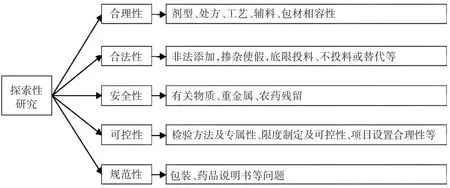
圖1 省藥品風險監測探索性研究內容Fig.1 Exploratory research content of provincial drugrisk monitoring
檢驗結果及相關材料報送:各承檢單位認真匯總檢驗及探索性研究結果,并結合實際工作和監測情況開展研判和分析,形成相關分析報告。發現藥品安全風險情況或潛在風險的,要按要求形成書面材料并及時向省院報告,由省院組織專家核實后報告省局。在檢測過程中發現可能存在較高風險的問題樣品,應當在省院確認檢驗結果后的24 h 之內報告省局。各承檢機構應妥善保存與藥品風險監測有關的各類數據、資料、文書,并建立檔案備查,有關資料保留時間不得少于2年。
不合格藥品報告書傳遞與處置:經標準檢驗發現的不合格藥品,承檢機構須在得出檢驗結論后2 d 內,將不合格樣品檢驗報告按程序寄送省局。
2.6 期中檢查調研
檢查和調研工作由省局組織,省院負責具體實施,根據項目(品種)進度安排,有計劃、有步驟地對部分檢驗研究機構進行檢查和調研,掌握省藥品風險監測工作開展情況、存在的問題及解決方案、意見和建議等,切實保證工作有序、科學、規范地開展。
2.7 交流評議
各檢驗研究機構對承擔項目(品種)完成情況進行現場報告,邀請專家進行評議,評議內容主要包括質量分析報告整體情況、法定檢驗情況總體分析、探索性研究與發現存在主要問題及分析、發現的該品種風險點及提出有效的監管建議、匯報情況等方面。
2.8 發出質量提示函
國家藥品抽檢質量提示工作開始于2014 年[6],參照國家工作模式,省藥品風險監測質量提示工作包括發出質量提示函、分析驗證質量信息、反饋質量提示信息三部分。工作流程見圖2。
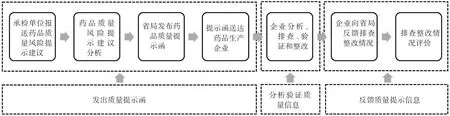
圖2 省藥品風險監測質量提示工作流程Fig.2 Quality prompt workflow of provincial drug risk monitoring
3 存在的問題
3.1 抽樣壓力較大
省藥品風險監測范圍廣、規模大,參與單位17 家,樣品涉及我省生產企業及流通使用環節品種,年度完成量共計2 000 批次。省局將做好生產環節的質量安全風險防控作為監管的根本[7],將關口前移至藥品生產一線,要求本省生產企業產品抽樣要求達到60%(即1 200 批次),存在前期調研不充分或企業臨時停產導致抽樣壓力較大。
3.2 探索性研究不夠深入
此項工作品種遴選確定、下達工作方案一般在每年4 月左右,2 個月時間完成相關抽樣和樣品送檢,10 月中旬完成藥品標準檢驗工作,11 月上旬完成檢驗結果匯總、問題樣品和分析報告報送,11 月底前完成風險監測年度質量分析報告。標準檢驗及探索性研究工作時間約3個月,如因前期調研不充分或企業臨時停產導致抽樣推遲或不足,且各藥檢機構藥品注冊、委托、抽驗等多個任務集中下達,時間緊、任務重、困難大,檢驗人員因工作繁重而導致探索性研究工作不夠深入。
3.3 信息公開缺乏制度支撐
保障公眾用藥安全、有效是省藥品風險監測工作的最終目的,因此充分轉化工作成果提高監管效能,促進藥品檢驗及探索性研究結果轉化利用,需適度開展信息公開。但鑒于藥品檢驗及探索性研究結果的專業性,《藥品管理法》《藥品質量抽查檢驗管理辦法》等法律規范為開展藥品風險監測工作提供了制度保障,但缺少對藥品風險監測結果信息公開的詳細規定,對于公開主體、方式、范圍、時限、追責等[8]則未明確要求。
3.4 疫情防控風險
省藥品風險監測工作抽驗涵蓋生產、流通和使用環節,抽樣對象包括本省藥品生產企業、批發和零售企業、醫院和診所等使用單位,抽驗人員需深入一線進行現場抽樣,且可能在同一天內去往多地抽樣,流動性大、工作繁重,在新冠肺炎疫情解除前,由于職業特點,抽樣工作暴露風險隨之升高。
4 建議
4.1 推廣網絡智慧監管
省藥品風險監測工作,將網絡技術應用于業務培訓、溝通合作、交流評議,極大地推動了工作的有效開展,又能避免人員聚集。截至目前,新型冠狀病毒感染疫情尚未解除,應充分利用網絡技術異地互聯、實施高效、功能多樣的特點,提高網絡利用率。建議在疫情常態化防控形勢下,充分利用信息化手段,省院組織的交流評議現場會議改為視頻會議;省局和省院對承檢單位的期中現場調度檢查改為問卷調查;此外,建議承檢單位將復驗受理工作現場需提交的紙質材料,采用網絡平臺傳送電子版,并通過電話或視頻進行必要的技術交流和溝通。此外,盡快推進智慧監管體系建設[9-10],實現監管信息互聯互通,篩查藥品質量安全風險高的企業和品種作為監管對象,充分提高監管效能[11]。
4.2 優化抽檢工作安排
為有效兼顧省藥品風險監測工作與省級抽驗其他工作任務,對各工作環節進行優化。通過省抽系統實時監測同品種同規格同批號藥品抽驗批次,達到抽樣地域及抽樣環節覆蓋率,提前終止抽樣。此外,建議抽樣單位根據具體承擔任務,結合轄區內具體情況,合理安排工作,安排業務骨干、增加人員,突出重點,盡快完成抽驗送承檢單位檢驗。對于從當地確實抽不到的品種,探索線上線下相結合,可通過第三方平臺抽取部分樣品。同時,針對同品種不同任務,樣品抽樣時可考慮不同任務交叉同時抽樣,分別寄送不同承檢單位,完成不同任務抽樣工作;同時,建議承檢單位根據具體承擔任務,優先安排此類項目(品種)的檢驗,做到隨到隨檢,以最快速度出具檢驗報告書并開展探索性研究工作,為后續藥品質量風險采取控制措施贏得充足時間[12]。
4.3 信息公開
在省院官方網站設立風險監測專欄,適時公開風險檢驗檢測方法等抽檢成果,及時、準確且有針對性地公開信息;充分利用行業協會會議或監管部門業務培訓,通報風險監測發現的隱患,加強藥檢機構和企業之間開展良性互動和溝通,鼓勵藥品生產企業借鑒并將其轉化,使企業意識到探索性研究結果對促進自身發展和提高產品質量具有重大意義,充分利用探索性研究結果,并主動參與其中,排查潛在質量安全風險,提升藥品質量控制水平,提高識別質量安全風險的能力。
4.4 加強溝通協作,強化探索性研究靶向性
藥品檢驗研究機構在任務下達后,通過電話咨詢、現場考察和函調等方式,明確研究項目(品種)的工藝處方或藥品質量管理方面存在的問題和難點,針對性地開展研究,綜合評價藥品質量風險。藥品生產企業應充分認識到省藥品風險監測對提升藥品質量具有積極促進作用,主動配合抽樣和檢驗工作,并按要求提供藥品自檢報告、藥品標準等相關資料[13]。另外,借助藥品標準制修訂、國家藥品重點實驗室建設[14]及一致性評價工作,按省藥品風險監測工作要求,進一步提升藥品檢驗研究機構的檢驗能力,以助力企業和服務監管為目標,從藥品質量和質量標準等關鍵因素入手,多舉措提高探索性研究工作的科學性和靶向性。
4.5 深入挖掘數據,提高監管效能
藥品質量安全風險具有客觀性,藥品監管需常抓不懈。風險提示函發送企業后,建議完善企業核實情況反饋承檢機構機制,同時,監管部門也要加強對風險監測結果的運用,推進制度化規范化建設,不斷提高監測數據的深度挖掘和分析利用,突出技術支撐作用,發現并及時查處假劣藥品,不斷凈化藥品市場,提高監管效能[15]。

