超聲波清洗技術在硬式腔鏡器械清洗消毒中的應用
劉潔
武警天津總隊執勤第四支隊勤務保障大隊衛生隊(天津 300162)
外科腔鏡技術的迅猛發展使微創手術患者獲益,其臨床應用范圍十分廣泛。硬式腔鏡器械的精密度高,價格相對昂貴,需妥善保管和維護。但同時硬式腔鏡器械的結構也較為復雜,其內徑細長,咬合齒、軸關節、凹凸槽較多,分泌物或細胞組織易在上述部位殘留,明顯增加清洗消毒的難度,若清洗消毒不合格,可導致系列交叉感染問題的發生[1-2],進而影響醫院的醫療質量。為了延長硬式腔鏡器械的使用壽命并控制醫源性感染的發生,需尤為重視清洗消毒相關工作。近年來,隨著腔鏡器械消毒管理工作的不斷深入,超聲波清洗技術的地位日益突顯[3],為提高器械清洗消毒質量和控制醫源性感染提供了優化途徑。本研究探討超聲波清洗技術在硬式腔鏡器械清洗消毒中的應用價值,現報道如下。
1 材料與方法
1.1 一般材料
選取2020 年7 月至2021 年8 月武警天津總隊執勤第四支隊衛生隊回收待清洗的400 件硬式腔鏡器械作為研究對象,利用隨機數字表法分成對照組和觀察組,每組200 件。每組胸腔鏡75 件,縱隔鏡55 件,止血鉗40 件,雙極鉗30 件。兩組硬式腔鏡器械的具體種類構成和數量比較,差異均無統計學意義(P>0.05),具有可比性。
納入標準:臨床比較常用的硬式腔鏡器械;可拆解且有管腔、齒槽和軸節構造的硬式腔鏡器械;已經被使用污染且及時回收待清洗消毒的硬式腔鏡器械。排除標準:被特殊污染和明確要求需特殊處理的硬式腔鏡器械。
1.2 方法
由同一組器械清洗人員(均熟練掌握《內鏡清洗消毒技術操作規范》[4])按照相應的方法進行清洗消毒。
對照組采用手工清洗程序進行清洗消毒:將回收的腔鏡器械進行充分拆解,拆解至最小單元后,先用流動水沖洗掉器械表面的污漬殘留,對于較難沖洗的部位可選擇特制清潔毛刷進行刷洗,尤其是器械的軸節、咬合面和凹凸槽等部位,清洗擦拭時注意避免劃傷器械;完成上述清洗操作后,將器械放置于低泡型多酶清洗液(3M-70503 型號多酶清洗液,規格5 L,多酶稀釋比為1∶100)中浸泡6~8 min,然后在流動水下用合適型號的管道刷、毛刷對器械再次進行手工刷洗,管腔內壁用高壓水槍沖洗,最后依次進行純化水漂洗、潤滑劑潤滑、高壓氣槍吹干水分、80 ℃干燥箱烘干等處理。
觀察組在對照組基礎上采用超聲波清洗技術:手工清洗程序步驟同對照組,完成多酶清洗液浸泡、刷洗的環節后,將器械完全浸泡在超聲波清洗機(山東新華醫療,QX 2000 型)內的酶洗槽內,酶洗槽內配有低泡型多酶清洗液(多酶稀釋比為1∶100),清洗溫度為45 ℃,超聲波加酶清洗8 min 后,再依次進行流動水沖洗、純化水漂洗、潤滑劑潤滑、高壓氣槍吹干水分、80 ℃干燥箱烘干等處理。
1.3 觀察指標
分別采用5 倍放大鏡法、細菌學測試法和三磷酸腺苷(adenosine triphosphate,ATP)生物熒光法對兩組的清洗消毒效果進行評價,其中細菌學測試法和ATP 生物熒光法主要針對管腔、咬合齒、凹凸槽等比較難清洗的腔鏡器械部位進行檢測。(1)5 倍放大鏡法:將清洗后的器械充分打開暴露,先用肉眼觀察,然后借助5 倍放大鏡(3M公司),仔細觀察器械把手、軸關節、咬合齒、凹凸槽等部位,無污漬殘留判定為合格,若發現任意部位有污漬殘留,則判定為不合格。(2)細菌學測試法:將無菌棉拭子在0.9%氯化鈉注射液中浸濕,分別對器械管腔、咬合齒、凹凸槽等部位進行仔細擦拭,擦拭完成后置入0.9%氯化鈉注射液試管中送檢,若未檢出致病微生物且細菌總數<5 cfu/cm2則判定為合格。(3)ATP 生物熒光法:用ATP 采樣棒分別涂抹腔鏡器械管腔、咬合齒、凹凸槽等部位,將海綿頭放置于采樣器中并折斷頂部的塑料圓柱,釋放試劑后震蕩15 次,放入美國Hygiena PLUS 手持式ATP 熒光檢測儀后按“OK”鍵,15 s 后讀取檢測結果,ATP 熒光值的相對光單位(relative light unit value,RLU)<45 則判定為合格。
1.4 統計學處理
采用SPSS 19.0 統計軟件進行數據分析,計數資料以率表示,采用χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 5 倍放大鏡法檢測結果
5 倍放大鏡法檢測結果顯示,觀察組咬合齒、凹凸槽清洗合格率和器械清洗合格率均高于對照組,差異有統計學意義(P<0.05),見表1。

表1 兩組5 倍放大鏡法檢測合格率比較[件(%)]
2.2 細菌學測試法檢測結果
細菌學測試法檢測結果顯示,觀察組管腔、咬合齒、凹凸槽清洗合格率和器械清洗合格率均高于對照組,差異有統計學意義(P<0.05),見表2。

表2 兩組細菌學測試法檢測合格率比較[件(%)]
2.3 ATP 生物熒光法檢測結果
ATP 生物熒光法檢測結果顯示,觀察組管腔、咬合齒、凹凸槽清洗合格率和器械清洗合格率均高于對照組,差異有統計學意義(P<0.05),見表3。
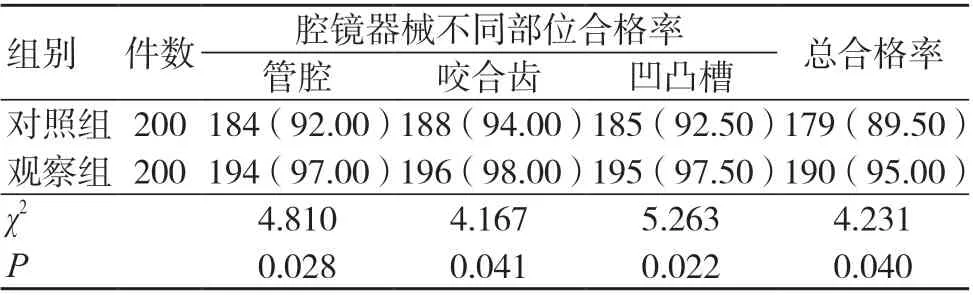
表3 兩組ATP 生物熒光法檢測合格率比較[件(%)]
3 討論
內鏡器械使用后需及時回收和清洗,若清洗不及時,污染物附著于器械的黏附力會增強,如較細管腔內的血跡清洗不及時可凝固附著于器械內壁上,形成血痂和細菌保護膜,不僅增加清洗消毒難度和醫源性感染風險,而且因清洗相對困難,清洗時易損壞器械,縮短器械使用壽命。與普通手術器械相比,硬式腔鏡器械的構造更復雜,型號各異,多帶有軸關節、細孔、管腔、咬合齒或凹凸槽等結構,一些狹縫、小孔或死角的部位易殘留污染物,清洗消毒難度明顯更高[5],而提高硬式腔鏡器械的清洗消毒質量對預防醫源性感染具有重要意義[6]。
規范的手工清洗程序是硬式腔鏡器械清洗合格的必要條件,需將器械拆解至最小單元,選擇規格合適的清洗工具進行手工清洗,同時借助多酶清洗液幫助消毒滅菌。多酶清洗液具有大量的蛋白酶和活性酶,對黏附在器械上的蛋白質、黏多糖等有較好的清除作用[7]。但從實際工作情況來看,手工清洗質量有待提高。
近年來,超聲波技術在醫學相關領域的應用進展迅速。超聲波技術在醫療器械清洗消毒中的作用原理是,借助超聲波發生器產生高頻機械振蕩循環,超聲波在多酶清洗液中傳播并產生“空化效應”,一方面能破壞污染物對器械表面的吸附性,另一方面這種“空化效應”還能瞬間產生較大的沖擊力,破壞生物保護膜和污染層并使其剝離脫落[8],非常適合清潔管腔、凹凸槽等手工清洗相對困難的器械部位;此外,將多酶清洗液的溫度設置為45 ℃,能發揮最大酶活性,和超聲波結合使用可使清洗消毒效果更佳[9]。本研究結果顯示,采用5 倍放大鏡法、細菌學測試法和ATP 生物熒光法檢測后,觀察組清洗消毒效果均優于對照組(P<0.05),這與張靜輝和陳潔霞[10]的研究結果相似,也證實了超聲波清洗技術的應用優勢。需要注意的是,手工清洗與超聲波清洗不可替代,兩者結合能更好地提高清洗消毒效果。綜上可知,超聲波清洗技術應用于硬式腔鏡器械清洗消毒中的價值顯著,與單純手工清洗相比,超聲波清洗技術與手工清洗的完美結合既明顯提高了清洗合格率,也有利于控制醫源性感染和減少不必要的醫療意外,為此類器械的安全使用、延長使用壽命提供了保障。

