腹腔鏡下低位前切除術中保留左結腸動脈對直腸癌患者療效及預后的影響
陳小保, 梅天明, 魏 俊, 柳長青, 章 濤
(安徽醫科大學附屬宿州醫院胃腸外科, 安徽 宿州 234000)
2018年一項調查顯示,我國結直腸癌的發病率及死亡率約占全部惡性腫瘤的第3及第5位[1]。腹腔鏡下全直腸系膜切除術(TME)具有術后復發率低的特點,逐漸成為治療直腸癌的主流術式。近年來,TME治療的療效及安全性已被臨床認可,成為中低位直腸癌手術中貫徹的原則,但該術中對腸系膜下動脈(IMA)的結扎部位及淋巴結清掃方式,尚有爭議[2]。IMA的離斷方式主要包括不保留左結腸動脈(LCA)及保留LCA兩種,以往普遍認為前者可保證IMA根部淋巴結徹底清除,避免疾病復發。但越來越多研究顯示,保留LCA不僅可保障患者左半結腸血供,且對生存期無明顯影響[3]。目前關于上述兩種IMA離斷方式的療效差異仍需大量臨床資料支持。本研究旨在探究腹腔鏡下低位前切除術中保留或不保留LCA對患者胃腸功能及復發轉移的影響,現報道如下。
1 資料與方法
1.1一般資料:回顧性分析2018年4月至2021年2月收治的85例患者的臨床資料。根據治療方式不同分為觀察組(術中保留LCA,n=40例)和對照組(術中不保留LCA,n=45例)。病例納入標準:①符合直腸癌診療標準[4]:患者排便習慣改變,腹痛、腹部腫塊或現腸梗阻相關癥狀,腸鏡、磁共振等檢查發現直腸腫瘤,組織病理學診斷提示癌變;②年齡29~76歲之間,均順利完成手術,無中轉開腹;③直腸癌TNM分期Ⅰ~Ⅲ期,腫瘤下緣距離肛緣4~8cm[5];④無遠端轉移;⑤術前未行新輔助治療;⑥自愿參加研究者。排除標準:①直腸癌復發或合并其他惡性腫瘤者;②術后標本組織學檢查近端、遠端或環周邊緣(+)者;③重要臟器功能異常者;④合并血液系統疾病、染色體疾病或全身傳染性疾病者;⑤臨床資料不全者。本研究符合赫爾辛基人體試驗準則,經醫院倫理委員會批準(A2020006)。兩組一般資料比較差異無統計學意義(P>0.05),見表1。

表1 兩組一般資料比較
1.2方法:患者靜脈麻醉,常規五孔法穿刺,人工氣腹后分別于臍部(10mm)、臍旁左右腹直肌外緣(5mm)、右側下腹(12mm)及左下腹(5mm)做操作孔;以骶骨岬下方直腸系膜薄弱處為手術入路,兩組均按照直腸癌TME原則完成直腸低位前切除術:①觀察組保留LCA:于臍部置入腹腔鏡探查IMA及靜脈解剖結構,沿Toldt間隙游離乙狀結腸系膜,向上游離至IMA根部,并解剖使其骨骼化,打開根部血管鞘,裸化IMA暴露分支LCA、乙狀結腸動脈及直腸上動脈,分離過程中注意保護腹下神經;于LCA下方1cm處切斷IMA,保留LCA;在IMA根部外側1cm處結扎并切斷腸系膜下靜脈根部,同時完成血管周圍脂肪及第253組淋巴結清掃,系膜根部淋巴結清掃應由近及遠行整塊切除;而后以TME原則完成直腸腫瘤切除,腸管吻合,消化道重建等操作。②對照組不保留LCA:解剖出IMA,清掃周圍脂肪及淋巴結后,于IMA根部1cm處結扎切斷,繼續分離腸系膜下靜脈,清掃周圍淋巴結;后續腫瘤切除等操作同觀察組。根據術后組織病理學結果,TNM分期為Ⅱ~Ⅲ期的患者接受mFOLFOX6方案輔助化療。本研究中所有患者由同組醫師施術。
1.3觀察指標:①比較兩組術中出血量、淋巴結總清掃數、手術時間、第253組淋巴結清掃數目、術中殘端缺血性改變、預防性造口例數;②比較兩組術后首次排氣時間、進食流質時間、住院時間;③比較兩組手術前后腸胃動力及肛門功能(Wexner便秘評分):分別于兩組患者術前1d及術后3d留取其清晨空腹外周靜脈血,運用全自動生化分析儀以放射免疫法檢測胃動素(motilin,MTL)及胃泌素(gastrin,GAS)水平;Wexner便秘評分[6]包括排便完整性、在廁所時間等評估內容,總分0~30分,分值越高表示肛門功能越差,本研究中所有患者的Wexner評分均由同一名醫護人員記錄;④叮囑患者術后定期行門診CT(胸部+全腹+盆腔增強掃描)復檢,觀察腸壁增厚、淋巴結腫大及外血管侵犯情況,記錄復發轉移率;⑤記錄兩組隨訪期間吻合口漏、切口感染、尿潴留等并發癥發生情況。
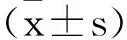
2 結 果
2.1兩組手術相關指標比較:對照組的手術時間顯著短于觀察組(P<0.05),兩組術中出血量、淋巴結總清掃數目、第253組淋巴結清掃數目、術中殘端缺血性改變數及預防性造口數比較差異無統計學意義(P>0.05),見表2。

表2 兩組手術相關指標比較
2.2兩組術后恢復情況比較:觀察組的術后首次排氣時間及住院時間顯著短于對照組(P<0.05),兩組進食流質時間比較差異無統計學意義(P>0.05),見表3。
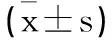
表3 兩組術后恢復情況比較
2.3兩組手術前后胃腸動力及肛門功能比較:術后兩組血清MTL、GAS水平較術前明顯降低(P<0.05),Wexner便秘評分較術前明顯升高(P<0.05),但兩組上述指標治療前后的差值比較差異均無統計學意義(P>0.05),見表4。
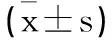
表4 兩組手術前后胃腸動力及肛門功能比較
2.4兩組復發轉移情況比較:隨訪12個月時,觀察組局部復發1例(2.50%),對照組局部復發3例(6.67%),組間比較差異無統計學意義(χ2=0.154,P>0.05);觀察組肝臟轉移2例(5.00%),對照組肝臟轉移3例(6.67%),組間比較差異無統計學意義(χ2=0.018,P>0.05)。
2.5兩組并發癥比較:隨訪12個月期間,兩組吻合口漏、吻合口出血、泌尿系統感染等并發癥發生率比較差異無統計學意義(P>0.05),見表5。

表5 兩組并發癥比較n(%)
3 討 論
腫瘤的TME治療遵循根治性切除原則,對于中低位直腸癌患者除保證直腸系膜的完整性之外,IMA根部淋巴結徹底清掃也是評價手術療效的重要因素。IMA根部淋巴結,既中央區淋巴結,日本大腸癌病理規約將其命名為第253組淋巴結,該組織位于IMA起始部及LCA起始處之間,是直腸癌細胞向遠處轉移的最后一道屏障[7]。故以往治療中,多數專家認為于IMA根部結扎可整塊清除第253組淋巴結,對術后生存期有益[8]。但隨著臨床不斷研究發現,IMA的不同處理方式與淋巴結清掃數目之間無明顯相關性,且國內學者更推薦保留LCA治療,以更好的保證吻合口血供[9]。本研究中85例直腸癌患者,分別接受保留或不保留LCA的腹腔鏡下低位前切除術治療,結果顯示,兩組患者的淋巴結總清掃數目及第253組淋巴結清掃數目比較無明顯差異。說明保留LCA可較好的清掃中央區淋巴結,可行性良好。
比較兩組患者的手術相關指標,發現觀察組的手術時間較對照組明顯延長,而兩組術中出血量比較差異無統計學意義。這是由于觀察組術中既要保留LCA,又要行周圍淋巴結清掃,故一定程度上延長手術時間。本研究中施術醫生經驗豐富,技術嫻熟,故可有效控制術中出血量。姜慧員等[10]研究表明,技術嫻熟的腹腔鏡外科醫師在直腸癌保留LCA術中不會增加術中出血量,與本研究結論相符。吻合口血供不足可引發術中殘端缺血性改變,傳統IMA高位結扎后的吻合口血供主要來源于結腸中動脈的邊緣支,而保留LCA及其上升支可增加近端結腸殘端血供,降低術中殘端缺血性改變。早在2011年Komen等[11]采用激光多普勒血流儀系統證實,保留LCA的腸管殘端血供顯著優于不保留組。而本研究顯示,觀察組的術中殘端缺血性改變數及預防性造口數雖少于對照組,但組間比較差異無統計學意義。這可能與研究樣本量較小有關,有待后續進一步驗證。
直腸癌前切除術后,部分患者會因腸蠕動減弱,導致排便困難,還有部分患者出現腹瀉、里急后重等癥狀。本研究中于兩組患者治療前后采用血清MTL、GAS水平、Wexner便秘評分評估其胃腸動力及肛門功能,顯示兩組術后的血清MTL、GAS水平較術前明顯降低,Wexner便秘評分較術前明顯升高,但手術前后的上述指標差值比較差異無統計學意義。提示,腹腔鏡下直腸癌前切除術保留或不保留LCA對患者胃腸及肛門功能的影響相當。另外,本研究還顯示觀察組住院時間、術后排氣時間明顯縮短。這可能與保留結腸血管可降低腸胃損傷,保護IMA根部神經叢的作用相關。
中低位直腸癌由于近端殘管較長,血運壓力較大,僅靠中結腸動脈邊緣的血管弓,無法保證吻合口充足的血供,易引發吻合口漏、切口感染等術后并發癥,尤其對于免疫力下降的老年患者,術后并發率更高。此前有研究顯示,保留LCA可分擔吻合口血運壓力,促進腸道功能恢復,從而減少吻合口漏發生率[12],這與本研究結論不一,這可能受患者病情、樣本量等因素影響,有待探究。關于兩組術后腫瘤復發及轉移情況,隨訪12個月時觀察組局部復發1例,轉移2例,對照組局部復發3例,轉移3例,均為肝轉移,兩組間復發及轉移發生率比較無顯著差異。說明,保留LCA不會增加直腸癌術后復發及轉移風險,但仍需長期精確隨訪以提高結論可靠性。
總之,腹腔鏡下直腸癌低位前切除術保留LCA安全可行,與不保留LCA相較,既不影響術中淋巴結清掃,又不增加術中出血量及術后轉移復發風險,還具有縮短術后排氣時間及總體住院時間的優勢。未來隨著高清腹腔鏡技術的發展,將更多直腸癌患者受益。但本研究存在不足:為單中心臨床設計,未對兩組患者的遠期預后進行比較,部分結論存在偏倚。

