基于BMI選擇千伏降低CT引導下射頻消融治療肝臟腫瘤輻射劑量
趙君祿, 聶關偉, 趙 炎, 劉 沖, 鄭立冬, 趙德園
(河北醫科大學第一醫院, 河北 石家莊 050000)
射頻消融(radio frequency ablation RFA)由于療效確切、副作用小,越來越多的應用于各種腹部腫瘤[1,2]。在可用于射頻消融的各種圖像引導模式中,CT引導因其優越的解剖分辨率和病變空間定位,特別是對于肥胖患者[3]。盡管有這些好處,但考慮到CT引導程序的復雜性以及需要頻繁成像以監測治療和治療后結果的需要,與程序相關的輻射劑量值得關注,因此輻射劑量可以達到高水平。隨著人們越來越擔心CT相關的輻射劑量導致癌癥終生風險增加,一些研究[4,5]已經通過改變掃描參數來降低CT掃描輻射劑量。本文將探討基于BMI選擇千伏是否能夠降低CT引導下射頻消融治療肝臟腫瘤的輻射劑量。
1 資料與方法
1.1一般資料:本研究通過河北醫科大學第一醫院倫理委員會批準,并簽署了知情同意。該研究分為兩個階段進行:第一階段是觀察階段,第二階段是方案修改階段。
1.1.1第一階段觀察階段:回顧性識別本研究的患者。本研究的納入標準為2019年1月1日至2019年12月31日期間接受CT引導下的肝臟腫瘤射頻消融治療的患者。記錄了患者基本資料(手術日期、年齡、性別和身高、體重等信息)以及技術細節(病變大小和治療次數)。記錄這些步驟的掃描參數(管電壓、管電流、CT劑量指數[CTDI]和劑量長度乘積[DLP]),以計算輻射劑量。在這個階段,100例患者接受了CT引導下肝臟腫瘤的射頻消融治療(男55例、女45例,年齡29~90歲)。平均BMI為24.41±3.86。
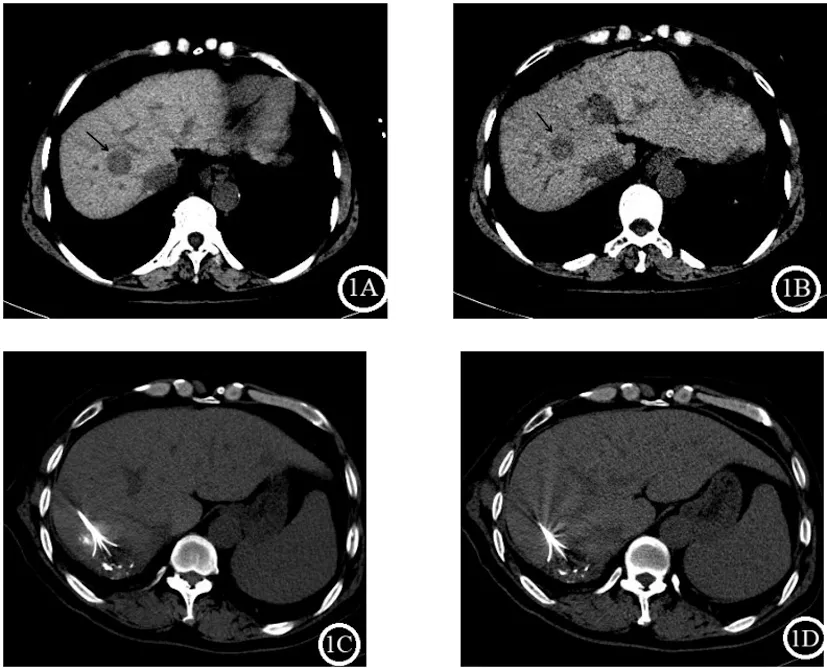
1.1.2第二階段方案修改階段:掃描方案基于患者體重指數(Body mass index,BMI)進行修改,BMI≤24采用70KV,24 1.2CT引導掃描技術:所有CT引導均采用64MDCT掃描儀(INCISIVE,Philips),掃描參數如下:機架旋轉時間0.5s;探測器寬度64X0.625mm。觀察階段掃描均采用120KV,自動毫安秒進行掃描,(dose report index,DRI)=23,方案修改階段根據病人BMI分別采用70KV、80KV及100KV,自動毫安秒進行掃描,DRI=23。 1.3射頻消融技術:所有CT引導下射頻消融治療均使用美國RATA射頻消融儀,射頻電極針采用RATA多級電極針進行。對每個腫瘤進行了多次重疊消融,靶溫度設置為85℃,每次消融的時間限制為達到靶溫度后消融5min。 1.4劑量計算:CT引導下的消融術手術分三步進行,以實現有效的腫瘤消融。步驟1包括規劃,包括靶向病變的初步軸向成像,評估經皮到病變的軌跡,以及評估實現完全消融所需的重疊消融的數量。第2步涉及對電極放置和重新定位的評估,涉及多次迭代。第3步包括電極移除后的術后評估,以評估立即的并發癥和治療成功。記錄這些單獨步驟的CTDIvol和DLP。 1.5圖像分析:圖像質量采用PACS診斷工作站由兩名高年資放射科醫生進行主觀圖像質量評估。圖像顯示在肝臟窗口設置(WL:60HU;WW:180HU),根據病變性質調節窗寬窗位用于評估病變。兩位醫師在3周的時間內獨立評估了有和沒有方案修改的隨機CT圖像的圖像質量。兩名放射科醫生評估了圖像質量(5分:優秀圖像質量劃分病變,4分:輕微模糊的病變不受限制的圖像評估,3分:適度模糊病變的輕微限制評估,2分:嚴重模糊或定義模糊的病變評估不確定性,1分:嚴重降低圖像質量使可靠的解釋不可能)。操作者總體信心滿意度(5分:完全自信診斷解釋,4分:可能自信解釋,3分:信心只有在有限的條件下可視化的異常,2分:有些不可接受的診斷圖像,1分:完全不可接受的診斷圖像)。 2.1基本資料:兩階段患者年齡、BMI差異無統計學意義,可用于對比研究,見表1。 表1 兩階段患者年齡BMI對比 2.2圖像質量:第一階段的圖像質量高于第二階段圖像質量,兩者差異有統計學意義(P<0.05),但兩個階段的圖像質量均大于3.8分,可滿足CT引導下射頻消融治療肝臟腫瘤的需要。電極針顯示和操作者的信心滿意度差異沒有統計學意義(P>0.05),見表2及圖1。 圖1 圖像質量A顯示常規劑量下肝臟圖像,B顯示低劑量下肝臟圖像,箭頭顯示肝臟腫塊。C顯示常規劑量下電極針在肝臟腫塊內顯示,D顯示低劑量下電極針在肝臟腫塊內顯示。 表2 兩階段圖像質量電極針顯示及操作者信心滿意度 2.3輻射劑量:第一階段:CT引導下射頻消融術的CT劑量指數(CTDIvol)為(12.83±3.78)mGy。第二階段:方案修改后,平均CTDIvol下降至(3.84±2.24)mGy,降低8.99mGy(P<0.05),降低率為70.07%,見表3。 表3 兩個階段輻射劑量對比 鑒于CT在診斷和監測中使用的增加,人們越來越關注患者所接受的輻射劑量[6]。成人腹部成像的平均CTDIvol為25mGy;然而,CT引導手術的相應統計數據和參考范圍尚未建立。已有研究提倡使用低劑量CT掃描技術來減少輻射劑量,而不增加手術時間或顯著降低圖像質量[7]。在診斷性CT檢查中,輻射劑量可能顯著降低,而診斷圖像質量沒有損失。同樣在射頻消融治療肝臟腫瘤時CT引導應考慮低劑量CT掃描方案,如本文中描述的方案,并且使用的輻射劑量應盡可能低到合理可達到的水平,以成功完成射頻消融治療。在可行的情況下,應首選使用超聲、核磁共振等非離子輻射方式引導來降低患者的輻射劑量。 低劑量掃描技術已成功應用于CT引導下的胸部活檢,人們通過使用超低劑量CT掃描方案而不降低活檢的成功率或患者安全,劑量減少了47%。房達等[8]研究發現采用50mA固定毫安進行掃描可以降低CT引導下微波消融治療肝癌中47.9%的CT劑量,我們的研究實現了肝臟腫瘤消融術平均70.07%的劑量減少率,高于房達等的研究。由于采用根據患者BMI調節千伏的自動毫安進行掃描,更能保證CT圖像質量,低劑量掃描的圖像質量接近4分。且電極針的顯示及操作者信心滿意度與常規劑量相比沒有統計學意義。本研究應用的低劑量掃描方案降低了患者的輻射劑量,但對CT引導下射頻消融治療肝臟腫瘤的操作沒有影響。 研究表明,通過根據患者體重選擇參數來調整CT掃描方案是降低CT輻射劑量的一種可行方法。在以往的研究中,人們將低千伏應用于各種CTA成像,能夠個性化降低患者的輻射劑量,同時保證圖像質量[9,10]。在我們的研究中,我們發現根據患者BMI來調整千伏,更有利于在不降低圖像質量的前提下降低患者的輻射劑量。隨著千伏值的降低,圖像的對比度增強,更有利于電極針的顯示。 基于患者BMI的CT掃描方案修改可以顯著減少CT引導下經皮消融肝臟腫瘤的輻射劑量,而不顯著降低圖像質量和操作者的信心滿意度。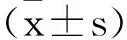
2 結 果
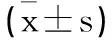
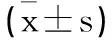
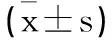
3 討 論

