食管癌患者血清NLR LMR NMR與預后的關系研究
胡俊澤, 謝 權, 馬建偉, 申 彬, 關 麗
(山西省臨汾市中心醫院檢驗科, 山西 臨汾 041000)
食管癌是我國臨床常見的多因素影響引起的食管多基因變異的人類惡性腫瘤,臨床主張手術切除為食管癌患者的主要治療手段[1]。對于早期食管癌患者,手術切除可獲得較好的療效,但對于中晚期食管癌患者,因其具有較高的復發和遠處轉移的特性,通常中晚期患者手術治療效果欠佳[2],造成患者預后不良。因此,如何有效改善患者預后是目前臨床研究的重要問題。中性粒細胞與淋巴細胞比值(neutrophils-lymphocytes ratio,NLR)是反映機體免疫機能的重要指標,對惡性腫瘤疾病的預后評估具有一定的指導意義[3]。既往研究顯示[4],NLR在三陰性乳腺癌患者中表達異常,可用于預測患者預后。淋巴細胞/單核細胞比值(lymphocyte-to-monocyte ratio,LMR)作為將淋巴細胞和單核細胞整合后的新型炎癥標志物,已用于評估多種實體腫瘤患者的預后[5]。中性粒細胞比單核細胞比值(neutrophil-monocyte ratio,NMR) 是中性粒細胞與單核細胞整合之后的新型炎癥指標,而臨床對于NMR的研究較少,并且目前關于血清NLR、LMR、NMR與食管癌患者預后的研究鮮有報道。本研究探討血清NLR、LMR、NMR與食管癌患者預后的關系,以期為臨床治療和診斷患者預后提供新的方向。
1 材料與方法
1.1一般資料:選取2017年1月至2021年1月我院收治的食管癌患者116例作為觀察組,同期選取116例體檢健康人群作為對照組。觀察組男50例,女66例;年齡44~60歲,平均年齡(52.63±4.55)歲;腫瘤分期:Ⅰ期59例,Ⅱ期35例,Ⅲ期22例。對照組男53例,女63例;年齡45~59歲,平均年齡(53.34±4.18)歲。納入標準:食管癌患者均符合《食管癌規范化診治指南》診斷標準[6]:病變局限于黏膜層或黏膜下層,無論由于區域淋巴結轉移;具備手術適應癥;均進行食管癌根治術;初次接受治療;臨床資料完整。排除標準:合并其他惡性腫瘤患者;存在心肺腎重要器官嚴重損傷患者;存在精神疾病患者。對照納入標準:既往身體健康;無炎癥疾病癥狀;無任何心血管功能不全癥狀;臨床資料完整。對照組排除標準:經醫院體檢發現食管病變;存在其他重要器官功能損傷。兩組患者一般資料比較,差異無統計學意義(P>0.05)。
1.2檢測炎性細胞因子:食管癌患者術后,采集空腹靜脈血4mL,采用Sysmex XN-1000血細胞分析儀(南京華仁生物科技有限公司)行血常規檢查,并分析炎性細胞計數,包括白細胞計數(White blood cell count,WBC)、中性粒細胞、淋巴細胞和單核細胞,并分析NLR、LMR和NMR。
1.3食管癌根治術:所有食管癌患者均采取胸腹腔鏡食管癌根治術進行治療,患者均經全身麻醉,保持左側臥位,行單肺通氣,在右側行腹腔鏡根治術將食管病灶去除,術中密切監測患者血壓、脈搏、心率情況。術后留置胸腔引流管,并關閉胸腔,經腹腔行靜脈營養支持。
1.4觀察指標:比較觀察組和對照組患者血清WBC、中性粒細胞、淋巴細胞、單核細胞、NLR、LMR和NMR;比較不同分期患者血清NLR、LMR和NMR;比較預后良好組和預后不良組患者血清NLR、LMR和NMR。采用受試者工作特征曲線(receiver operator characteristic curve,ROC)分析NLR、LMR和NMR水平對食管癌患者預后的預測價值。
1.5統計患者預后情況:統計116例患者術后12個月隨訪情況,采用電話、門診復查等多種方式結合進行隨訪,隨訪頻率為3個月一次,隨訪6個月,患者均完成隨訪,無失訪。預后不良主要包括食管癌癌復發(癌細胞在原來臟器再次產生),轉移(癌細胞轉移到其他位置),分期上升(出現淋巴結轉移,腫瘤細胞侵犯肌層或者發生明顯外侵),并發其他器官轉移及死亡。
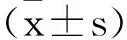
2 結 果
2.1觀察組和對照組外周血炎性細胞水平比較:兩組WBC、中性粒細胞、淋巴細胞水平比較差異無統計學意義(P>0.05)。觀察組單核細胞低于對照組(P<0.05)。見表1。
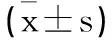
表1 觀察組和對照組外周血炎性細胞水平比較
2.2觀察組和對照組血清NLR、LMR、NMR水平比較:兩組患者NLR比較,差異無統計學意義(P>0.05);觀察組LMR低于對照組,NMR高于對照組(P<0.05)。見表2。
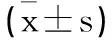
表2 觀察組和對照組血清NLR LMR NMR水平
2.3不同分期患者血清NLR、LMR、NMR水平比較:Ⅰ+Ⅱ期組和Ⅲ期組患者NLR比較,差異無統計學意義(P>0.05),Ⅰ+Ⅱ期組LMR高于Ⅲ期,NMR低于Ⅲ期(P<0.05)。見表3。
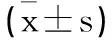
表3 觀察組和對照組外周血T淋巴細胞亞群比較
2.4預后不良組和預后良好組血清NLR、LMR、NMR水平比較:116例食管癌患者發生預后不良32例,發生率為27.85%,預后不良組患者血清NLR、NMR高于預后良好組,LMR低于預后良好組(P<0.05)。見表4。

表4 預后不良組和預后良好組血清
2.5血清NLR、LMR、NMR對食管癌患者預后預測價值:ROC曲線分析結果顯示,血清NLR、LMR、NMR預測食管癌預后AUC分別為0.766、0.799、0.708,P均<0.05;以2.670、4.379、15.896分別為NLR、LMR、NMR的截斷值,三項指標并聯預測患者預后的敏感度為93.75%,特異度為64.29%,聯合預測的敏感度均高于各項指標單獨檢測。見圖1和表5。

圖1 血清NLR、LMR、NMR對食管癌患者預后的ROC曲線

表5 血清NLR LMR NMR對食管癌患者預后預測價值
3 討 論
食管癌主要由于食管鱗狀上皮或腺上皮異常增生造成的病變[7]。其早期發病無明顯特異性,多數患者臨床確診已處于中晚期,錯失手術治療的最佳時機,導致患者治療后病死率及并發癥率較高,嚴重影響患者預后[8]。因此,研究能夠預測食管癌患者預后的有效指標對提高患者生存率意義重大。
近年來大量流行病學研究已證實炎癥與腫瘤發生發展過程密切相關,在腫瘤觸發、轉移及侵襲等生物行為學過程中扮演重要角色,多種炎癥標志物可用于腫瘤預后評估[9]。本研究分析患者生化指標發現,兩組WBC、中性粒細胞、淋巴細胞水平比較差異無統計學意義;而觀察組單核細胞低于對照組。此外,兩組患者NLR比較差異無統計學意義;觀察組LMR低于對照組,NMR高于對照組。淋巴細胞是機體免疫應答功能中重要的執行者,可通過誘導腫瘤細胞凋亡發揮抑癌作用。淋巴細胞低表達表示機體免疫能力較弱,降低對腫瘤細胞清除能力和生長控制能力,臨床表現多與患者預后不良有關[10]。單核細胞不僅可以分泌多種細胞炎癥因子,促成適合腫瘤生長的微環境,加速腫瘤侵襲轉移;還能誘導腫瘤細胞發生免疫逃逸[11]。NLR是反映機體促腫瘤炎癥反應與抗腫瘤免疫反應之間平衡狀態的重要指標,與腫瘤患者的預后不良密切相關[12]。已有研究表明[13],NLR與胃癌、肺癌、宮頸癌等多種惡性腫瘤的預后密切相關。本研究中,兩組患者NLR比較無差異,推測可能是患者病情相對穩定且屬于早期發病,其具體是否存在差異尚需進一研究分析。LMR與NLR類似,可以反映淋巴細胞和單核細胞狀態,可在一定程度上體現機體抗腫瘤免疫與炎癥反應間的動態平衡,再多想研究中證實可用于評估腫瘤患者預后。既往研究顯示[14],低LMR是提示宮頸癌患者預后不良的關鍵指標。本研究結果提示高NMR和低LMR反映機體炎癥反應嚴重,促進腫瘤發生發展。
此外,本研究發現,Ⅰ+Ⅱ期組和Ⅲ期組患者NLR比較差異無統計學意義,Ⅰ+Ⅱ期組LMR高于Ⅲ期,NMR低于Ⅲ期。本研究結果提示,低LMR水平和高NMR水平可能影響食管癌患者病情,促使患者向惡性程度更高的水平轉移,臨床可早期檢測相關指標,及時調整患者治療方案,提高治療效果。本研究隨訪結果發現,116例食管癌患者發生預后不良32例,發生率為27.85%,預后不良組患者血清NLR、NMR高于預后良好組,LMR低于預后良好組。ROC曲線結果顯示,NLR、LMR和NMR對食管癌預后均有良好的預測價值,聯合檢測敏感度均高于各項指標單獨檢測。既往研究顯示[15],宮頸癌根治術前檢測外周血NLR和LMR水平對于宮頸癌預后具有一定預測價值,且NLR預測價值較高。研究結果提示,NLR、LMR和NMR在預測食管癌預后方面具有一定價值。
綜上所述,食管癌患者免疫能力下降,血清NLR、LMR和NMR與食管癌患者預后有關,聯合檢測血清NLR、LMR和NMR水平在診斷食管癌和預測1年預后情況具有重要臨床價值。本文不足在于研究對象均來自同一醫院,缺乏代表性,會存在選擇性偏倚,今后需擴大樣本量探究NLR、LMR和NMR在食管癌患者預后中的價值。

